
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет изменения энергии Гиббса химической реакции при нестандартной температуре
|
|
|
|
Расчет изменения энергии Гиббса химической реакции при стандартной температуре
Расчет изменений энергии Гиббса химической реакции при стандартной температуре (298 К) может быть осуществлен при наличии соответствующих справочных данных по изменениям стандартных потенциалов образования веществ  , участвующих в химической реакции с использованием следующего уравнения:
, участвующих в химической реакции с использованием следующего уравнения:
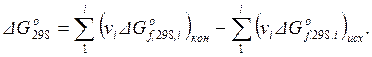 (1.42)
(1.42)
Стандартное изменение энергии Гиббса образования простых устойчивых веществ равно нулю.
Другим методом расчета стандартного изменения энергии Гиббса химической реакции является применение уравнения Гиббса-Гельмгольца:
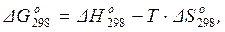 (1.43)
(1.43)
где Т = 298 К; 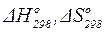 – стандартное изменение энтальпии (стандартный тепловой эффект при P = const) и стандартное изменение энтропии, которые рассчитываются по формулам (1.17) или (1.18) и (1.38) соответственно.
– стандартное изменение энтальпии (стандартный тепловой эффект при P = const) и стандартное изменение энтропии, которые рассчитываются по формулам (1.17) или (1.18) и (1.38) соответственно.
Расчет изменений энергии Гиббса химической реакции при нестандартной температуре обычно производят по уравнению Гиббса-Гельмгольца:
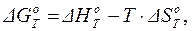 (1.44)
(1.44)
где Т – температура реакции; 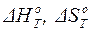 – изменение энтальпии (тепловой эффект при P = const) и изменение энтропии для данной реакции при температуре Т, которые точно рассчитываются по формулам (1.25) или (1.26) и (1.39) или (1.40), соответственно. В этом случае развернутая формула для расчета изменения энергии Гиббса химической реакции может быть записана следующим образом:
– изменение энтальпии (тепловой эффект при P = const) и изменение энтропии для данной реакции при температуре Т, которые точно рассчитываются по формулам (1.25) или (1.26) и (1.39) или (1.40), соответственно. В этом случае развернутая формула для расчета изменения энергии Гиббса химической реакции может быть записана следующим образом:
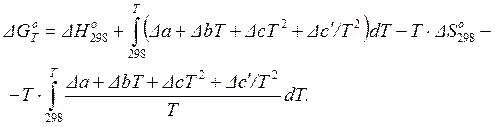 (1.45)
(1.45)
При приближенных расчетах можно использовать допущение, что изменения энтальпии и энтропии не зависят от температуры, и в расчетах применять их стандартные значения, найденные для температуры 298 К:
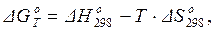 (1.46)
(1.46)
где Т – температура реакции, для которой выполняется приближенный расчет.
При отсутствии фазовых переходов для точного расчета стандартного изменения энергии Гиббса при температуре Т (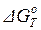 ) можно применять формулу Темкина–Шварцмана, полученную после интегрирования, выполнения действий, приведения подобных в основной формуле (1.45) и введения величин коэффициентов Мn, зависящих только от температуры:
) можно применять формулу Темкина–Шварцмана, полученную после интегрирования, выполнения действий, приведения подобных в основной формуле (1.45) и введения величин коэффициентов Мn, зависящих только от температуры:
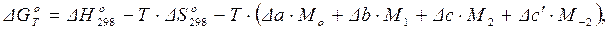 (1.47)
(1.47)
где Т – температура, при которой протекает реакция; Δa, Δb, Δc, Δc΄ – коэффициенты при Т в соответствующих степенях, полученные при расчете ΔСP; Mo, M1, M2, M –2 – коэффициенты при Δa, Δb, Δc, Δc΄,соответственно, которые для заданной температуры приводятся в справочной литературе для указанного метода расчета.
П р и м е р 1.15. Рассчитать приближенно и точно изменение энергии Гиббса следующей химической реакции при Т = 298 К и Т = 1800 К и определить возможность ее протекания при данных температурах:
TiO2 + 2H2 = Ti + 2H2O.
кр. газ кр. газ
Необходимые справочные данные представлены в табл. 1.10.
Таблица 1.10
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 8620; Нарушение авторских прав?; Мы поможем в написании вашей работы!