
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы электролиза Фарадея и их применение для расчета количественных характеристик процесса электролиза
|
|
|
|
Тогда
 , (3.53)
, (3.53)
а сама константа равновесия:
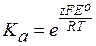 . (3.54)
. (3.54)
П р и м е р 3.11. Рассчитать потенциал кадмиевого электрода, опущенного в водный раствор сульфата кадмия с активностью ионов кадмия 0,015, при температуре 30 ОС (303 К). 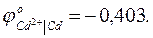
Р е ш е н и е
Электродная реакция может быть записана следующим образом:
Cd2+ + 2 e – ↔ Cd.
Количество электронов, участвующих в данной электродной реакции, z = 2.
Равновесный электродный потенциал рассчитываем по уравнению Нернста:
 ,
,

П р и м е р 3.12. Рассчитать ЭДС гальванического элемента, составленного из полуэлементов Zn2+│Zn и Cu2+│Cu при температуре 20 оС, если активности ионов цинка и меди равны 0,1 и 0,05, соответственно.
Р е ш е н и е
Zn – 2 e – ↔ Zn2+; 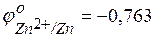 В,
В,
Cu2+ + 2 e – ↔ Cu;  .
.
Находим стандартную ЭДС:
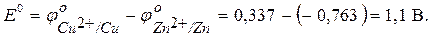
Для данного гальванического элемента z = 2; T = 293 K.
ЭДС гальванического элемента рассчитываем по уравнению (3.39):
 .
.
П р и м е р 3.13. Как должен быть записан гальванический элемент, состоящий из хлорсеребряного и каломельного электродов, в котором протекает следующая химическая реакция:
2Ag + Hg2Cl2 ↔ 2 AgCl + 2 Hg.
Чему равна стандартная ЭДС этого элемента?
Р е ш е н и е
При работе гальванического элемента серебро окисляется, а ртуть восстанавливается:
2 Ag – 2 e– → 2 Ag+ (ионы переходят в раствор)
2 Hg+ + 2 e– → 2 Hg,
следовательно, хлорсеребряный электрод – отрицательный, а каломельный является положительным электродом. Поэтому гальванический элемент должен быть записан следующим образом:
Ag│AgCl, KCl║ KCl, Hg2Cl2│Hg.
Стандартные потенциалы электродных реакций:
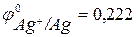 В,
В,  В.
В.
Стандартная ЭДС гальванического элемента:
 В.
В.
П р и м е р 3.14. Написать химическую реакцию, протекающую в данном гальваническом элементе в стандартных условиях:
Pt│H+, MnO4–, Mn2+ ║ Co3+, Co2+│Pt.
Р е ш е н и е
В таблице стандартных потенциалов находим потенциалы электродных реакций, соответствующих данному гальваническому элементу:
MnO4– + 8 H + + 5 e– ↔ Mn2+ + 4 H2O; 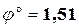 В;
В;
Co3+ + e – ↔ Co2+;  В.
В.
Так как при записи гальванического элемента сначала указывается более отрицательный электрод, на котором происходит окисление, следовательно, эта запись соответствует окислению ионов марганца Mn2+ и восстановлению ионов кобальта Co3+.
Тогда протекающая в элементе реакция должна быть записана следующим образом:
5Co3+ + Mn2+ + 4 H2O = 5 Co2+ + 8 H+ + MnO4–.
П р и м е р 3.15. Для химической реакции
Pb + Hg2Cl2 = PbCl2 + 2 Hg,
протекающей обратимо в гальваническом элементе, зависимость ЭДС от температуры описывается уравнением E = 0,5353 + 1,45·10–4 Т. Рассчитать при температуре 298 К ЭДС гальванического элемента, изменение энергии Гиббса, изменение энтропии, изменение энтальпии и количество теплоты, которое будет поглощаться в этом процессе.
Р е ш е н и е
Находим ЭДС гальванического элемента, подставляя в известное уравнение зависимости Е = f(T) заданную температуру:
E = 0,5353 + 1,45·10–4 · 298 = 0,5353 + 0,0432 = 0,5785 B.
В гальваническом элементе будут происходить следующие реакции:
Pb – 2 e– = Pb2+ (окисление); 2 Hg+ + 2e– = 2Hg (восстановление); z = 2.
Рассчитываем изменение энергии Гиббса по формуле (3.43)
∆G = – z · F · E = – 2 · 96485 · 0,5785 = – 111633 Дж/моль.
Температурный коэффициент ЭДС находим, дифференцируя по температуре известное из условия уравнение зависимости Е = f(T):
 = 1,45·10–4 В/K.
= 1,45·10–4 В/K.
Изменение энтропии находим по формуле (3.45):
 .
.
Изменение энтальпии ∆H рассчитываем по формуле (3.48):
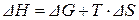 = – 111633 + 298 · 27,98 = – 103295 Дж/моль.
= – 111633 + 298 · 27,98 = – 103295 Дж/моль.
Рассчитываем связанную энергию процесса:
T ·ΔS = 298 · 27,98 = 8338 Дж/моль.
Так как  > 0, то такое количество энергии будет поглощаться при работе гальванического элемента.
> 0, то такое количество энергии будет поглощаться при работе гальванического элемента.
П р и м е р 3.16. Рассчитать константу равновесия при стандартных условиях следующей окислительно-восстановительной реакции:
Zn + 2 HCl ↔ ZnCl2 + H2.
Р е ш е н и е
Данная реакция может быть осуществлена в следующем гальваническом элементе:
Zn│ZnCl2║H+│H2, Pt.
Уравнения полуреакций и соответствующие им стандартные потенциалы, значения которых взяты из справочной таблицы, выглядят так:
2 H+ + 2 e – ↔ H2;  В;
В;
Zn2+ + 2 e – ↔ Zn;  В.
В.
Тогда стандартная ЭДС гальванического элемента определяется следующим образом:
 В.
В.
Константу равновесия рассчитываем, используя уравнения (3.53) и (3.54):
 ;
;  .
.
Высокое значение константы равновесия свидетельствует о практической необратимости реакции вытеснения водорода цинком при стандартной температуре.
П р и м е р 3.17. Может ли железо вытеснить медь из раствора сульфата меди? Чему равна константа равновесия этой реакции при стандартной температуре?
Р е ш е н и е
Уравнение окислительно-восстановительной реакции выглядит так:
Fe + Cu2+ ↔ Fe2+ + Cu.
Полуреакции и соответствующие им стандартные потенциалы определяется так:
Fe2+ + 2 e – ↔ Fe; 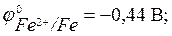
Cu2+ + 2 e – ↔ Cu; 
При протекании данной реакции в гальваническом элементе:
Fe│FeSO4║CuSO4│Cu
его стандартная ЭДС находится из уравнения

Константу равновесия рассчитываем, используя уравнения (3.53) и (3.54):

Значение константы равновесия показывает, что процесс вытеснения меди из раствора железом протекает при стандартной температуре практически полностью.
Электролизом называется совокупность электрохимических окислительно-восстановительных реакций, протекающих на электродах при прохождении постоянного электрического тока через раствор или расплав электролита. При этом на катоде происходит процесс восстановления, а на аноде – окисления. Катионы восстанавливаются в ионы более низкой степени окисления или в атомы, например:
Fe3+ + e – → Fe2+; (3.55)
Cu2+ + 2 e – → Cu. (3.56)
Нейтральные молекулы могут участвовать в превращениях на катоде непосредственно или взаимодействовать с продуктами катодного процесса, которые рассматриваются в этом случае как промежуточные вещества. Например, восстановление воды:
2 H2O + 2 e – → H2 + 2 OH–. (3.57)
На аноде окисляются ионы или молекулы, поступающие из объема электролита, например:
4 OH– – 4 e – → 2 H2O + O2; (3.58)
2 Cl– – 2 e – → Cl2,– (3.59)
или принадлежащие материалу анода. в последнем случае анод растворяется, например:
Cu – 2 e – → Cu2+ (растворение медного анода). (3.60)
Протекание электродных реакций зависит от состава и концентрации электролита, материала электродов, электродного потенциала, температуры, гидродинамических условий.
Процессы электролиза описываются законами Фарадея, которые в объединенной форме читаются следующим образом: массы веществ, испытавших электрохимические превращения на электродах, прямо пропорциональны количеству протекшего через электролит электричества и электрохимическим эквивалентам этих веществ:

 (3.61)
(3.61)
где m – масса вещества, превратившегося на электроде (выделившегося на электроде),
 электрохимический эквивалент – величина характеризующая массу продуктов электролиза, выделившихся на электродах при прохождении через электролит 1 Кл электричества;
электрохимический эквивалент – величина характеризующая массу продуктов электролиза, выделившихся на электродах при прохождении через электролит 1 Кл электричества;
Э – химический эквивалент вещества (эквивалентная масса вещества) при окислительно-восстановительном превращении, г/экв;
q – количество прошедшего электричества, Кл;
F – число Фарадея (96485 Кл/г-экв) – количество электричества, необходимое для химического превращения (выделения на электроде) 1 г-экв вещества.
Так как q = I · τ (I – сила тока, А; τ – продолжительность электролиза, с), то уравнение закона Фарадея может быть записано следующим образом:
 (3.62)
(3.62)
Химический эквивалент вещества (эквивалентная масса вещества) при окислительно-восстановительном превращении рассчитывается по формуле:
 , (3.63)
, (3.63)
где М – молярная масса вещества, претерпевающего превращение на электроде, г/моль;
n – количество электронов, участвующих в одном акте химического превращения.
По законам Фарадея (3.61) и (3.62) рассчитываются теоретически возможные количества превращающихся веществ на электродах. На практике при электрохимических процессах наблюдаются отклонения от законов Фарадея: масса действительно полученного или разложившегося продукта может не соответствовать теоретической. Эти отклонения – кажущиеся и возникают за счет одновременного протекания побочных электрохимических процессов; химических реакций, в которые вступает продукт; потерь продукта и потерь электроэнергии на преодоление сопротивления электролизера. Эффективность электрохимического процесса оценивается выходом по току Вт:
 (3.64)
(3.64)
Эта величина может быть выражена в процентах:
 . (3.65)
. (3.65)
Тогда практическое количество вещества, образующееся при электролизе рассчитывается по формуле:
 . (3.66)
. (3.66)
П р и м е р 3.18. Какое количество алюминия выделится при электролизе за время 12 ч, если сила тока I = 2,5 A, а выход по току составляет 88 %. Молярная масса алюминия М, равная его грамм-атомной массе А, составляет 26,98 г/моль.
Р е ш е н и е
Выделение алюминия при электролизе происходит на катоде при прохождении следующей реакции восстановления:
Al3+ + 3 e – = Al; n = 3.
Химический эквивалент алюминия рассчитываем по формуле (3.62):
Э = М / 3 = 26,98 / 3 = 8,99 г/экв.
Продолжительность электролиза τ = 12 час = 12 · 3600 = 43200 с.
По объединенному закону Фарадея (3.62) находим теоретическое количество алюминия, выделяющееся при электролизе в указанных условиях:
 г.
г.
Практическое количество выделившегося при электролизе алюминия находим с учетом величины ВТ по формуле (3.66):

П р и м е р 3.19. Определить время, необходимое для выделения при электролизе 1,2 г меди, если сила тока I = 2 A, а выход по току ВТ = 96 %.
Р е ш е н и е
На основании формулы (3.66) находим, на какое теоретическое количество меди необходимо рассчитывать продолжительность электролиза:

Выделение меди при электролизе происходит на катоде при прохождении следующей реакции восстановления:
Сu2+ + 2 e – = Cu; n = 2.
Химический эквивалент меди рассчитываем по формуле (3.63):
Э = М / 2 = 63,54 / 2 = 31,77 г/экв.
Из уравнения закона Фарадея (3.62) находим время процесса:

- ХИМИЧЕСКАЯ КИНЕТИКА
Химическая кинетика – раздел физической химии, в котором рассматривается зависимость скорости химической реакции от концентрации реагентов, температуры, свойств среды и других факторов.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 2294; Нарушение авторских прав?; Мы поможем в написании вашей работы!