
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи для самостоятельного решения
|
|
|
|
Р е ш е н и е
Находим из уравнения (4.12) температурный коэффициент реакции:
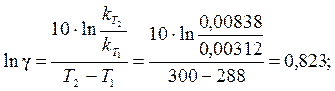
 .
.
Находим константу скорости реакции при температуре Т3 с применением уравнения (4.12):

Рассчитываем энергию активации по уравнению (4.15)


Находим константу скорости реакции при 308 К, используя уравнение (4.14), подставляя в него соответствующие пары значений k и Т:

П р и м е р 4.7. Для химической реакции первого порядка, проходящей при температуре 313,2 К, константа скорости ( ) составляет 0,026 мин–1, энергия активации 57,8 кдж/моль. Рассчитать константу скорости данной реакции при температуре 330 К (
) составляет 0,026 мин–1, энергия активации 57,8 кдж/моль. Рассчитать константу скорости данной реакции при температуре 330 К ( ) и определить концентрацию исходного вещества при данной температуре через 15 минут ее прохождения, если начальная концентрация реагента составляла 0,5 моль/л.
) и определить концентрацию исходного вещества при данной температуре через 15 минут ее прохождения, если начальная концентрация реагента составляла 0,5 моль/л.
Р е ш е н и е
Из уравнения (4.14), подставляя в него известные значения константы, энергии активации и температур находим  :
:

 .
.
Из уравнения для реакции первого порядка находим концентрацию исходного вещества в заданный момент времени:
lnc = lnco – k·τ = ln 0,5 – 0,0816 · 15 = –0,693 – 1,224 = –1,917;
c = e –1,917 = 0,147 моль/л.
5.1. Задачи к главе “Основные положения химической термодинамики и ее приложение для расчета равновесий”
З а д а ч а 1. Рассчитать количество теплоты, которое необходимо для нагревания вещества А, взятого в количестве g от температуры T1 до температуры Т2 при P = const (изменение энтальпии при нагревании) (табл. 5.1), используя стандартную теплоемкость, среднюю теплоемкость данного вещества в указанном интервале температур, а также с учетом зависимости его теплоемкости от температуры.
Таблица 5.1.
| Вариант | Вещество А | g, кг | T1, К | Т2, К |
| Ag (серебро, кр.) | 1,5 | |||
| Al (алюминий, кр.) | 500,0 | |||
| Cu (медь, кр.) | 2,0 | |||
| Ni (никель, кр.) | 12,0 | |||
| CaO (оксид кальция, кр.) | 450,0 | |||
| MgCO3 (карбонат магния, кр.) | 200,0 |
З а д а ч а 2. Рассчитать стандартный тепловой эффект по теплотам образования веществ и изменение внутренней энергии (P = const) при прохождении химических реакций, указанных в табл. 5.2.
Таблица 5.2
| Вариант | Химическая реакция |
| MgCO3 = MgO + CO2 кр. кр. газ | |
| CaCO3 = CaO + CO2 кр. кр. газ | |
| CH4 + 2 O2 = CO2 + 2 H2O газ газ газ газ | |
| СO + 0,5 O2 = CO2 газ газ газ | |
| CO2 + C = 2 CO газ графит газ | |
| 2 СaC2 + 3 O2 = 2 CaO + 4 CO кр.-α газ кр. газ | |
| FeO + C = Fe + CO кр. графит кр.-α газ |
З а д а ч а 3. Рассчитать стандартный тепловой эффект получения 50 г ацетилена по следующей химической реакции:
СaC2 + 2 H2O = Ca(OH)2 + C2H2.
кр. ж. кр. газ
З а д а ч а 4. Рассчитать, какое количество теплоты выделится при окиcлении 0,5 кг монооксида углерода в стандартных условиях:
2 СO + O2 = 2 CO2.
газ газ газ
З а д а ч а 5. Рассчитать тепловой эффект химических реакций (P = const), приведенных в таблице, при получении вещества А в количестве g при температуре Т, используя справочные значения энтальпий образования и средние значения изобарных теплоемкостей веществ в соответствующем интервале температур.
Таблица 5.3.
| Вариант | Химическая реакция | Вещество А | g, кг | Т, К |
| CaCO3 = CaO + CO2 кр. кр. газ | CaO | |||
| СaC2 + 2 H2O = Ca(OH)2 + C2H2 кр. ж кр. газ | С2H2 | 1,5 | ||
| C2H6 = C2H4 + H2 газ газ газ | С2H4 | |||
| С2H4 + 3 O2 = 2 CO2 + 2 H2O газ газ газ ж | СO2 | 0,2 | ||
| FeO + C = Fe + CO кр. графит кр.-α газ | Fe | 10,0 |
З а д а ч а 6. Рассчитать изменение энтропии (ΔS) при нагревании вещества А, взятого в количестве g, от температуры T1 до температуры Т2 при P = const, учитывая зависимость его мольной теплоемкости от температуры.
Таблица 5.4
| Вариант | Вещество А | g, кг | T1, К | Т2, К |
| Ag (серебро, кр.) | 0,3 | |||
| Al (алюминий, кр.) | 1000,0 | |||
| Cu (медь, кр.) | 5,0 | |||
| Fe-α (железо, кр.) | 20,0 | |||
| СO (монооксид углерода, газ) | 2,0 | |||
| MgO (оксид магния, кр.) | 10,0 | |||
| СаCO3 (карбонат кальция, кр.) | 200,0 | |||
| C2H2 (ацетилен, газ) | 1,5 | |||
| С (графит) | 0,5 | |||
| Zn (цинк, кр.) | 1,0 |
З а д а ч а 7. Рассчитать стандартное изменение энтропии химических реакций, приведенных в табл. 5.5.
Таблица 5.5
| Вариант | Химическая реакция |
| СaC2 + 2 H2O = Ca(OH)2 + C2H2. кр. ж. кр. газ | |
| CaCO3 = CaO + CO2 кр. кр. газ | |
| C2H5ОH + 2 O2 = CO2 + 2 H2O (этиловый спирт, газ) газ газ газ | |
| 2 СO + 2 H2 = CO2 + CH4 газ газ газ газ | |
| CO2 + C = 2 CO газ графит газ | |
| C2H4 + H2O = C2H5ОH газ газ (этиловый спирт, газ) | |
| FeO + CO = Fe + CO2 кр. газ кр.-α газ |
З а д а ч а 8. Рассчитать изменение энергии Гиббса химических реакций, приведенных в табл. 5.6, при Т = 298 К и приближенным методом при температуре Т. Определить возможность их протекания при данных температурах (P = const).
Таблица 5.6
| Вариант | Химическая реакция | Температура Т, K |
| Fe3O4 + 4 H2 = 3 Fe + 4 H2O кр. газ кр.-α газ | ||
| FeO + CO = Fe + CO2 кр. газ кр.-α газ | ||
| FeO + C = Fe + CO кр. графит кр.-α газ | ||
| Fe + H2O = FeO + H2 кр.-α газ кр. газ | ||
| SnO2 + 2 CO = 2 CO2 + Sn кр. газ газ кр. |
З а д а ч а 9. Рассчитать изменение энергии Гиббса и константу равновесия химических реакций, проходящих в газовой фазе (табл. 5.7), при температуре Т по методу Темкина-Шварцмана.
Таблица 5.7
| Вариант | Химическая реакция | Температура Т, K |
| 2 SO2 + O2 = 2 SO3 | ||
| 2 NO + O2 = 2 NO2 | ||
| 2 CO2 = 2 CO + O2 | ||
| CO + 2 H2 = CH3OH | ||
| 2 CO + 2 H2 = CH4 + CO2 |
З а д а ч а 10. Давления насыщенного пара алюминия при двух температурах представлены в табл. 5.8. Определить теплоту испарения алюминия и температуру кипения алюминия при 560 мм рт. ст.
Таблица 5.8
| Температура, К | ||
| Р, мм. рт. ст. | 0,67 | 29,8 |
З а д а ч а 11. Давление насыщенного пара жидкого нафталина равно 10 мм рт. ст. при 85,8 оС и 40 мм рт. ст. при 119,3 оС. Определить энтальпию испарения, температуру кипения при нормальном атмосферном давлении (760 мм рт. ст.) и энтропию испарения в нормальной точке кипения.
З а д а ч а 12. Рассчитать теплоту испарения неполярного растворителя бензола, если его температура кипения при нормальном атмосферном давлении равна 80,1 оС.
З а д а ч а 13. Рассчитать давление насыщенного пара толуола при 60 оС, если известны давления насыщенного пара при двух температурах (табл. 5.9):
Таблица 5.9
| Температура, оС | 51,9 | 89,5 |
| Р, кПа | 13,33 | 53,33 |
5.2. Задачи к главе “Свойства растворов”
З а д а ч а 14. Раствор 60 % (по массе) ортофосфорной кислоты H3PO4 в воде при 20 оС имеет плотность 1426 кг/м3 (1426 г/см3). Определить молярность, моляльность этого раствора и мольную долю ортофосфорной кислоты в растворе.
З а д а ч а 15. Рассчитать моляльность 15 % раствора серной кислоты в воде и определить ее мольную долю в растворе.
З ад а ч а 16. Какое количество едкого натрия (NaOH) и воды необходимо взять для приготовления 10 л раствора 20 % концентрации, если плотность такого растовра составляет 1,219 кг/л.
З а д а ч а 17. В жидком доменном ферросилиции содержится 11,2 % Si, 1,5 % Си 87,3 % Fe. Определить мольную долю каждого компонента в расплаве.
З а д а ч а 18. Этанол C2H5OH и метанол CH3OH при смешении образуют почти идеальные растворы. При 20 оС давление пара этанола равно 5,93 кПа, а метанола – 11,83 кПа. Рассчитать давление пара раствора, состоящего из 100 г этанола и 100 г метанола.
З а д а ч а 19. Вычислить температуру кипения раствора, содержащего 20 г хлорида бария BaCl2 в 1000 г воды. Степень диссоциации α = 75 %. Эбулиоскопическая константа воды 0,516 град.
З а д а ч а 20. Чему равна температура замерзания раствора, содержащего 1 г нитробензола C6H5NO2 в 25 г бензола. Температура замерзания чистого бензола 6 оС. Криоскопическая константа бензола равна 5,16 град.
З а д а ч а 21. Раствор 8,6 г нитрата натрия NaNO3 в 100 г воды замерзает при (– 3,04) оС. Рассчитать степень диссоциации этой соли в данном растворе. Криоскопическая константа воды равна 1,86 град.
5.3. Задачи к главе “Электрохимия”
З а д а ч а 22. Рассчитать концентрацию раствора слабого электролита AgOH, если степень его диссоциации равна 0,02, а константа диссоциации Кд = 1,1· 10-4.
З а д а ч а 23. Определить константу диссоциации слабой кислоты, если в растворе концентрацией 0,0125 г-экв/л (моль/л) она имеет степень диссоциации 4,2 %.
З а д а ч а 24. Вычислить рН раствора уксусной кислоты концентрации 0,25 моль/л..Константа диссоциации кислоты 1,86·10-5.
З а д а ч а 25. Вычислить рН раствора гидроксида цинка концентрации 0,15 моль/л. Константа диссоциации основания 1,5·10-9.
З а д а ч а 26. Рассчитать эквивалентную электрическую проводимость раствора концентрации 0,025г-экв/л, помещенного в ячейку с расстоянием между электродами 0,8 см и поверхностью каждого электрода 0,8 см2, если сопротивление раствора составляет 1020 Ом.
З а д а ч а 27. Определить постоянную измерительной ячейки К, если раствор концентрации 0,01 г-экв/л имеет эквивалентную электрическую проводимость 350 Ом-1·г-экв-1·см2, а сопротивление этого раствора составляет 250 Ом.
З а д а ч а 28. Сопротивление раствора концентрации 0,125 г-экв/л составляет 260 Ом. Постоянная измерительной ячейки равна 0,54 см-1. Рассчитать удельную и эквивалентную электрическую проводимость раствора.
З а д а ч а 29. Определить степень диссоциации и константу диссоциации одно-одновалентного слабого электролита, если при его концентрации 1,59·10-4 моль/л эквивалентная электрическая проводимость раствора составляет 12,77 Ом-1см2/г-экв, а  390,7 Ом-1см2/г-экв.
390,7 Ом-1см2/г-экв.
З а д а ч а 30. Рассчитать потенциал медного электрода, опущенного в водный раствор сульфата меди с активностью ионов меди 0,01, при температуре 25 оС.
З а д а ч а 31. Рассчитать потенциал цинкового электрода, опущенного в водный раствор сульфата цинка с активностью ионов цинка 0,05, при температуре 30 оC.
З ад а ч а 32. Рассчитать электродвижущую силу гальванического элемента, составленного из медного и кадмиевого электродов, опущенных в раствор своих солей, если моляльность раствора сульфата меди 1 моль/1000 г, а моляльность раствора сульфата кадмия 0,01 моль/1000 г. Температура – стандартная.
З а д а ч а 33. Рассчитать константу равновесия при стандартных условиях окислительно-восстановительной реакции:
Zn + Cd 2+ ↔ Zn2+ + Cd.
З а д а ч а 34. Количество никеля, выделившееся при электролизе равно 1,5 г, ВТ = 91,5%. Определить количество электричества, затраченное на электролиз.
З а д а ч а 35. При электролизе CuSO4 за время 2,5 ч, при силе тока 1,5 A на катоде выделилось 4,12 г меди. Чему равен выход по току?
З а д а ч а 36. Какое количество никеля выделилось из раствора, содержащего Ni 2+ , за время 0,5 ч при силе тока 1,5 A, если ВТ = 92%.
З а д а ч а 37. Какое количество электричества необходимо для выделения на катоде 2 г серебра, если выход по току составляет 84 %.
5.4. Задачи к главе “Химическая кинетика”
З а д а ч а 38. Константа скорости реакции разложения вещества первого порядка равна 2,2·10–5 с–1 при температуре 320 оС. Рассчитать, какой процент вещества разложится в течение 2 часов при данной температуре.
З а д а ч а 39. Начальные концентрации исходных веществ реакции второго порядка были равны между собой и составляли 0,02 моль/л. Через 30 мин концентрация каждого из реагентов составила 0,011 моль/л. Рассчитать константу скорости данной реакции и концентрации реагентов за время 1 час.
З а д а ч а 40. Бимолекулярная реакция, для которой исходные концентрации реагентов равны между собой, протекает за 10 мин на 25 %. Сколько потребуется времени для того, чтобы реакция прошла на 50 % при той же температуре?
З а д а ч а 41. Вещество А смешано с В и С в равных концентрациях (С0= 1 моль/л). Через 1000 с осталось 50 % вещества А. Сколько вещества А останется через 2000 с, если реакция имеет третий порядок?
З а д а ч а 42. Определить энергию активации и константу скорости реакции:
Cu + (NH4)2S2O8 = CuSO4 + (NH4)2SO4
при температуре 340 оС, если известны константы скорости при двух температурах (табл. 5.9).
Таблица 5.10
| Температура, К | 293,2 | 313,2 |
| К · 103, л/(моль· мин) | 9,6 | 18,16 |
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 921; Нарушение авторских прав?; Мы поможем в написании вашей работы!