
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экспериментальная часть
|
|
|
|
Оксокислоты
Получение
Кетокислоты
СН3 – С(О) – СООН - α-оксопропионовая (пировиноградная) кислота
Бесцветная жидкость с резким запахом уксуса, растворяется в воде, эфире, спирте.
1) Перегонка винной кислоты над KHSO4

2) Окисление молочной кислоты

3) Гидролиз дигалогенпроизводных пропионовой кислоты

Как кислота она значительно сильнее, чем α-гидроксикислоты (электроотрицательное влияние карбонила). Дает характерные реакции кетонов и карбоновых кислот:

Является важным промежуточным продуктом, связывающим превращения углеводов, белков, липидов (цикл трикарбоновых кислот), применяется в производстве лекарственных препаратов (цинхофен).
β-Оксокислоты среди оксокислот имеют наибольшее практическое значение. Особенности их химических свойств обусловлены наличием сильного СН-кислотного центра, возникновение которого связано с β-расположением функциональных групп.
СН3 – С(О) – СН2 – СООН – ацетоуксусная (β-оксомасляная) кислота
β-Оксокислоты и их соли термически нестабильны, при небольшом нагревании декарбоксилируются, что обусловлено образованием шестизвенного переходного состояния с низкой энергией
СН3 – С(О) – СН2 – СООН → СН3 – С(О) – СН3 + СО2
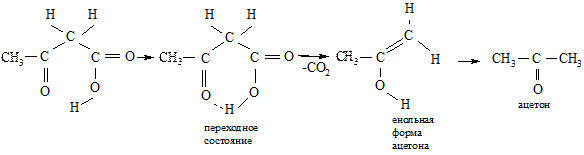
Важную роль в органическом синтезе играет ацетоуксусный эфир – жидкость с приятным своеобразным запахом, не растворима в воде, растворяется в спирте и эфире.
Является классическим примером соединения, способного к кето-енольной таутомерии

Обе формы могут быть получены в свободном виде, однако они не устойчивы и легко превращаются в равновесную смесь с содержанием енола менее 10%. Чем более полярен растворитель, тем больше содержание кетонной формы. В воде содержание енола 0,4 %, в этаноле – 12%.
Ацетоуксусный эфир обладает высокой реакционной способностью.
В химических превращениях он ведет себя как кетон и как енол.
Реакции кетонной формы:
1. Восстановление:
СН3 – С(О) – СН2 – СООС2Н5 + 2 [H] → CH3 – CH(ОН) – CH2 – COOC2H5
2. Реакция с синильной кислотой HCN
CH3 – C(О) – CH2 – COOC2H5 + HCN → CH3 – C(ОН) (СN) – CH2 – COOC2H5
этиловый эфир β-гидрокси-β-цианомасляной кислоты
Реакции енольной формы
1. О-Ацилирование
 СН3 –С(ОН) =СН–СООС2Н5 +СН3 – СОCl → CH3 – C = CH – COOC2H5 + HCl
СН3 –С(ОН) =СН–СООС2Н5 +СН3 – СОCl → CH3 – C = CH – COOC2H5 + HCl
O – COCH3
2. С PCl5
CH3–C(ОН)=CH – COOC2H5 + PCl5 → CH3 – C(Cl) = CH–COOC5H5 +POCl3 + HCl
3. Качественный пробой для обнаружения енольной формы ацетоуксусного эфира служит реакция с хлоридом железа (III), приводящая к появлению вишневого окрашивания реакционной смеси. С FeCl3 дает фиолетовую окраску, образуя комплексную соль.
4. Образование натрийацетоуксусного эфира
СН3 – С(ОН) = СН – СООС2Н5 + Na →CH3 – C(ONa)= CH – COOC2H5 + ½ H2
4. Расщепление по С-С связям
Разбавленные щелочи или кислоты вызывают кетонное (I) расщепление, а концентрированные (II) – кислотное:
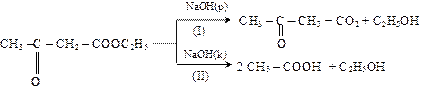
На основе ацетоуксусного эфира разработаны методы синтеза кетонов, карбоновых и дикарбоновых кислот

Большое биологическое значение имеют α-кетокарбоновые кислоты.
Мезоксалевая (кетомалоновая) кислота НООС–С(О)–СООН существует только в виде гидрата

Получается при гидролизе ее уреида – аллоксана (образуется в организме при сахарном диабете), окислении малоновой или мочевой кислот. Легко разлагается в водном растворе на глиоксалевую кислоту и СО2; обладает сильным восстановительным свойствами.
Щавелевоуксусная (α-кетоянтарная) кислота
HOOC – C(О) – CH2 – COOН
неустойчива, в чистом виде существует исключительно в виде – гидроксималеиновой и гидроксифумаровой кислот. В растворах устанавливается равновесие между стереоизомерными енолами и кетоформой. Играет важную роль в углеводном обмене в живых организмах является метаболитом, участвующим в цикле Кребса.

Качественные реакции
Опыт № 1. Качественная реакция на молочную кислоту (реакция Уфельмана).
В пробирку взять 3–4 капли фенола, добавить 1 каплю хлорида железа (III). К полученному феноляту железа добавить 1 каплю молочной кислоты. Какое окрашивание наблюдаете? Напишите уравнения химических реакций.
Опыт № 2. Декарбоксилирование салициловой кислоты и обнаружение продуктов реакции.
В сухую пробирку насыпать немного салициловой кислоты (прикрыть дно пробирки), надеть газоотводную трубку, конец трубки опустить в пробирку с 5 каплями известковой воды Са(ОН)2. Нагреть салициловую кислоту. Что наблюдается? Напишите уравнения соответствующих реакций.
Разобрать прибор, снять газоотводную трубку, капнуть в пробирку 2 капли FeCl3. Какое наблюдается окрашивание? Почему?
Опыт № 3. Доказательства наличия двух карбоксильных групп в винной кислоте.
В пробирку поместите 1 каплю 15% раствора винной кислоты, 2 капли 5% раствора КОН, встряхните! Охладите под струей воды. Что наблюдаете? Добавьте еще в пробирку 4-5 капель КОН.
Запишите уравнения реакций полученной кислой и средней солей виной кислоты.
Опыт № 4. Получение пировиноградной кислоты и доказательства ее образования.
Налейте в пробирку 1–2 мл молочной кислоты и столько же 10% раствора KMnO4, нагрейте. После того, как исчезнет окраска перманганата, прибавьте лопаточку 2,4-динитрофенилгидразина. Нагрейте смесь на водяной бане 15–20 минут. После охлаждения выпадет желтый осадок 2,4-динитрофенилгидразона пировиноградной кислоты. Напишите уравнения реакций.
Опыт № 5. Получение натриевого производного ацетоуксусного эфира.
В сухую пробирку поместите 3-4 капли ацетоуксусного эфира и добавьте кусочек металлического натрия, выделяются пузырьки водорода. Напишите уравнение реакции.
Опыт № 6. Обнаружение кислотных свойств ацетоуксусного эфира.
Смешайте в пробирке 2-3 капли воды и 1 каплю фенолфталеина и прибавьте 1 каплю 2н NaOH. Раствор при этом окрасится в красный цвет. Добавьте 2-3 капли ацетоуксусного эфира – окраска исчезнет. Напишите уравнения реакции.
Опыт № 7. Кетонное расщепление ацетоуксусного эфира.
В пробирку с газоотводной трубкой налейте 2 мл ацетоуксусного эфира и 1 мл 2н H2SO4 и нагрейте. Трубку опустите в пробирку с несколькими каплями баритовой воды, при появлении мути перенесите отводную трубку в пробирку с раствором I2 в KI, обесцвеченным 2н NaOH – выделяется желтоватый осадок йодоформа. Напишите уравнения реакции.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 143; Нарушение авторских прав?; Мы поможем в написании вашей работы!