
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
При решении задач без вывода
|
|
|
|
Перечень формул, которые можно использовать
Количество вещества – число структурных элементов (молекул, атомов и т.д.), содержащихся в теле (системе)
 ,
,
где N – число структурных элементов, NА – число Авогадро.
Молярная масса вещества:
 ,
,
где m – масса тела.
Концентрация молекул
 ,
,
где V – объем тела.
Уравнение состояния идеального газа
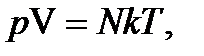
где р – давление газа, V – его объем, N – количество молекул газав данном объеме, Т - термодинамическая температура, выраженная в кельвинах, k – постоянная Больцмана.
Уравнение Менделеева-Клапейрона
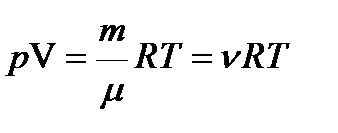 ,
,
где R = 8,31  - универсальная газовая постоянная.
- универсальная газовая постоянная.
Опытные газовые законы для двух состояний идеального газа:
1. Закон Бойля-Мариотта (изотермический процесс: Т = const, m = const):
 .
.
2. Закон Гей-Люссака (изобарный процесс: р = const, m = const):
 .
.
3. Закон Шарля (изохорный процесс: V= const, m = const):
 .
.
4. Объединенный газовый закон (m = const):
 .
.
Закон Дальтона:
 ,
,
где р – давление смеси газов; р 1, р 2, …, р n – парциальные давления – давления каждой из компонентов смеси.
Основное уравнение молекулярно-кинетической теории газа (уравнение, задающее связь между макро - и микропараметрами):
 ,
,
где р – давление газа; п – концентрация молекул газа (число молекул в единице объема); <en> - средняя кинетическая энергия поступательного движения молекулы.
Средняя кинетическая энергия молекулы или полная энергия молекулы, приходящаяся на все степени свободы:
 ,
,
где i – число степеней свободы молекулы.
Зависимость давления газа от концентрации молекул
 .
.
Скорости молекул:
а) средняя квадратичная
 ,
,
б) средняя арифметическая
 ,
,
в) наиболее вероятная
 ,
,
где т 0 – масса одной молекулы; R – универсальная газовая постоянная; m - молярная масса газа, k – постоянная Больцмана, Т – термодинамическая температура.
Средняя длина свободного пробега молекул газа
 ,
,
где n – концентрация молекул, d – эффективный диаметр молекул газа.
Среднее число соударений, испытываемых одной молекулой газа в единицу времени
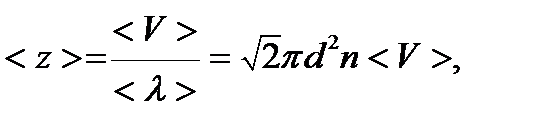
где  - средняя арифметическая скорость молекул.
- средняя арифметическая скорость молекул.
Связь между удельной с и молярной С теплоемкостями газа
 .
.
Молярная теплоемкость газа при постоянном давлении Ср и постоянном объеме С V
 ,
,
где i – число степеней свободы молекул идеального газа, R - универсальная газовая постоянная.
Уравнение Майера
 .
.
Первое начало термодинамики
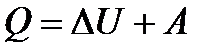 ,
,
где Q – количество теплоты, сообщаемое системе, D U – изменение внутренней энергии системы, А – работа, совершаемая системой (идеальным газом) против внешних сил.
При бесконечно малом сообщении теплоты
 ,
,
где dU – бесконечно малое изменение внутренней энергии системы, dA - элементарная работа, совершаемая газом.
Изменение внутренней энергии идеального газа
 ,
,
где i – число степеней свободы молекул; 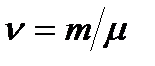 - количество вещества.
- количество вещества.
Работа при изменении объема газа в общем случае вычисляется по формуле

где V1 – начальный объем газа, V2 – его конечный объем.
Работа газа:
а) при изохорном процессе (V = const, m = const)
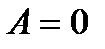 ,
,
б) при изобарном процессе (р = const, m = const)
 ,
,
в) при изотермическом процессе (Т = const, m = const)
 ,
,
г) при адиабатном процессе (dQ = 0)
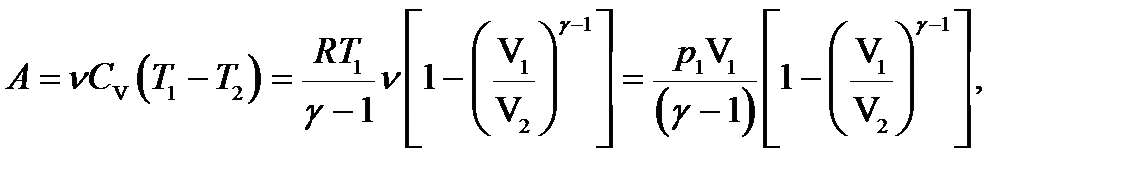
где  – показатель адиабаты.
– показатель адиабаты.
Уравнения адиабатного процесса для двух состояний идеального газа (уравнения Пуассона):

КПД цикла любой тепловой машины
 ,
,
где A – работа, совершаемая газом за цикл, Q 1 – количество теплоты, получаемое рабочим телом (газом) за цикл от нагревателя, Q 2 – количество теплоты, отдаваемое за один цикл холодильнику.
Термический коэффициент полезного действия цикла Карно:
 ,
,
где Т 1 и Т 2 – соответственно абсолютные температуры нагревателя и холодильника.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 55; Нарушение авторских прав?; Мы поможем в написании вашей работы!