
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 14. Свойства элементов VI A группы
|
|
|
|
Фосфор
Свойства 15P.
| Атомная масса | 30,97 | кларк, ат.% (распространненость в природе) | 0,04 |
| Электронная конфигурация* | 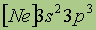
| Агрегатное состояние (н. у.). | твердое вещество |
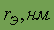
| 0,013 | Цвет | белый красный черный |
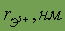
| 0,035 | 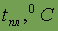
| 44,2 |
Энергия ионизации
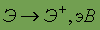
| 10,484 | 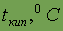
| |
| Относительная электроотрицательность | 2,1 | Плотность 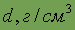
| бел. – 1,82 красн. – 2,69 черн. – 2,2 |
| Возможные степени окисления | -3, +3, +4, +5 | Стандартный электродный потенциал
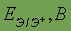
| |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Фосфор — аналог азота. Однако по сравнению с атомом азота атом фосфора характеризуется меньшей энергией ионизации и имеет больший радиус. Это означает, что неметаллические признаки у фосфора выражены слабее, чем у азота. Поэтому для фосфора реже встречается степень окисления -3 и чаще +5. Мало характерны и другие степени окисления.
Физические свойства. Фосфор — один из распространенных элементов в земной коре. В свободном состоянии в природе фосфор не встречается из-за высокой химической активности. Уменьшение неметалличности элемента фосфора по сравнению с азотом сказывается на свойствах его простых веществ. Так, фосфор в отличие от азота имеет несколько аллотропных модификаций: белый, красный, черный и др.
Белый фосфор — бесцветное и очень ядовитое вещество. Получается конденсацией паров фосфора. Не растворяется в воде, но хорошо растворяется в сероуглероде. При длительном слабом нагревании белый фосфор переходит в красный.
Красный фосфор — порошок красно-бурого цвета, не ядовит. Нерастворим в воде и сероуглероде. Установлено, что красный фосфор представляет собой смесь нескольких аллотропных модификаций, которые отличаются друг от друга цветом (от алого до фиолетового) и некоторыми другими свойствами. Свойства красного фосфора во многом зависят от условий его получения.
Черный фосфор по внешнему виду похож на графит, жирный на ощупь, обладает полупроводниковыми свойствами. Получается длительным нагреванием белого фосфора при очень большом давлении (200° С и 1200 МПа).
Красный и черный фосфор при сильном нагревании возгоняются.
Природный фосфор состоит из одного стабильного изотопа 3115P. Широкое применение нашел искусственный радиоактивный изотоп 3215P (период полураспада 14,3 суток).
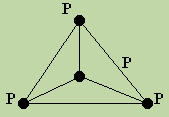
Свойства аллотропных модификаций фосфора объясняются их строением. Более подробно изучено строение белого фосфора. Он имеет молекулярную кристаллическую решетку. Его молекулы четырехатомны (P4 — тетрафосфор) и имеют форму правильной трехгранной пирамиды, а каждый атом фосфора находится в
одной из вершин пирамиды и связан тремя -связями с другими тремя атомами. Как все вещества с молекулярной решеткой, белый фосфор легко плавится и летуч. Он хорошо растворяется в органических растворителях.
В отличие от белого фосфора красный и черный фосфоры имеют атомную кристаллическую решетку. Поэтому они нерастворимы почти во всех растворителях, не летучи и, как уже отмечалось, не ядовиты.
Нахождение в природе. Общее содержание фосфора в земной коре составляет 0,08%. В связанном виде он входит в состав многих минералов, главным образом апатитов 3Ca3(РО4)2 СаF2 и фосфатов Са3(РO4)2. Разновидности апатита слагают осадочные горные породы — фосфориты, фосфор входит также в состав белковых веществ в виде различных соединений. Содержание фосфора в тканях мозга составляет 0,38%, в мышцах - 0,27%.
Самые богатые в мире залежи апатитов находятся близ г. Кировска на Кольском полуострове. Фосфориты широко распространены на Урале, в Поволжье, в Сибири, Казахстане, Эстонии, Белоруси и др. Большие месторождения фосфоритов имеются в Северной Африке, Сирии и США. Фосфор необходим для жизни растений. Поэтому почва всегда должна содержать достаточное количество соединений фосфора.
Получение. Обычно белый фосфор получают из фосфата кальция при нагревании его в смеси с песком и углем в электрической печи без доступа воздуха:
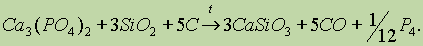
Красный фосфор можно получить при нагревании жидкого белого фосфора без доступа воздуха при температуре около 300 °С при небольшом давлении. При нагревании белого фосфора при большом давлении можно получить и черный фосфор.
Поскольку красный и черный фосфор являются полимерными модификациями, по сравнению с белым у них следует ожидать повышения температур плавления и температур кипения. Действительно, для красного фосфора Тпл составляет 600 °С (под давлением).
Применение. Красный фосфор применяется для производства спичек. Из красного фосфора, сульфида сурьмы (III), железного сурика [природного оксида железа (III) с примесью кварца] и клея приготовляют смесь, которую наносят на боковые поверхности спичечной коробки. Головка спичек состоит главным образом из бертолетовой соли, молотого стекла, серы и клея. При трении головки о намазку спичечной коробки красный фосфор воспламеняется, поджигает состав головки, а от него загорается дерево.
Белый фосфор широкого применения не имеет. Обычно его используют для образования дымовых завес. Черный фосфор применяется очень редко.
Химические свойства. В химическом отношении белый фосфор сильно отличается от красного. Так, белый фосфор легко окисляется и самовоспламеняется на воздухе, поэтому его хранят под водой. Красный фосфор не воспламеняется на воздухе, но воспламеняется при нагревании свыше 240° С. При окислении белый фосфор светится в темноте — происходит непосредственное превращение химической энергии в световую.
В жидком и растворенном состоянии, а также в парах при температуре ниже 800° С фосфор состоит из молекул Р4. При нагревании выше 800° С молекулы диссоциируют: P4 2P2. Последние при температуре выше 2000°С распадаются на атомы: P2 2P. Атомы фосфора могут объединяться в молекулы Р2, Р4 и в полимерные вещества. Очевидно, молекула P4, где атомы связаны между собой тремя -связями, прочнее молекулы Р2, в которой атомы связаны одной - и двумя -связями. Уже при обычной температуре молекула P2.
Фосфор химически активен и непосредственно взаимодействует с большинством простых веществ. Электронная конфигурация внешнего слоя фосфора 3s23p3, поэтому для фосфора наиболее характерны степени окисления 5+ (Н3РO), 3+ (РСl3) и 3- (РН3).
Из трех аллотропных модификаций наиболее активным является белый фосфор. При обычных условиях на воздухе тонко измельченный фосфор самовоспламеняется:
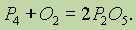
При недостатке кислорода образуется оксид фосфора (III):
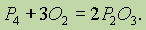
Поскольку температура плавления фосфора мала (44 °С), то давление насыщенных паров фосфора над твердым фосфором при обычных условиях достаточно велико — это и является причиной того, что белый фосфор “светится” в темноте. МолекулыP4 присутствующие в парах над поверхностью, окисляются кислородом с выделением света.
Красный и черный фосфор вступают в химические реакции при более высоких температурах. Аналогично азоту фосфор может взаимодействовать с металлами, образуя фосфиды, например:
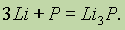
Фосфор соединяется со многими простыми веществами — кислородом, галогенами, серой, проявляя окислительные и восстановительные свойства:
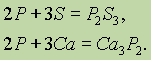
При взаимодействии фосфидов с водой выделяется фосфин РН3:
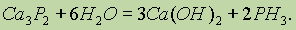
Фосфин. РН3 — чрезвычайно ядовитый газ с чесночным запахом. По своим химическим свойствам он напоминает аммиак, однако, по сравнению с аммиаком является более сильным восстановителем.
По аналогии с NH3 фосфин способен к реакциям присоединения:
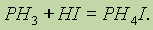
Так, на воздухе фосфин самопроизвольно воспламеняется, реакция протекает весьма энергично с образованием различных кислородных кислот фосфора (в основном ортофосфорной кислоты):
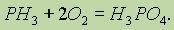
Так же легко, как с кислородом, протекает взаимодействие фосфора с хлором, и в зависимости от условий образуется либо РСl3, либо PCl5.
Оксиды фосфора. Фосфор образует несколько оксидов. Важнейшими из них являются Р4O6 и Р4О10. Часто их формулы пишут в упрощенном виде как Р2О3 и P2O5 (индексы предыдущих разделены на 2).
Оксид фосфора (III) Р4O6 — воскообразная кристаллическая масса, плавящаяся при 22,5° С. Получается сжиганием фосфора при недостатке кислорода. Сильный восстановитель. Очень ядовит.
Оксид фосфора (V) Р4О10 — белый гигроскопичный порошок. Получается при горении фосфора в избытке воздуха или кислорода. Он очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Оксиды и все кислородные соединения фосфора намного прочнее аналогичных соединений азота, что следует объяснить ослаблением неметаллических свойств у фосфора по сравнению с азотом.
Оксид фосфора (V). P2O5 энергично взаимодействует с водой, а также отнимает воду от других соединений. Именно поэтому P2O5 широко используется как осушитель различных веществ от паров воды.
Фосфорный ангидрид, взаимодействуя с водой, образует в первую очередь метафосфорную кислоту НРО3:
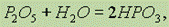
при кипячении раствора метафосфорной кислоты образуется ортофосфорная кислота H3PO4:
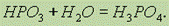
При нагревании H3PO4 можно получить пирофосфорную кислоту H4P2O7:
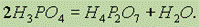

Ортофосфорная кислота. Наибольшее практическое значение имеет ортофосфорная кислота Н3РO4 (часто эту кислоту называют просто фосфорной).
Фосфорная кислота представляет собой белое твердое вещество, хорошо растворимое в воде. В отличие от азотной кислоты не является окислителем и не разлагается при нагревании, что объясняется наибольшей устойчивостью степени окисления +5 из всех возможных для фосфора. В промышленности фосфорная кислота получается двумя способами: экстракционным и термическим.
В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
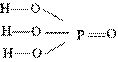
В водном растворе фосфорная кислота диссоциирует ступенчато. Как трехосновная кислота, НзР04 образует три типа солей: дигидрофосфаты (замещен один атом водорода кислоты), например NaH2PO4; гидрофосфаты (замещены два атома водорода кислоты), например Na2HPO4; фосфаты (замещены все атомы водорода в фосфорной кислоте), например Na3PO4.
Все дигидрофосфаты растворимы в воде. Из гидрофосфатов и фосфатов в воде растворимы только соли щелочных металлов и аммония.
Соли фосфорной кислоты. Соли фосфорной кислоты являются ценными минеральными удобрениями. Наиболее распространенные фосфорные удобрения — суперфосфат, преципитат и фосфоритная мука. Простой суперфосфат — смесь дигидрофосфата кальция Са(H2PO4)2, гидрофосфата кальция СаH2PO4, фосфата кальция Са3(РO4)2, а также апатита, гипса и других примесей. Его получают, обрабатывая фосфориты и апатиты серной кислотой. При обработке минеральных фосфатов фосфорной кислотой получают двойной суперфосфап Са(H2PO4)2. При гашении фосфорной кислоты известью получают преципитат СаНPO4 2Н2O.
Более важное значение имеют сложные удобрения (т. е. содержащие одновременно азот и фосфор или азот, фосфор и калий — основные компоненты удобрений). Из них наиболее известен аммофос — смесь NH4H2PO4 и (NH4)2HPO4.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 516; Нарушение авторских прав?; Мы поможем в написании вашей работы!