
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кремний. Свойства 14Si
|
|
|
|
| Атомная масса | 28,086 | кларк, ат.% (распространненость в природе) | 16,7 |
| Электронная конфигурация* | 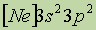
| Агрегатное состояние (н. у.). | твердое вещество |
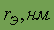
| 0,132 | Цвет | темно-серый блестящий |
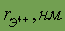
| 0,034 | 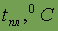
| |
Энергия ионизации
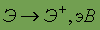
| 8,151 | 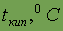
| |
| Относительная электро- отрицательность | 1,74 | Плотность 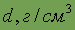
| 2,3263 |
| Возможные степени окисления | -4, +2, +4 | Стандартный электродный потенциал
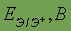
| |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Нахождение в природе. Кремний после кислорода — самый распространенный элемент в земной коре. В отличие от углерода в свободном состоянии кремний в природе не встречается. Наиболее распространенными его соединениями являются оксид кремния (IV) SiO2 и соли кремниевых кислот — силикаты. Они образуют оболочку земной коры. Соединения кремния содержатся в организмах растений и животных.
Природные силикаты имеют сложный состав и строение. Вот состав некоторых природных силикатов: полевой шпат К2О • Аl2O3• 6SiO2, асбест 3MgО • 2SiO2• 2H2O, cлюда К2О • 3Аl2O3• 6SiO2 • 2H2O, каолинит 3Аl2O3• 2SiO2• 2H2O.
Силикаты, содержащие в своем составе также оксид алюминия, называются алюмосиликатами. Из названных выше силикатов алюмосиликатами являются полевой шпат, каолинит и слюда. В природе наиболее распространены именно алюмосиликаты, например полевые шпаты. Распространены также смеси различных силикатов. Так, горные породы — граниты и гнейсы — состоят из кристалликов кварца, полевого шпата и слюды.
Основным продуктом разрушения является минерал каолинит — главная составная часть белой глины. В результате выветривания горных пород образовались залежи глины, песка и солей.
Получение. В промышленности кремний получают восстановлением SiO2 коксом в электрических печах:
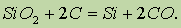
В лаборатории в качестве восстановителей используют магний или алюминий:
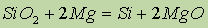
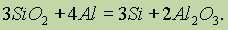
Наиболее чистый кремний получают восстановлением тетрахлорида кремния парами цинка:
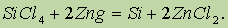
Применение. Кремний используют в качестве полупроводника. Из него изготовляют, так называемые, солнечные батареи, превращающие световую энергию в электрическую (питание радиоустановок космических кораблей). Кремний используют в металлургии для получения кремнистых сталей, обладающих высокой жаростойкостью и кислотоупорностью.
Физические свойства. Кристаллический кремний — вещество темно-серого цвета со стальным блеском. Структура кремния аналогична структуре алмаза. В его кристалле каждый атом окружен тетраэдрически четырьмя другими и связан с ними ковалентной связью, которая значительно слабее, чем между атомами углерода в алмазе. В кристалле кремния даже при обычных условиях часть ковалентных связей разрушается. Поэтому в нем имеются свободные электроны, которые обусловливают небольшую электрическую проводимость. При освещении и нагревании увеличивается число разрушаемых связей, а значит, увеличивается число свободных электронов и возрастает электрическая проводимость. Так следует объяснять полупроводниковые свойства кремния.
Кремний очень хрупок, его плотность 2,33 г/см3. Как и уголь, относится к тугоплавким веществам.
Кремний состоит из трех стабильных изотопов: 2814Si (92,27%), 2914Si (4,68%) и 3014 S i (3,05%).
Химические свойства. По химическим свойствам кремний, как и углерод, является неметаллом, но его неметалличность выражена слабее, так как он имеет больший атомный радиус. Поскольку у атомов кремния на внешнем энергетическом уровне находится 4 электрона, то для кремния характерна степень окисления как -4, так и +4 (известно соединение кремния, где его степень окисления равна +2).
Кремний при обычных условиях довольно инертен, что следует объяснить прочностью его кристаллической решетки. Непосредственно он взаимодействует только со фтором:
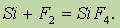

Кислоты (кроме смеси плавиковой HF и азотной HNO3) на кремний не действуют. Однако он растворяется в гидроксидах щелочных металлов, образуя силикат и водород:
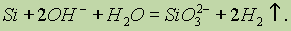
Из двух аллотропных модификаций кремния — кристаллической и аморфной — химически более активным является аморфный кремний. Он реагирует с кислородом при нагревании, образуя SiO2:
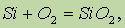
а также со всеми галогенами, например:
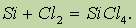
При высокой температуре кремний соединяется с углеродом, образуя карборунд SiC:
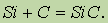
Карборунд имеет алмазоподобную кристаллическую решетку, в которой каждый атом кремния окружен четырьмя атомами углерода и наоборот, а ковалентные связи очень прочны, как в алмазе. Поэтому по твердости он близок к алмазу. Из карбида кремния изготовляют точильные камни и шлифовальные круги.
Силицид магния. В реакциях с активными металлами, протекающих с образованием силицидов, кремний выступает в роли окислителя:
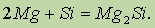
При высоких температурах кремний восстанавливает многие металлы из их оксидов.
Силан. При действии на силициды соляной кислоты получают простейшее водородное соединение кремния силан SiH4:
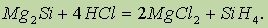
Силан — ядовитый газ с неприятным запахом, самовоспламеняется на воздухе:
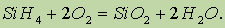
Оксид кремния (IV). Оксид кремния (IV) называют также кремнеземом. Это твердое тугоплавкое вещество (температура плавления 1700°С), широко распространенное в природе в двух видах: 1) кристаллический кремнезем — в виде минерала кварца и его разновидностей (горный хрусталь, халцедон, агат, яшма, кремень); кварц составляет основу кварцевых песков, широко используемых в строительстве и в силикатной промышленности; 2) аморфный кремнезем — в виде минерала опала состава SiO2 п H2O; землистыми формами аморфного кремнезема являются диатомит, трепел (инфузорная земля); примером искусственного аморфного безводного кремнезема может служить силикагель, который получается из метасиликата натрия:
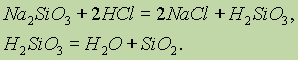
Силикагель имеет развитую поверхность, а поэтому хорошо адсорбирует влагу.
При 1710° кварц плавится. При быстром охлаждении расплавленной массыобразуется кварцевое стекло. Оно имеет очень малый коэффициент расширения, благодаря чему раскаленное кварцевое стекло не трескается при быстром охлаждении водой. Из кварцевого стекла изготовляют лабораторную посуду и приборы для научных исследований.
Простейшая формула оксида кремния (IV) SO2 аналогична формуле оксида углерода (IV) СO2. Между тем физические свойства их резко отличаются (SiO2 — твердое вещество, CO2 — газ). Это различие объясняется строением кристаллических решеток. С02 кристаллизуется в молекулярной решетке, SiO2 — в атомной. Структуру SiO2 в плоскостном изображении можно представить так:
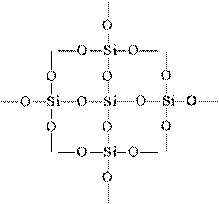
Координационное число атома углерода в твердом СO2 равно 2, а кремния в SiO2 равно 4. Каждый атом кремния заключен в тетраэдр из 4 атомов кислорода. При этом атом кремния находится в центре, а по вершинам тетраэдра расположены атомы кислорода. Весь кусок кремнезема можно рассматривать как кристалл, формула которого (SiO2)n. Такое строение оксида кремния (IV) обусловливает его высокую твердость и тугоплавкость.
По химическим свойствам оксид кремния (IV) SiO2 относится к кислотным оксидам. При сплавлении его с твердыми щелочами, основными оксидами и карбонатами образуются соли кремниевой кислоты:
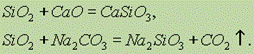
С оксидом кремния (IV) взаимодействует только плавиковая кислота:
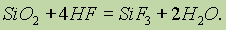
С помощью этой реакции производится травление стекла.
В воде оксид кремния (IV) не растворяется и с ней химически не взаимодействует. Поэтому кремниевую кислоту получают косвенным путем, действуя кислотой на раствор силиката калия или натрия:
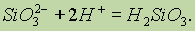
При этом кремниевая кислота(в зависимости от концентрации исходных растворов соли и кислоты) может быть получена как в виде студнеобразной массы, содержащей воду, так и в виде коллоидного раствора (золя).
Кремниевые кислоты. SiO2 является ангидридом ряда кремниевых кислот, состав которых можно выразить общей формулой xSiO2 yH2O, где х и у — целые числа:
1) х = 1, у = 1: SiO2 • H2O, т. е. H2SiO3 — метакремниевая кислота;
2) х = 1, у = 2: SiO2 • 2H2O, т. е. H4SiO4 — ортокремниевая кислота;
3) х = 2, у = 1: 2SiO2 • H2O, т. е. H2Si2O5 — двуметакремниевая кислота.
Кремниевая кислота построена из тетраэдрических структурных звеньев (в каждом таком звене атом кремния находится в центре тетраэдра, а по вершинам расположены атомы кислорода). Структурные звенья, объединяясь в цепи, образуют более устойчивые поликремниевые кислоты:
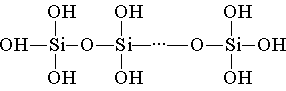
Состав такого соединения можно выразить формулой (H2SiO3)n. Однако обычно кремниевую кислоту изображают формулой H2SiO3. H2SiO3 — кислота очень слабая, в воде мало растворима. При нагревании легко распадается аналогично угольной кислоте:
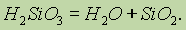
Все кремниевые кислоты очень слабые (слабее угольной).
Силикаты. Соли всех кремниевых кислот называют силикатами, хотя, как правило, в учебной литературе под силикатами подразумевают соли метакремниевой кислоты. Их состав обычно изображают формулой в виде соединений оксидов элементов. Например, силикат кальция CaSiO3 можно выразить так: СаО SiO2.
Силикаты состава R2О nSiO2, где R2O — оксиды натрия или калия, называются растворимым стеклом, а их концентрированные водные растворы — жидким стеклом. Наибольшее значение имеет натриевое растворимое стекло.
При стоянии на воздухе растворы силикатов мутнеют, так как находящийся в воздухе оксид углерода (IV) вытесняет кремниевую кислоту из ее солей:
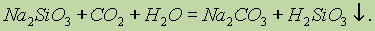
Кремниевая кислота практически нерастворима в воде — это свойство используют как качественную реакцию на ион SiO32 .
Силикаты получают сплавлением оксида кремния с щелочами или карбонатами:
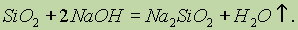
Применение силикатов. Наиболее широко используются силикаты натрия и калия. Концентрированные растворы этих солей называют жидким стеклом; они имеют сильнощелочную реакцию вследствие гидролиза. Жидкое стекло используют при изготовлении клея и водонепроницаемых тканей. Жидкое стекло применяется в качестве связующего при изготовлении кислотоупорных бетонов, а также для изготовления замазок, конторского клея. Им пропитывают ткани, дерево и бумагу для придания им огнестойкости и водонепроницаемости.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 2339; Нарушение авторских прав?; Мы поможем в написании вашей работы!