
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Медь, серебро. Свойства элементов I B группы
|
|
|
|
Лекция 15. Свойства элементов побочных подгрупп
1. Общая характеристика
2. Получение
3. Физические свойства
4. Химические свойства
5. Соединения
| Свойства | 29Cu | 47Ag | 79Au |
| Атомная масса | 63,546 | 107,868 | 196,966 |
| Электронная конфигурация* | 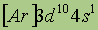
| 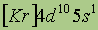
| 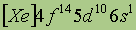
|
| 0,127 | 0,144 | 0,144 |
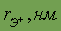
| 0,098 | 0,113 | 0,137 |
Энергия ионизации
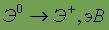
| 7,726 | 7,547 | 9,223 |
| Относительная электроотрицательность | 1,9 | 1,9 | 2,4 |
| Возможные степени окисления | +1, +2, +3 | +1, +2, +3 | +1, +3 |
| кларк, ат.% (распространненость в природе) | 0,003 | 2× 10- 6 | 5× 10- 8 |
| Агрегатное состояние (н. у.) | Т В Е Р Д Ы Е В Е Щ Е С Т В А | ||
| Цвет | красный | белый | желтый |
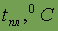
| 961,3 | 1064,7 | |
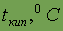
| |||
Плотность 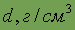
| 8,96 | 10,50 | 19,3 |
Стандартный электродный потенциал
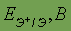
| 0,51 | 0,81 | 1,68 |
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Медь. Физические свойства. Медь — довольно мягкий металл красно-желтого цвета. Ее атомы имеют электронную конфигурацию внешнего уровня 3d104s1.
Химические свойства. Медь обладает наименьшей активностью среди всех переходных металлов. Так, она не реагирует с разбавленными соляной и серной кислотами. Она растворяется только в кислотах-окислителях:
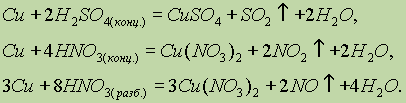
В соединениях медь проявляет две степени окисления: 1+ и 2+, из которых более устойчиво состояние 2+. Одновалентная медь встречается либо в нерастворимых соединениях(CuCl, Cu2S), либо в виде растворимых комплексов типа[Cu(NH3)2]+.
Хлорид меди (I) растворяется в концентрированном растворе аммиака с образованием комплексного иона диамминмеди (I) [Cu(NH3)2]+:
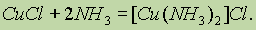
Так же в аммиаке растворяется оксид меди (I) Cu2O:
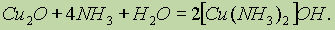
Ионы Си2+ в водном растворе существуют в виде комплексов гексааквамеди (II) [Cu(H2O)6]2+, имеющих характерную сине-голубую окраску. При добавлении гидроксида натрия к раствору, содержащему эти ионы, образуется голубой осадок гидратированного гидроксида меди (II):
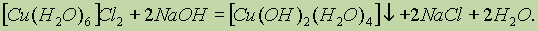
Полученный осадок, в свою очередь, растворяется в растворе аммиака, образуя ярко-синий комплекс:
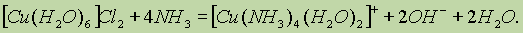
Изменение окраски соединений меди при переходе из степени окисления 2+ в степень окисления 1+ используется в органической химии для качественного анализа. Так, свежеосажденный гидроксид Си(ОН)2 синего цвета восстанавливается до оранжевого осадка Сu2О альдегидами или восстанавливающими углеводами, например глюкозой.
Серебро. Химические свойства. Серебро, так же как и медь, не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах-окислителях:
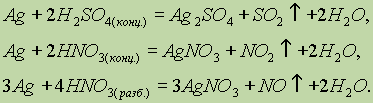
В большинстве соединений серебро проявляет степень окисления 1+. Растворимый нитрат серебра используется как реактив для качественного определения ионов Сl-, Вr-, I-:
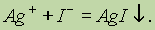
При добавлении NaOH к раствору AgNO3 образуется темно-коричневый осадок оксида серебра Ag2O:
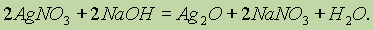
Подобно соединениям меди (I), осадки AgCl и Ag2O могут растворяться в растворах аммиака с образованием комплексных соединений:
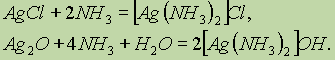
Последний комплекс используется в органической химии в качественной реакции на альдегиды (реакция “серебряного зеркала”).
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 775; Нарушение авторских прав?; Мы поможем в написании вашей работы!