
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Алюминий
|
|
|
|
Свойства 13Al.
| Атомная масса | 26,98 | кларк, ат.% (распространненость в природе) | 5,5 |
| Электронная конфигурация* | 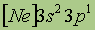
| Агрегатное состояние (н. у.). | твердое вещество |
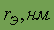
| 0,143 | Цвет | серебристо-белый |
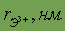
| 0,057 | 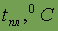
| |
Энергия ионизации
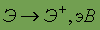
| 5,98 | 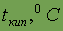
| |
| Относительная электроотрицательность | 1,5 | Плотность 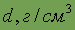
| 2,698 |
| Возможные степени окисления | +1, +2,+3 | Стандартный электродный потенциал
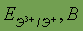
| -1,69 |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Алюминий — основной представитель металлов главной подгруппы III группы периодической системы. Свойства его аналогов — галлия, индия и таллия — во многом напоминают свойства алюминия, поскольку все эти элементы имеют одинаковую электронную конфигурацию внешнего уровня ns2np1 и поэтому все они проявляют степень окисления 3+.
Физические свойства. Алюминий — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Поверхность металла покрыта тонкой, но очень прочной пленкой оксида алюминия Аl2Oз.
Получение. Алюминий получают электролизом расплава Al2O3.
Химические свойства. Алюминий весьма активен, если нет защитной пленки Аl2Oз. Эта пленка препятствует взаимодействию алюминия с водой. Если удалить защитную пленку химическим способом (например, раствором щелочи), то металл начинает энергично взаимодействовать с водой с выделением водорода:
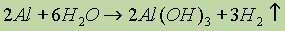
Алюминий в виде стружки или порошка ярко горит на воздухе, выделяя большое количество энергии:
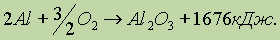
Эта особенность алюминия широко используется для получения различных металлов изих оксидов путем восстановления алюминием. Метод получил название алюмотермии. Алюмотермией можно получить только те металлы, у которых теплоты образования оксидов меньше теплоты образования Аl2Oз, например:
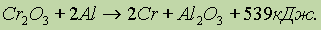
При нагревании алюминий реагирует с галогенами серой, азотом и углеродом, образуя при этом соответственно галогениды:
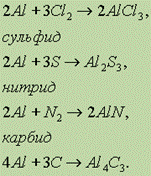
Сульфид и карбид алюминия полностью гидролизуются образованием гидроксида алюминия и соответственно сероводорода и метана.
Алюминий легко растворяется в соляной кислоте любой концентрации:
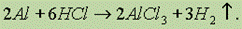
Концентрированные серная и азотная кислоты на холоде не действуют на алюминий (пассивируют). При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
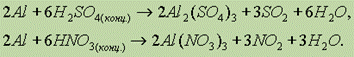
В разбавленной серной кислоте алюминий растворяется с выделением водорода:

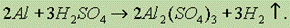
В разбавленной азотной кислоте реакция идет с выделением оксида азота (II):
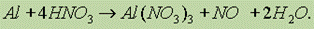
Алюминий растворяется в растворах щелочей и карбонатов щелочных металлов с образованием тетрагидроксоалюминатов:
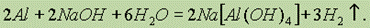
Оксид алюминия. Al2O3 имеет 9 кристаллических модификаций. Самая распространенная - модификация. Она наиболее химически инертна, на ее основе выращивают монокристаллы различных камней для использования с ювелирной промышленности и технике.
В лаборатории оксид алюминия получают, сжигая порошок алюминия в кислороде или прокаливая его гидроксид:
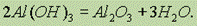
Оксид алюминия, будучи амфотерным, может реагировать не только с кислотами, но и с щелочами, а также при сплавлении с карбонатами щелочных металлов, давая при этом метаалюминаты:
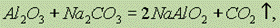
и с кислыми солями:
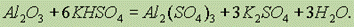
Гидроксид алюминия — белое студенистое вещество, практически нерастворимое в воде, обладающее амфотерными свойствами. Гидроксид алюминия может быть получен обработкой солей алюминия щелочами или гидроксидом аммония. В первом случае необходимо избегать избытка щелочи, поскольку в противном случае гидроксид алюминия растворится с образованием комплексных тетрагидроксоалюминатов [Аl(ОН)4]:
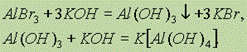
На самом деле в последней реакции образуются тетрагидроксодиакваалюминат-ионы [Al(OH)4(Н2O)2], однако для записи реакций обычно используют упрощенную форму [Аl(ОН)4]. При слабом подкислении тетрагидроксоалюминаты разрушаются:
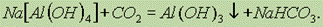
Соли алюминия. Из гидроксида алюминия можно получить практически все соли алюминия. Почти все соли алюминия и сильных кислот хорошо растворимы в воде и при этом сильно гидролизованы.
Галогениды алюминия хорошо растворимы в воде, и по своей структуре являются димерами:
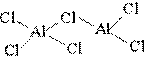
| 2AlCl3 Al2Cl6 |
Сульфаты алюминия легко, как и все его соли, гидролизуются:
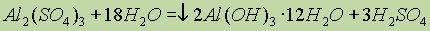
Известны также калий-алюминиевые квасцы: KAl(SO4)2 12H2O.
Ацетат алюминия Al(CH3COO)3 используют в медицине в качестве примочек.
Алюмосиликаты. В природе алюминий встречается в виде соединений с кислородом и кремнием – алюмосиликатов. Общая их формула: (Na, K)2Al2Si2O8 – нефелин.
Также природными соединениями алюминия являются: Al2O3 – корунд, глинозем; и соединения с общими формулами Al2O3 nH2O и Al(OH)3 nH2O – бокситы.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 996; Нарушение авторских прав?; Мы поможем в написании вашей работы!