
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 13. Щелочные металлы. Свойства элементов I A группы
|
|
|
|
Вода.
Оксид водорода — одно из наиболее распространенных и важных веществ. Поверхность Земли, занятая водой, в 2,5 раза больше поверхности суши. Чистой воды в природе нет, — она всегда содержит примеси. Получают чистую воду методом перегонки. Перегнанная вода называется дистиллированной. Состав воды (по массе): 11,19 % водорода и 88,81 % кислорода.
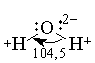
Физические свойства. Чистая вода прозрачна, не имеет запаха и вкуса. Наибольшую плотность она имеет при 0 °С (1 г/см3). Плотность льда меньше плотности жидкой воды, поэтому лед всплывает на поверхность. Вода замерзает при 0 °С и кипит при 100° С при давлении 101 325 Па. Она плохо проводит теплоту и очень плохо проводит электричество. Вода — хороший растворитель.
Молекула воды имеет угловую форму: атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды — диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, — отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы.
В жидкой воде наряду с обычными молекулами Н2О содержатся ассоциированные молекулы, т. е. соединенные в более сложные агрегаты (Н2О)х, благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии ее физических свойств; максимальная плотность при 4° С, высокая температура кипения (в ряду Н2О—H2S — H2Se — Н2Те), аномально высокая теплоемкость [4,18 кДж/(гЧ К)]. С повышением температуры водородные связи разрываются, и полный разрыв их наступает при переходе воды в пар.
Химические свойства. Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочноземельными металлами:
H2O + Na 2O = 2 NaOH
2 H2O + Li = 2 Li OH + H2 ↑
H2O + SO2 = H2SO3
2 H2O + Ca = Ca(OH)2 + H2 ↑
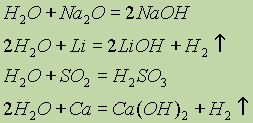
Вода образует многочисленные соединения — гидраты (кристаллогидраты):
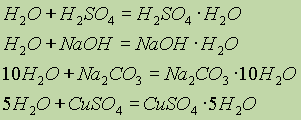
Очевидно, соединения, связывающие воду, могут служить в качестве осушителей. Из других осушающих веществ можно указать Р2O5, СаО, ВаО, металлический Na (они тоже химически взаимодействуют с водой), а также силикагель.
К важным химическим свойствам воды относится ее способность вступать в реакции гидролитического разложения.
Тяжелая вода. Вода, содержащая тяжелый водород, называется тяжелой водой (обозначается формулой D2O). Как это видно из сопоставления физических свойств, она отличается от обычной воды:(в скобках приведены характеристики обычной воды (H2O))
Молекулярная масса: 20 (18)
Плотность при 20 °С, г/см3 : 1,1050 (0,9982)
Температура кристаллизации, oC: 3,8 (0)
Температура кипения, °С: 101,4 (100)
Химические реакции с тяжелой водой протекают значительно медленнее, чем с обычной водой. Поэтому она при длительном электролизе обычной воды накапливается в электролизере.
Тяжелая вода применяется в качестве замедлителей нейтронов в ядерных реакторах.
1. Общая характеристика
2. Получение
3. Физические свойства
4. Химические свойства
5. Соединения
| Свойства | 3Li | 11Na | 19K | 37Rb | 55Cs | 87Fr |
| Атомная масса | 6,941 | 22,9898 | 39,098 | 85,468 | 132,905 | [223] |
| Электронная конфигурация* | 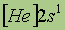
| 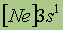
| 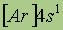
| 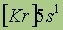
| 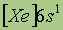
| 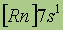
|
| 0,155 | 0,189 | 0,238 | 0,253 | 0,274 | 0,280 |
| 0,068 | 0,098 | 0,133 | 0,149 | 0,165 | 0,175 |
Энергия ионизации
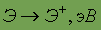
| 5,392 | 5,14 | 4,341 | 4,176 | 3,89 | 3,98 |
| Относительная электро- отрицательность | 0,97 | 1,01 | 0,91 | 0,89 | 0,86 | 0,86 |
| Возможные степени окисления | +1 | +1 | +1 | +1 | +1 | +1 |
| кларк, ат.% (распро- странненость в природе) | 0,02 | 2,0 | 1,1 | 7*10-3 | 9*10-9 | |
| Агрегатное состояние (н. у.), цвет | С Е Р Е Б Р И С Т Ы Е М Е Т А Л Л Ы | |||||
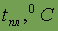
| 180,05 | 97,82 | 63,2 | 38,7 | 28,64 | |
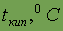
| 753,8 | |||||
Плотность 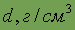
| 0,534 | 0,971 | 0,862 | 1,532 | 1,873 | 2,1 2,4 |
Стандартный электродный потенциал
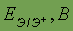
| -3,02 | -2,71 | -2,92 | -2,925 | -2,91 | |
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Как видно из данных, приведенных в таблице, элементы IA обладают большими атомными радиусами (самыми большими в периоде) и низкой энергией ионизации (самой низкой в периоде), при этом в группе энергия ионизации уменьшается сверху вниз, так что Cs обладает наименьшей энергией ионизации вообще. Аналогичные выводы можно сделать и исходя из значений относительной электроотрицательности. В силу выше названных причин, химические связи в соединениях щелочных металлов – ионные.
2. Получение. Из-за высокой химической активности щелочные металлы встречаются в природе только в виде соединений (галогенидов, нитратов силикатов и др.). Чистые металлы получают путем электролиза расплавов галогенидов и щелочей или металлотермией.
3.Физические свойства. Элементы IA группы – типичные металлы. В силу относительной легкости протекания процесса ионизации, они - сильные восстановители, особенно Rb и Cs, что позволяет широко использовать их в фотоэлементах.
Это металлы, серебристого цвета (у Cs иногда встречается розовато-желтоватый оттенок), мягкие, пластичные, легкоплавкие, легколетучие. Обладают хорошей тепло- и электропроводностью.
Уменьшение температуры плавления от Li к Cs объясняется увеличением размера атома (см. табл.) и, как следствие, ослаблением межатомных связей.
Практическое применение. Na используется как восстановитель в металлотермии. Li и Na также применяются при изготовлении сталей, в качестве т. наз. “раскислителей”, которые удаляют примеси из стали (O2, N2, S, As и др.).
4. Химические свойства. Как уже было сказано, элементы IA группы – сильные восстановители, активные металлы (Ме). Они легко реагируют с водой, кислотами. другими металлами и неметаллами, особенно при нагревании:
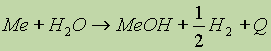 (легко).
(легко).
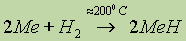 - гидриды – сильные восстановители, химически активные солеподобные соединения. Легко разлагаются при нагревании с выделение водорода. Гидрид натрия используют для получения металлов. В частности:
- гидриды – сильные восстановители, химически активные солеподобные соединения. Легко разлагаются при нагревании с выделение водорода. Гидрид натрия используют для получения металлов. В частности: 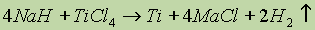
 - карбиды. При гидролизе этих соединений, который протекает достаточно легко, образуются, соответственно, ацетилен и метан.
- карбиды. При гидролизе этих соединений, который протекает достаточно легко, образуются, соответственно, ацетилен и метан.
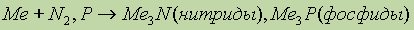 - легко гидролизуются с образованием
- легко гидролизуются с образованием 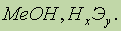
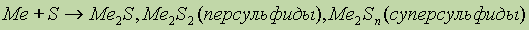 Персульфиды и суперсульфиды, равно как и пероксиды и супероксиды (см. ниже) являются окислителями.
Персульфиды и суперсульфиды, равно как и пероксиды и супероксиды (см. ниже) являются окислителями.
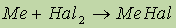 - химические связи в галогенидах и оксидах щелочных металлов очень прочные и не подвержены гидролизу.
- химические связи в галогенидах и оксидах щелочных металлов очень прочные и не подвержены гидролизу.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 969; Нарушение авторских прав?; Мы поможем в написании вашей работы!