
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства
|
|
|
|
Получение.
Для промышленного получения водорода используют следующие способы:
1. Электролиз водных растворов хлоридов.
2. Пропускание паров воды над раскаленным углем при температуре 1000 ° С:

3. Конверсия метана при высоких температурах:
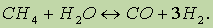
4. Крекинг углеводородов.
Для лабораторного получения водорода используют следующие способы:
1. Взаимодействие металлов с кислотами:
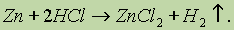
2. Взаимодействие щелочноземельных металловс водой:
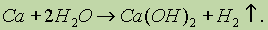
3. Взаимодействие алюминия или кремния с водными растворами щелочей:
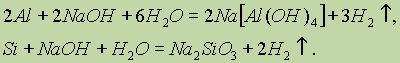
4. Взаимодействие гидридов с водой.
Энергия связи в молекуле водорода H2 составляет 436 кДж/моль. Большая величина энергии связи объясняет сравнительно малую активность молекулярного водорода при обычных условиях. Так, при комнатной температуре водород реагирует лишь с фтором:
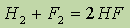
и с хлором при ультрафиолетовом облучении.
При повышенной температуре водород реагирует со многими веществами: он сгорает в атмосфере кислорода с образованием воды и выделением большого количества теплоты:
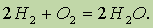
Соединения водорода с неметаллами. При нагревании водород обратимо реагирует также с бромом, иодом, серой и азотом, причем с последним только в присутствии катализатора и при высоком давлении.
Водород при нагревании способен реагировать не только с простыми, но и со сложными веществами:
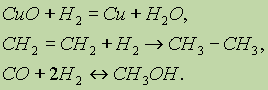
Во всех рассматриваемых реакциях водород является восстановителем, образуя соединения, где его степень окисления равна 1+.
Соединения водорода с металлами. Со многими металлами водород вступает в реакции при повышенных температуре и давлении с образованием гидридов (NaH, KH, СаН2, где его степень окисления равна1-:
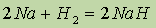
Гидрид натрия — белое кристаллическое соединение, по физическим свойствам напоминающее хлорид натрия. Однако химические свойства NaH и NaCI сильно различаются. Так, хлорид натрия растворяется в воде и диссоциирует в растворе на ионы. Гидрид натрия водой разлагается с образованием щелочи и водорода:
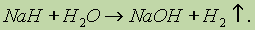
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 462; Нарушение авторских прав?; Мы поможем в написании вашей работы!