
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция № Водород. Свойства 1H
|
|
|
|
1. Общая характеристика
2. Получение
3. Химические свойства
4. Вода, ее свойства
| Атомная масса | 1,008 | кларк, ат.% (распространненость в природе) | |
| Электронная конфигурация* | 1s1 | Агрегатное состояние (н. у.). | газ |
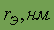
| ¾ | Цвет | бесцветный |
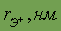
| 0,136 | 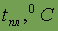
| - 259,1 |
Энергия ионизации
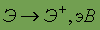
| 13,6 | 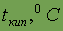
| - 252,6 |
| Относительная электроотрицательность | 2,10 | Плотность 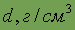
| ¾ |
| Возможные степени окисления | +1,-1 | Стандартный электродный потенциал

|
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Атом водорода состоит из одного протона и одного электрона. Этот простейший атом не имеет аналогов в периодической системе. Он способен терять электрон, превращаясь в катион Н+, и в этом отношении сходен со щелочными металлами, которые также проявляют степень окисления 1+. Атом водорода может также присоединять электрон, образуя при этом анион Н-, электронная конфигурация которого такая же, как у атома гелия. В этом отношении водород сходен с галогенами, анионы которых имеют электронные конфигурации соседних благородных газов.
Таким образом, водород имеет двойственную природу, проявляя как окислительную, так и восстановительную способность. По этой причине в одних случаях водород помещают в подгруппу щелочных металлов, в других — в подгруппу галогенов.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 346; Нарушение авторских прав?; Мы поможем в написании вашей работы!