
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства элементов II A группы
|
|
|
|
Лекция 3. Щелочноземельные металлы, бериллий, магний.
1. Общая характеристика
2. Физические свойства
3. Получение
4. Химические свойства
5. Соединения
| Свойства | 4Be | 12Mg | 20Ca | 38Sr | 56Ba | 88Ra |
| Атомная масса | 9,012 | 24,305 | 40,80 | 87,62 | 137,34 | 226,025 |
| Электронная конфигурация* | 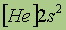
| 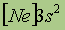
| 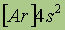
| 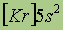
| 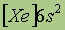
| 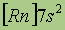
|
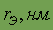
| 0,113 | 0,160 | 0,190 | 0,213 | 0,225 | 0,235 |
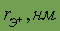
| 0,034 | 0,078 | 0,106 | 0,127 | 0,133 | 0,144 |
Энергия ионизации
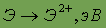
| 9,32 | 7,644 | 6,111 | 5,692 | 5,21 | 5,28 |
| Относительная электро- отрицательность | 1,5 | 1,2 | 1,0 | 1,0 | 0,9 | 0,9 |
| Возможные степени окисления | +2 | +2 | +2 | +2 | +2 | +2 |
| кларк, ат.% (распро- странненость в природе) | 1*10-3 | 1,4 | 1,5 | 8*10-3 | 5*10-3 | 8*10-12 |
| Агрегатное состояние (н. у.). | Т В Е Р Д Ы Е В Е Щ Е С Т В А | |||||
| Цвет | Серо- стальной | Сереб- ристый | С Е Р Е Б Р И С Т О – Б Е Л Ы Й | |||
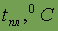
| 649,5 | |||||
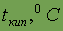
| ||||||
Плотность 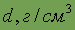
| 1,86 | 1,741 | 1,540 | 2,67 | 3,67 | |
Стандартный электродный потенциал
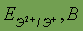
| -1,73 | -2,34 | -2,83 | -2,87 | -2,92 | |
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Как следует из данных, приведенных в таблице, элементы IIA группы имеют низкие (но все же не самые низкие: сравни с IA гр.) величины энергии ионизации и относительной электроотрицательности, при чем эти величины уменьшаются от Be к Ba, что позволяет сделать вывод о том, что эти элементы – типичные металлы-восстановители, и Ba – более активен, чем Be.
Ве – проявляет, подобно алюминию, амфотерные свойства. Однако у Ве металлические свойства все же более ярко выражены, чем неметаллические. Бериллий реагирует в отличие от остальных элементов IIA группы со щелочами.
Химические связи в соединениях Ве в основном ковалентные, тогда как связи в соединениях всех остальные элементов (Mg - Ra) носят ионный характер. При этом, как и у элементов IA группы, связи с галогенами и кислородом весьма прочные, а с водородом, углеродом, азотом, фосфором и серой – легко гидролизуются.
Физические свойства. Это металлы серебристо-белого цвета, относительно легкие, мягкие (за исключением бериллия), пластичные, легкоплавкие (все, кроме бериллия), обладают хорошей электро- и теплопроводностью.
Практическое применение. Ве используется в атомной технике как замедлитель и поглотитель нейтронов. Сплавы бериллия с медью – бронзы – очень стойкие, а с никелем – обладают высокой химической устойчивостью, благодаря чему и используются в хирургии.
Mg, Ca – используются как хорошие восстановители в металлотермии.
Ca, Sr, Ba – достаточно легко реагируют с газами и используются как геттеры (поглотители из воздушной среды) в вакуумной технике.
Получение. Будучи высоко химически активными, щелочноземельные металлы не встречаются в природе в свободном состоянии, их получают электролизом расплавов галогенидов или металлотермией. В природе щелочноземельные элементы входят в состав следующих минералов: 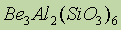 -берилл;
-берилл; 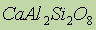 - полевой шпат;
- полевой шпат; 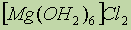 - бишофит- используется в медицине и для получения магния путем электролиза. Для получения бериллия в металлургии используются фторбериллаты:
- бишофит- используется в медицине и для получения магния путем электролиза. Для получения бериллия в металлургии используются фторбериллаты: 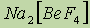 .
.
Химические свойства. Щелочноземельные металлы легко реагируют с кислородом, галогенами, неметаллами, водой и кислотами, особенно при нагревании:
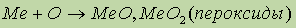 - особенно легко эта реакция протекает для кальция и бария, поэтому их хранят в особых условиях.
- особенно легко эта реакция протекает для кальция и бария, поэтому их хранят в особых условиях.
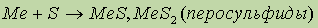 - персульфид бария BaS – люминофор.
- персульфид бария BaS – люминофор.
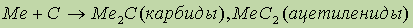 - при гидролизе ацетиленидов образуется ацетилен:
- при гидролизе ацетиленидов образуется ацетилен: 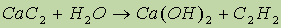
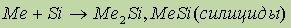
Получить соединения Be и Mg с водородом прямым взаимодействием простых веществ не удалось:
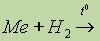 реакция не идет, тогда как
реакция не идет, тогда как 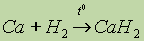 идет достаточно легко. Образующиеся гидриды – сильные восстановители.
идет достаточно легко. Образующиеся гидриды – сильные восстановители.
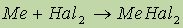
Металлы IIA группы по-разному взаимодействуют с водой:
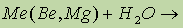 реакция не идет, пассивация (сравни с Al).
реакция не идет, пассивация (сравни с Al).
 - в случае с Са эта реакция идет очень бурно.
- в случае с Са эта реакция идет очень бурно.
Взаимодействие с кислотами не окислителями: 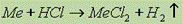
Взаимодействие с кислотами окислителями: 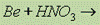 пассивация, реакция не идет на холоду в независимости от концентрации кислоты;
пассивация, реакция не идет на холоду в независимости от концентрации кислоты;
продукты взаимодействий остальных металлов с кислотами-окислителями зависят от условий их протекания, так: 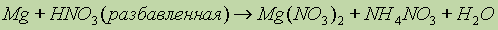 , а при взаимодействии Mg с концентрированной азотной кислотой возможно образование помимо нитрата магния также
, а при взаимодействии Mg с концентрированной азотной кислотой возможно образование помимо нитрата магния также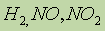 и др.
и др.
Взаимодействие с основаниями: 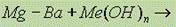 реакция не идет, т. к. эти металлы сильные восстановители;
реакция не идет, т. к. эти металлы сильные восстановители;
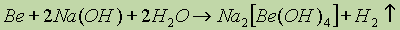 - проявление амфотерности бериллия;
- проявление амфотерности бериллия;
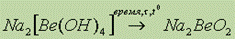
Оксиды щелочноземельных металлов. Оксиды щелочноземельных элементов находят широкое применение в строительстве. Их получают разложением солей: 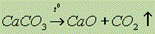 - СаО – негашеная известь.
- СаО – негашеная известь.
В ряду оксидов от BeO до BaO слева направо растет растворимость оксидов в воде, их основные свойства и химическая активность, так: BeO – нерастворим в воде, амфотерен, MgO – мало растворим в воде, а CaO, SrO, BaO – хорошо растворяются в воде с образованием гидроксидов Me(OH): 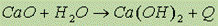 .
.
Температуры плавления оксидов понижаются в ряду BeO BaO. Температуры плавления оксидов BeO и MgO 2500C, что позволяет использовать их как огнеупорные материалы.
Гидроксиды щелочноземельных металлов. В ряду Be(OH)2 Ba(OH)2 растет радиус ионов Ме2+, и, как следствие, увеличивается вероятность проявления основных свойств гидроксидов, их растворимость в воде: Ве(ОН)2 – мало растворим в воде, вследствие своей амфотерности проявляет слабые кислотные и основные свойства, а Ва(ОН)2 – хорошо растворим в воде и по своей силе может сравнится с таким сильным основанием как NaOH.
Амфотерность гидроксида бериллия можно проиллюстрировать следующими реакциями:
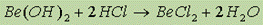

Соли щелочноземельных металлов. Растворимые соли Be и Ba – токсичны, ядовиты! СaF2 – малорастворимая соль, встречается в природе как флюорит или плавиковый шпат, находит применение в оптике. СaCl2, MgCl2 – хорошо растворимы в воде, находят применение в медицине и химическом синтезе в качестве осушителей. Карбонаты также находят широкое применение в строительстве: СaCО3 MgCО3 – доломит – используется в строительстве и для получения Vg и Ca. СaCО3 – кальцит, мел, мрамор, исландский шпат, MgCО3 – магнезит. Содержание растворимых карбонатов в природной воде определяет ее жесткость: 
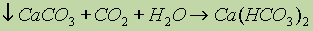 Сульфаты также являются широко распространенными природными соединениями щелочноземельных металлов: СaSO4 2H2O – гипс – широко используется в строительстве. MgSO4 7H2O – эпсомит, “английская горькая соль”, ВaSO4 – находит применеие с рентгеноскопии. Фосфаты: Са3(РО4)2 – фосфорит, Са(Н2РО4)2, СаНРО4 – преципитат – используются для производства удобрений, Са5(РО4)3 (ОН-, F-, Cl-) – аппатит – природный минерал Са, NH4Mg(PО4) – мало растворимое соединение. Известны и другие соли: Са(NО3)2 2Н2O – норвежская селитра, Mg(ClО4)2 – ангидрон – очень хороший осушитель.
Сульфаты также являются широко распространенными природными соединениями щелочноземельных металлов: СaSO4 2H2O – гипс – широко используется в строительстве. MgSO4 7H2O – эпсомит, “английская горькая соль”, ВaSO4 – находит применеие с рентгеноскопии. Фосфаты: Са3(РО4)2 – фосфорит, Са(Н2РО4)2, СаНРО4 – преципитат – используются для производства удобрений, Са5(РО4)3 (ОН-, F-, Cl-) – аппатит – природный минерал Са, NH4Mg(PО4) – мало растворимое соединение. Известны и другие соли: Са(NО3)2 2Н2O – норвежская селитра, Mg(ClО4)2 – ангидрон – очень хороший осушитель.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1254; Нарушение авторских прав?; Мы поможем в написании вашей работы!