
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксиды и пероксиды щелочных металлов
|
|
|
|
 - реакция протекает без нагревания. В случае с Li, в реакции образуется в основном оксид и немного пероксида, а в случае с Na – наоборот. При взаимодействии K, Rb и Cs с кислородом основным продуктом реакции является супероксид. Структуры соединений щелочных металлов с кислородом приведены ниже:
- реакция протекает без нагревания. В случае с Li, в реакции образуется в основном оксид и немного пероксида, а в случае с Na – наоборот. При взаимодействии K, Rb и Cs с кислородом основным продуктом реакции является супероксид. Структуры соединений щелочных металлов с кислородом приведены ниже:
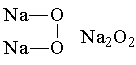


Среди пероксидов щелочных металлов наибольшее применение находит пероксид натрия:

 - сильный окислитель, используется при отбелке тканей.
- сильный окислитель, используется при отбелке тканей.
 - реакция регенерации воздуха в закрытых помещениях.
- реакция регенерации воздуха в закрытых помещениях.
Гидроксиды щелочных металлов. Это бесцветные твердые вещества, хорошо растворимые в воде, гигироскопичные. Химически активные, плавящиеся без разложения, за исключением:
 .
.
В ряду гидроксидов от LiOH к CsOH возрастает радиус атома щелочного металла, и, как следствие уменьшается прочность связи Ме О, что приводит к увеличению основных свойств.
 -взаимодействие с оксидами неметаллов.
-взаимодействие с оксидами неметаллов.
 - используется для получения алюминия.
- используется для получения алюминия.
Взаимодействие с галогенами:


Взаимодействие с кислотами:

 - эти реакции используются для получения солей.
- эти реакции используются для получения солей.
Соли щелочных металлов и их применение. Почти все соли щелочных металлов хорошо растворимы в воде. Трудно растворимы в основном соли лития (карбонат, фосфат и фторид), а также: LiAl(SiO3)2 – сподумен, LiAl(PO4)F – амблигонит, NaAlSi3O8 – альбит, KalSi3O8 – ортоклаз (полевые шпаты) и др.
Известны и встречаются в природе и другие соли щелочных металлов: NaCl – галит, KCl – сильвит. NaNO3 – чилийская селитра, KNO3 – индийская селитра (эти нитраты широко используются в сельском хозяйстве), Na2SO4, K2SO4 – тенардит, Na2CO3*10H2O – гидратированная сода (карбонаты используют для получения стекла), Na2SO4*12H2O – мирабилит, Na2SO4*10H2O – глауберова соль, Na2SiO3 – жидкое стекло, Na3PO4 – добавляют в вино для стабилизации, в стиральные порошки, и, вообще, широко используют в промышленности, KNaC4H4O6*4H2O – сегнетова соль (сегнетоэлектрик).
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 4029; Нарушение авторских прав?; Мы поможем в написании вашей работы!