
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз растворов
|
|
|
|
При электролизе расплава NaCl в электролите находились лишь один вид катионов и один вид анионов (Na+ и Сl-). В растворе электролита могут присутствовать несколько видов катионов и анионов, а также недиссоциированные молекулы (рис. 5.7.).
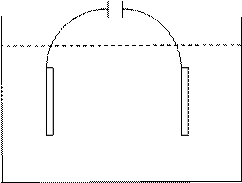
К А
Na+ Cl-
H+ OH-
H2O
Рис. 5.7.
При наличии нескольких видов ионов и недиссоциированных молекул возможно протекание нескольких электродных реакций.
Реакции, протекающие на катоде.
Так как на катоде идут реакции восстановления, т. е. прием электронов окислителем, то в первую очередь будут реагировать наиболее сильные окислители. На катоде прежде всего протекают реакции с наиболее положительным потенциалом. При электролизе водных растворов электролитов все окислители можно разделить на 3 группы:
1. Ионы металлов, потенциал которых более отрицателен, чем потенциал водородного электрода. К ним относятся ионы щелочных и щелочноземельных металлов, то есть группа ионов от Li по Al. В водных растворах разряд этих ионов практически не происходит, т.к. на катоде осуществляется разряд только Н+:
-3,04в 0 +1.5в
Li_______________ Al _____________________ H2_________Au
1 3 2
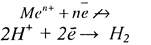
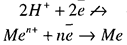
2. Окислители, потенциал которых существенно более положителен, чем потенциал водородного электрода:
Cu+ ÷Au3+, О2, PbO2, галогены.
При наличии в растворе ионов этой группы они разряжаются в первую очередь, а разряда Н+, не происходит:
3. Ионы, находящиеся между Аl и Н, потенциалы которых мало отличаются от потенциала водородного электрода:
Sn2+, Pb2+, Ni2+, Zn2+, Cd2+.
При наличии в растворе ионов этой группы на катоде происходит как разряд ионов этих металлов, так и Н+.
Потенциал водородного электрода больше чем у металлов 3 группы, поэтому сначала должно происходить разряд Н+, однако при электролизе рН среды увеличивается, что приводит к уменьшению потенциала водородного электрода, который оказывается меньше, чем потенциалы рассматриваемой группы металлов. Именно поэтому на катоде будет происходить разряд катионов металлов в первую очередь. Например:
Е2Н+/ Н2 = - 0,059 рН
при рН = 5 Е2Н+/ Н2 = - 0,059 ·5 = -0,23В.
Потенциал водородного электрода становится более отрицательным, чем потенциал металлического. Уменьшение потенциала водородного электрода явление положительное, т.к. удается выделить из растворов на катоде - Mn, Zn и др.
Реакции, протекающие на аноде.
На аноде протекает реакция окисления восстановителей, т. е. отдача электронов восстановителем, поэтому, в первую очередь, должны реагировать вещества, имеющие наиболее отрицательный потенциал.
Па аноде при электролизе водных растворов возможно протекание следующих реакций:
1. Растворение анода: Me ‒ nē → Men+
2. Окисление ионов 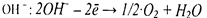
3. Окисление других веществ, присутствующих в растворе.
Если потенциал металлического анода меньше, чем потенциал ОН-, то происходит растворение металла, то есть первый процесс. При этом протекает электролиз с растворимым анодом.
Если потенциал металлического анода более положителен, чем потенциал ОН-, то протекает электролиз с нерастворимым анодом, т. е. вторая реакция.
Если потенциал металлического анода близок к потенциалу других электродных процессов, то наряду с растворением металла присутствуют и другие процессы (разряд ОН-, т.е. выделяется кислород).
В качестве нерастворимого анода используются золото и платиновые металлы, а также графит Ni, Fe, которые из-за высокой анодной поляризации практически не растворяются. Т.о. при электролизе с нерастворимым анодом на электроде будут окисляться или ОН- или недиссоциированные молекулы восстановителя.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 609; Нарушение авторских прав?; Мы поможем в написании вашей работы!