
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет спектра атома бериллия
|
|
|
|
Атом бериллия имеет четыре электрона. Наибольшую энергию ионизации имеет четвертый электрон, а наименьшую – первый.
Теоретическая величина энергии ионизации четвертого электрона равна 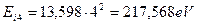 , экспериментальная -
, экспериментальная - 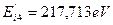 . С учетом этого спектр четвертого электрона атома бериллия представлен в табл. 8.
. С учетом этого спектр четвертого электрона атома бериллия представлен в табл. 8.
Таблица 8. Спектр четвертого электрона атома бериллия
| Значения | n | |||||
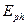 (эксп.) (эксп.)
| eV | 162,28 | 193,52 | 204,10 | 209,00 | 211,66 |
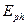 (теор.) (теор.)
| eV | 163,18 | 193,40 | 203,97 | 208,87 | 211,53 |
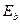 (теор.) (теор.)
| eV | 54,39 | 24,17 | 13,60 | 8,70 | 6.04 |
Энергия ионизации третьего электрона атома бериллия равна 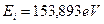 . А энергия связи с ядром, соответствующая первому энергетическому уровню, равна
. А энергия связи с ядром, соответствующая первому энергетическому уровню, равна 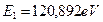 .
.
Подставляя значения 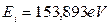 и
и 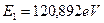 в формулы (32) и (33), найдем (табл. 9)
в формулы (32) и (33), найдем (табл. 9)
Таблица 9. Спектр третьего электрона атома бериллия
| Значения | n | |||||
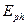 (эксп.) (эксп.)
| eV | 123,7 | 140,4 | 146,3 | 149,0 | 150,5 |
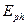 (теор.) (теор.)
| eV | 123,7 | 140,5 | 146,3 | 149,0 | 150,5 |
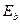 (теор.) (теор.)
| eV | 30,22 | 13,43 | 7,56 | 4,84 | 3,36 |
Второй электрон атома бериллия имеет энергию ионизации 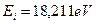 и энергию связи с ядром, соответствующую первому фиктивному энергетическому уровню,
и энергию связи с ядром, соответствующую первому фиктивному энергетическому уровню, 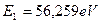 . Подставляя эту величину и энергию ионизации
. Подставляя эту величину и энергию ионизации 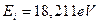 в формулы (32) и (33), найдем (табл. 10).
в формулы (32) и (33), найдем (табл. 10).
Таблица 10. Спектр второго электрона атома бериллия
| Значения | n | |||||
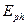 (эксп.) (эксп.)
| eV | - | 11,96 | 14,72 | 15,99 | 16,67 |
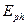 (теор.) (теор.)
| eV | 4,15 | 11,96 | 14,70 | 15,96 | 16,65 |
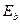 (теор.) (теор.)
| eV | 14,81 | 6,25 | 3,52 | 2,25 | 1,56 |
Первый электрон атома бериллия имеет энергию ионизации 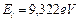 и энергию, соответствующую энергии связи электрона с ядром в момент пребывания его на первом энергетическом уровне,
и энергию, соответствующую энергии связи электрона с ядром в момент пребывания его на первом энергетическом уровне, 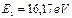 . Подставляя
. Подставляя 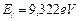 и
и 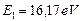 в формулы (32) и (33), найдем (табл. 11).
в формулы (32) и (33), найдем (табл. 11).
Таблица 11. Спектр первого электрона атома бериллия
| Значения | n | |||||||
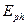 (эксп.) (эксп.)
| eV | 5,28 | 7,46 | 8,31 | 8,69 | 8,86 | 8,98 | 9,07 |
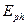 (теор.) (теор.)
| eV | 5,28 | 7,53 | 8,31 | 8,67 | 8,87 | 8,99 | 9,07 |
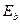 (теор.) (теор.)
| eV | 4,04 | 1,80 | 1,01 | 0,65 | 0,45 | 0,33 | 0,25 |
|
|
|
Таким образом, если мы будем удалять по одному электрону из атома бериллия, то их энергии связи в сравнении с энергиями связи электрона атома водорода будут изменяться так, как показано в табл. 12, но когда они все будут в атоме, то энергии их связи с протонами будут одинаковые (табл. 13). Аналогичные энергии связи электронов с протонами имеют и другие, не первые электроны в атомах, и табл. 5, 6, 7 легко приводятся к виду табл. 13.
Таблица 12. Энергии связи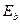 электрона атома водорода
электрона атома водорода 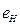 и первого, второго, третьего и четвертого электронов атома бериллия
и первого, второго, третьего и четвертого электронов атома бериллия 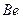 с ядром при их последовательном удалении из атома
с ядром при их последовательном удалении из атома
| n | |||||||||
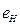
| 13,6 | 3,40 | 1,51 | 0,85 | 0,54 | 0,38 | 0,28 | 0,21 | 0,17 |
| 16,17 | 4,04 | 1,80 | 1,01 | 0,65 | 0,45 | 0,33 | 0,25 | 0,20 | |
| 56,26 | 14,06 | 6,25 | 3,52 | 2,25 | 1,56 | 1,15 | 0,88 | 0,69 | |
| 120,89 | 30,22 | 13,43 | 7,56 | 4,83 | 3,36 | 2,47 | 1,89 | 1,49 | |
| 217,71 | 54,43 | 24,19 | 13,6 | 8,71 | 6,05 | 4,44 | 3,40 | 2,69 | |
| n | |||||||||
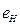
| 0,14 | 0,11 | 0,09 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 |
| 0,16 | 0,12 | 0,10 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 | |
| 0,56 | 0,46 | 0,39 | 0,33 | 0,29 | 0,25 | 0,22 | 0,19 | 0,17 | |
| 1,21 | 1,00 | 0,84 | 0,72 | 0,62 | 0,54 | 0,47 | 0,42 | 0,37 | |
| 2,18 | 1,80 | 1,51 | 1,29 | 1,11 | 0,97 | 0,85 | 0,75 | 0,67 |
Таблица 13. Энергии связи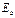 электрона атома водорода
электрона атома водорода 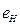 и электронов (1, 2, 3, 4) атома бериллия
и электронов (1, 2, 3, 4) атома бериллия 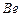 с ядром в момент, когда все они находятся в атоме
с ядром в момент, когда все они находятся в атоме
| n | |||||||||
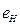
| 13,6 | 3,40 | 1,51 | 0,85 | 0,54 | 0,38 | 0,28 | 0,21 | 0,17 |
| 16,17 | 4,04 | 1,80 | 1,01 | 0,65 | 0,45 | 0,33 | 0,25 | 0,20 | |
| 16,17 | 4,04 | 1,80 | 1,01 | 0,65 | 0,45 | 0,33 | 0,25 | 0,20 | |
| 16,17 | 4,04 | 1,80 | 1,01 | 0,65 | 0,45 | 0,33 | 0,25 | 0,20 | |
| 16,17 | 4,04 | 1,80 | 1,01 | 0,65 | 0,45 | 0,33 | 0,25 | 0,20 | |
| n | |||||||||
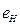
| 0,14 | 0,11 | 0,09 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 |
| 0,16 | 0,12 | 0,10 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 | |
| 0,16 | 0,12 | 0,10 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 | |
| 0,16 | 0,12 | 0,10 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 | |
| 0,16 | 0,12 | 0,10 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 |
|
|
|
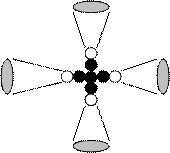
Поскольку из экспериментальной спектроскопии следует отсутствие орбитального движения электронов, то каждый электрон этого атома взаимодействует со своим протоном (рис. 4, 5).
Так как все четыре протона ядра расположены на его поверхности, и каждый из них имеет по одному свободному магнитному полюсу, то с этими полюсами и взаимодействуют магнитные полюса электронов одноименной полярности, ограничивая, таким образом, сближение электронов с протонами. По мере перехода на более высокие энергетические уровни, они удаляются от ядра атома и друг от друга, и их взаимодействие ослабевает. Данные табл. 13 показывают, что, начиная с 13 энергетического уровня, энергии связи всех электронов атома бериллия с ядром оказываются такими же, как и у электрона 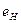 атома водорода. Это значит, что при удалении электронов от ядра атома их взаимное влияние друг на друга почти исчезает, и каждый из них начинает вести себя так же, как и электрон атома водорода [1], [2].
атома водорода. Это значит, что при удалении электронов от ядра атома их взаимное влияние друг на друга почти исчезает, и каждый из них начинает вести себя так же, как и электрон атома водорода [1], [2].
 3
3
1 2
Рис. 5. Схема структуры ядра и атома бериллия:
 1,2,3 и 4 – электроны; - протоны; - нейтроны
1,2,3 и 4 – электроны; - протоны; - нейтроны
Настала очередь проверить роль принципа Паули в атоме бериллия. Как известно, этот принцип используется при описании поведения элементарных частиц и, в частности, электронов в атомах, протонов и нейтронов в ядрах атомов. Согласно этому принципу электроны в атомах распределяются по уровням и подуровням, которых мы не увидели при анализе структуры атома бериллия и спектров его электронов. И это не удивительно, так как в основе принципа Паули лежит орбитальное движение электронов в атомах, которого, как мы показали, они не совершают. Это резко ограничивает рамки использования принципа Паули при описании микромира.
Поскольку уравнение Бора (25) позволяет рассчитывать спектр только атома водорода и водородоподобных атомов и не позволяет определять энергии связи электрона с ядром, то уравнения (32) и (33) имеют явные преимущества. Поэтому метод расчета спектров с использованием этих уравнений заслуживает дальнейшего развития.
Теперь мы видим, как Природа глубоко скрыла тайну поведения электрона в атоме и понимаем, что найти её не так просто, поэтому воздержимся от порицаний в адрес Бора и его экспертов. Тем не менее, у нас нет оправданий для столь длительного поиска этой тайны. Следующая лекция будет посвящена уравнениям Д. Максвелла.
|
|
|
ЛИТЕРАТУРА
1. Канарёв Ф.М. Начала физхимии микромира. Пятое издание. Краснодар 2004. 400 с.
2. Канарёв Ф.М. Начала физхимии микромира. Шестое издание. 500 с. Подготовлено к печати.
3. Зайдель А.Н. и др. Таблицы спектральных линий. М. «Наука».1977.
4. Стриганов А.Р., Одинцова Г.А. Таблицы спектральных линий. М.: «Наука». 1982.
5. Храмов Ю.А. Физики. М. «Наука». 1983. 395с.
6. Канарев Ф.М. Анализ фундаментальных проблем современной физики. Краснодар, 1993. 255 с.
7. Мэрион Дж. Б. Физика и физический мир. М.: «Мир». 1975.
8. Березин Ф.А., Шубин М.А. Уравнение Шредингера. М.: Изд-во МГУ, 1983.
9. Джеммер М. Эволюция понятий Квантовой механики. М. «Наука», 1985. 380 с.
10. Никитин А.А. Рудзикас З.Б. Основы теории спектров атомов и ионов. М.: «Наука». 1983.
11. Э.В. Шпольский. Атомная Физика. Том 1. М. 1963. 575с.
12. Спроул Р. Современная физика. Квантовая физика атомов твердого тела и ядер. М. «Наука» 1974. 591с.
13. Вихман Э. Квантовая физика. М.: «Наука» 1977. 415 с.
14. Новошинский И.И., Новошинская Н.С. Химия. Учебник для 10-го класса. М. «Оникс 21 век», «Мир и образование». 2004. 350 с.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 423; Нарушение авторских прав?; Мы поможем в написании вашей работы!