
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термомассоперенос
|
|
|
|
Адгезия
Адгезия — слипание поверхности двух разнородных тел. В кулинарной практике явление адгезии довольно широко распространено и часто играет отрицательную роль. Так, при жарке мясных и рыбных полуфабрикатов прилипание их к жарочной поверхности крайне нежелательно. Для уменьшения адгезии полуфабрикаты панируют в муке или сухарях и используют при жарке жир.
Отрицательную роль играет адгезия и при транспортировке мясного фарша по трубам в поточных линиях при производстве котлет. Трубопроводы засаливаются, на их стенках нарастает слой жира. Адгезия затрудняет и формовку изделий.
Уменьшение адгезии весьма актуально при выпечке изделий из теста, а также при изготовлении самого теста (потери в деже, на лопастях тестомесильных машин, на разделочных столах и т. д.). Одним из способов снижения степени адгезии является использование муки "на подпыл" при формовке изделий. В этом случае с поверхностью противней контактирует уже не тесто, а мука, адгезия которой к поверхности инвентаря значительно меньше. Часть муки при этом прилипает к тесту и попадает в готовые изделия, а часть теряется.
Для предупреждения прилипания кулинарной продукции в процессе ее тепловой обработки в последние годы широко используют оборудование и инвентарь со специальным покрытием, прослойки из полимерных материалов, так называемых антиадгезивов. Использование антиадгезивов повышает культуру производства и производительность труда. Обязательным условием применения полимерных материалов являются их безвредность, инертность по отношению к пищевому продукту и устойчивость при нагревании. Причем термостойкость должна сохраняться длительное время.
Как уже отмечалось, поверхностный нагрев создаёт в продуктах градиент температуры и вызывает перемещение влаги. Пищевые продукты представляют собой капиллярно-пористые тела. В капиллярах на влагу действуют силы поверхностного натяжения. Если оба конца капилляра имеют одинаковую температуру, то влага в нем находится в равновесии. Если же один конец капилляра нагреть, то поверхностное натяжение его уменьшится. Но поскольку на другом конце капилляра оно будет прежним, жидкость вместе с растворенными в ней веществами будет передвигаться от нагретого конца к холодному. Благодаря этому возникает поток влаги от нагретой поверхности продукта к его холодному центру (термодиффузия). Одновременно часть влаги с поверхности изделия под действием высокой температуры испаряется. Поверхностный слой быстро обезвоживается, в нем повышается температура, под действием которой глубокие изменения претерпевают отдельные пищевые вещества (меланоидинообразование, декстринизация крахмала, карамелизация сахарови др.), в результате чего на продукте образуется румяная корочка. Образовавшаяся корочка уменьшает потери влаги, а, следовательно, и массы изделия за счет испарения. Чем горячее поверхность при жарке, чем выше градиент температуры, тем быстрее образуется корочка. По мере образования обезвоженного поверхностного слоя возникает разница в содержании влаги (градиент влагосодержания). В поверхностных слоях влагосодержание меньше, в глубине—больше, вследствие чего поток влаги направляется к поверхности. При стационарном тепловом режиме устанавливается равновесие этих двух потоков: направленного к центру (вызванного термомассопереносом) и направленного к поверхности (вызванного градиентом влагосодержания).
3.2. Изменения белков
Белки относятся к основным химическим компонентам пищи. Они имеют и другое название — протеины, которое подчеркивает первостепенное биологическое значение этой группы веществ (от гр. protos — первый, важнейший).
Значение белков в кулинарных рецептурах. Белки являются структурными элементами клеток; служат материалом для образования ферментов, гормонов и др.; влияют на усвояемость жиров, углеводов, витаминов, минеральных веществ и т. д. Ежесекундно в нашем организме отмирают миллионы клеток и для восстановления их взрослому человеку требуется 80—100 г белка в сутки, причем заменить его другими веществами невозможно. Поэтому технологи, занятые организацией питания постоянного контингента потребителей по дневным рационам (интернаты, санатории, больницы и т. д.) или скомплектованному меню отдельных, приемов пищи, должны обеспечивать содержание белка в блюдах, соответствующее физиологическим потребностям человека.
Пользуясь таблицами химического состава готовых блюд, можно разработать меню рациона так, чтобы удовлетворить потребность питающихся в белках, как по количеству, так и по качеству, т. е. обеспечить биологическую ценность.
Биологическая ценность белков определяется содержанием незаменимых аминокислот (НАК), их соотношением и перевариваемостью. Белки, содержащие все НАК (их восемь: триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин, фенилаланин) и в тех соотношениях, в каких они вводят в белки нашего организма, называются полноценными. К ним относятся белки мяса, рыбы, яиц, молока. В растительных белках, как правило, недостаточно лизина, метионина, триптофана и некоторых других НАК. Так, в гречневой крупе недостает лейцина, в рисе и пшене — лизина. Незаменимая аминокислота, которой меньше всего в данном белке, называется лимитирующей. Остальные аминокислоты усваиваются в адекватных с ней количествах. Один продукт может дополнять другой по содержанию аминокислот. Однако такое взаимное обогащение происходит только в том случае, если эти продукты поступают в организм с разрывом во времени не более чем 2—3 ч. Поэтому большое значение имеет сбалансированность по аминокислотному составу не только суточных рационов, но и отдельных приемов пищи и даже блюд. Это необходимо учитывать при создании рецептур блюд и кулинарных изделий, сбалансированных по содержанию НАК.
Наиболее удачными комбинациями белковых продуктов являются:
♦ мука + творог (ватрушки, вареники, пироги с творогом);
♦ картофель + мясо, рыба или яйцо (картофельная запеканка с мясом, мясное рагу, рыбные котлеты с картофелем и др.);
♦ гречневая, овсяная каша + молоко, творог (крупеники, каши с молоком и др.);
♦ бобовые с яйцом, рыбой или мясом.
Наиболее эффективное взаимное обогащение белков достигается при их определенном соотношении, например:
♦ 5 частей мяса + 10 частей картофеля;
♦ 5 частей молока + 10 частей овощей;
♦ 5 частей рыбы + 10 частей овощей;
♦ 2 части яиц +10 частей овощей (картофеля) и т. д.
Усвояемость белков зависит от их физико-химических свойств, способов и степени тепловой обработки продуктов. Например, белки многих растительных продуктов плохо перевариваются, так как заключены в оболочки из клетчатки и других веществ, препятствующих действию пищеварительных ферментов (бобовые, крупы из цельных зерен, орехи и др.). Кроме того, в ряде растительных продуктов содержатся вещества, тормозящие действие пищеварительных ферментов (фазиолин фасоли).
По скорости переваривания на первом месте находятся белки яиц, молочных продуктов и рыбы, затем мяса (говядина, свинина, баранина) и, наконец, хлеба и крупы. Из белков животных продуктов в кишечнике всасывается более 90% аминокислот, из растительных — 60—80%.
Размягчение продуктов при тепловой обработке и протирание их улучшает усвояемость белков, особенно растительного происхождения. Однако при избыточном нагревании содержание НАК может уменьшиться. Так, при длительной тепловой обработке в ряде продуктов снижается количество доступного для усвоения лизина. Этим объясняется меньшая усвояемость белков каш, сваренных на молоке, по сравнению с белками каш, сваренных на воде, но подаваемых с молоком. Чтобы повысить усвояемость каш, рекомендуется крупу предварительно замачивать для сокращения времени варки и добавлять молоко перед окончанием тепловой обработки.
Качество белка оценивается рядом показателей (КЭБ — коэффициент эффективности белка, ЧУБ — чистая утилизация белка и др.), которые рассматривает физиология питания.
Химическая природа и строение белков. Белки — это природные полимеры, состоящие из остатков сотен и тысяч аминокислот, соединенных пептидной связью. От набора аминокислот и их порядка в полипептидных цепях зависят индивидуальные свойства белков.
По форме молекулы все белки можно разделить на глобулярные и фибриллярные. Молекула глобулярных белков по форме близка к шару, а фибриллярных имеет форму волокна.
По растворимости все белки делятся на следующие группы:
♦ растворимые в воде — альбумины;
♦ растворимые в солевых растворах — глобулины;
♦ растворимые в спирте — проламины;
♦ растворимые в щелочах — глютелины.
По степени сложности белки делятся на протеины (простые белки), состоящие только из остатков аминокислот, и протеиды (сложные белки), состоящие из белковой и небелковой частей.
Различают четыре структуры организации белка:
♦ первичная — последовательное соединение аминокислотных остатков в полипептидной цепи;
♦ вторичная — закручивание полипептидных цепей в спирали;
♦ третичная — свертывание полипептидной цепи в глобулу;
♦ четвертичная — объединение нескольких частиц с третичной структурой в одну более крупную частицу.
Белки обладают свободными карбоксильными или кислотными и аминогруппами, в результате чего они амфотерны, т. е. в зависимости от реакции среды проявляют себя как кислоты или как щелочи. В кислой среде белки проявляют щелочные свойства, и частицы их приобретают положительные заряды, в щелочной они ведут себя как кислоты, и частицы их становятся отрицательно заряженными.
При определенном рН среды (изоэлектрическая точка) число положительных и отрицательных зарядов в молекуле белка одинаково. Белки в этой точке электронейтральны, а их вязкость и растворимость наименьшие. Для большинства белков изоэлектрическая точка лежит в слабокислой среде.
Наиболее важными технологическими свойствами белков являются: гидратация (набухание в воде), денатурация, способность образовывать пены, деструкция и др.
Гидратация и дегидратация белков. Гидратацией называется способность белков прочно связывать значительное количество влаги. Гидрофильность отдельных белков зависит от их строения. Расположенные на поверхности белковой глобулы гидрофильные группы (аминные, карбоксильные и др.) притягивают молекулы воды, строго ориентируя их на поверхности. В изоэлектрической точке (когда заряд белковой молекулы близок к нулю) способность белка адсорбировать воду наименьшая. Сдвиг рН в ту или иную сторону от изоэлектрической точки приводит к диссоциации основных или кислотных групп белка, увеличению заряда белковых молекул и улучшению гидратации белка. Окружающая белковые глобулы гидратная (водная) оболочка придает устойчивость растворам белка, мешает отдельным частицам слипаться и выпадать в осадок.
В растворах с малой концентрацией белка (например, молоко) белки полностью гидратированы и связать воду не могут. В концентрированных растворах белков при добавлении воды происходит дополнительная гидратация. Способность белков к дополнительной гидратации имеет в технологии пищи большое значение. От нее зависят сочность готовых изделий, способность полуфабрикатов из мяса, птицы, рыбы удерживать влагу, реологические свойства теста и т. д.
Примерами гидратации в кулинарной практике являются: приготовление омлетов, котлетной массы из продуктов животного происхождения, различных видов теста, набухание белков круп, бобовых, макаронных изделий и т. д.
Дегидратацией называется потеря белками связанной воды при сушке, замораживании и размораживании мяса и рыбы, при тепловой обработке полуфабрикатов и т. д. От степени дегидратации зависят такие важные показатели, как влажность готовых изделий и их выход.
Денатурация белков. Белки по форме молекулы можно подразделить на глобулярные и фибриллярные. У глобулярных белков молекула близка кформе шара или эллипсоида, (отношение длины к ширине близко 1:1 или 3: 1),а у фибриллярных она имеет форму нити (длина примерно в 200 раз больше ширины). К фибриллярным белкам относятся: коллаген, эластин, осеин, а к глобулярным — альбумины, глобулины, миоген и др.
Молекулы белков построены из большого количества l -аминокислот, связанных в длинные цепочки полипептидов при помощи полипептидной связи — СО – NH –.Благодаря пространственному расположению валентностей у атомовуглерода и водорода цепочки аминокислот приобретают характерную форму. Аминокислотные цепи связаны между собой прочными водородными связями (водородный атом притягивается к атомам кислорода). Последовательность аминокислотных остатков и водородных связей между ними различная, что создает на поверхности белковой молекулы специфический рельеф из боковых цепей аминокислот (в схеме обозначены буквой R). Этот рельеф из водородных связей и остатков аминокислот определяет отличия одних белков от других, создает центры ферментативной активности и другие специфические свойства белков.
В фибриллярных белках спирали вытянуты и водородные связи направлены перпендикулярно оси спирали, т. е. связывают между собой отдельные, параллельно расположенные цепочки аминокислот.
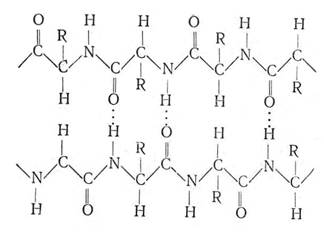
В глобулярных белках цепи аминокислот свернуты и имеют форму шара или эллипсоида. Конфигурация аминокислотных цепей, их изгибы специфичны для каждого белка. В этом положении их удерживают водородные связи. Состав аминокислот, порядок их расположения в полипептидной цепочке и конфигурация их в глобуле определяют свойства нативных белков.
Чем ближе состав аминокислот к составу белков организма человека, тем полноценнее белок. Ниже приводится суточная потребность в незаменимых аминокислотах для взрослого человека.
| Наименование аминокислот | Потребность человека, г |
| Триптофан………………...... | |
| Лейцин……………………… | 4-6 |
| Изолейцин………………….. | 3-4 |
| Валин……………………….. | |
| Треонин…………………….. | 2-3 |
| Лизин……………………….. | 3-5 |
| Метионин…………………... | 2-4 |
| Фенилаланин……………….. | 2-4 |
Под влиянием ряда факторов водородные связи, удерживающие, свернутые аминокислотные цепи в глобуле в определенном положении, могут разорваться, а затем снова свернуться, но уже иначе. Этот процесс перегруппировки аминокислотных (полипептидных) цепей называется денатурацией. Схема процесса денатурации представлена на рис.1, В зависимости от характера воздействия полипептидные цепи могут остаться в развёрнутомсостоянии, свернуться или принять первоначальную конфигурацию. Степень денатурации может быть различной — от незначительных изменений до полной потери первоначальных свойств.
Денатурацию может вызвать ряд факторов: воздействие высоких температур, кислот, щелочей, солей тяжелых металлов, дубильных веществ и т. д.
В кулинарной практике чаще всего имеет место воздействие высоких температур на продукты, содержащие белки, при их варке и жаренье.
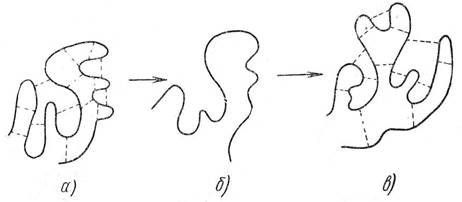
Рис. 1. Схема процесса денатурации:
а) нативный белок; б) переходное состояние; в) Денатурированный белок (жирная линия— полипептидные цепи, пунктирная — вторичные связи).
Денатурация вызывает изменение свойств нативных белков: потеря растворимости и способности кристаллизироваться, увеличение перевариваемости под действием ферментов («атакуемости ферментами»), потеря биологической активности ферментами, которые также относятся к белковым веществам.
Следствием тепловой денатурации является тепловая коагуляция или свертывание белков. Происходит оно обычно в изоэлектрической точке. Белки так же, как и составляющие их аминокислоты, амфотерны, т. е. обладают кислотными и основными свойствами. Объясняется это тем, что они содержат кислотные (карбоксильные) и основные (аминные) группы и поэтому являются амфотерными электролитами.
Диссоциацию их можно представить следующей схемой:
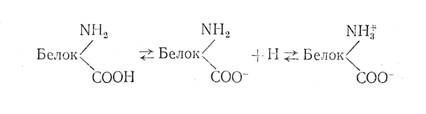
Из схемы видно, что, если водородные ионы присоединяются к аминной группе, то образуются частицы, несущие одновременно положительный и отрицательный заряды. Поэтому белок может вести себя как основание и как кислота. Зависит это от реакции среды (рН): в кислой среде белок ведет себя как основание, в щелочной — как кислота.
Однако при определенной реакции среды (рН) количество положительных и отрицательных зарядов может быть равным и молекула белка станет электронейтральной. Такое состояние молекулы белка называется изоэлектрическим, а рН, при которой оно наступает, — изоэлектрической точкой.
В изоэлектрической точке белковые молекулы не имеют заряда. Между тем наличие заряда придает им устойчивость.
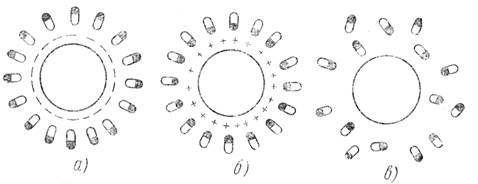
Рис. 2. Схема гидратной оболочки белковой молекулы:
а и б — оболочка из ориентированных молекул; в — без гидратной оболочки
Объясняется это тем, что заряженная частица белка притягивает полярные молекулы воды и они образуют защитную гидратную оболочку вокруг, препятствующую их слипанию, укрупнению их выпаданию в осадок. В изоэлектрической точке такой оболочки, естественно, нет и белки легко выпадают в осадок (свертываются (рис. 2).
Свертывание белков в результате изменения рН среды частовстречается в кулинарной практике: свертывание белка мяса при добавлении кислот, помутнение желе вокруг ломтиков лимона, быстрое свертывание поверхности яйца при варке его без скорлупы вподкисленной воде и т. п.
Свёртываниеможет быть двух типов:
1) если концентрация белка была незначительна, то свернувшиеся белкиобразуют хлопья (например, хлопья свернувшихся белков наповерхности мясных и рыбных бульонов, овощных отваров и т. д.);
2) если концентрация белка была значительна, то обычно они образуют при свертывании сплошную студнеобразную массу (гель); например, уплотнение белка яйца при варке.
Если белок в продукте находится уже в состоянии студия (геля), то денатурация приводит к третьему типу свертывания— уплотнению студня и выделению содержащейся в нем жидкости.
В фибриллярных белках (коллаген и др.) нагревание вызывает изменения другого характера. Полипептидные цепочки в них вытянуты и связаны друг с другом водородными связями. При нагревании тепловое движение полипептидных цепочек усиливается, водородные связи между ними рвутся и это приводив к двум характерным явлениям:
1) распаду фибрилл (волокон) белка на отдельные цепочки аминокислот (дезагрегация, т. е. распад больших молекулярных агрегатов);
2) сокращению в длину вытянутых аминокислотных цепочек за счет разрыва внутренних связей («сваривание»).
При длительном нагревании в присутствии воды, кислот и других электролитов белки подвергаются глубокому распаду. При этом могут разрываться аминокислотные цепочки с образованием полипептидов (обрывки цепей из нескольких аминокислот) и даже свободные аминокислоты. Процесс сопровождается выделением аммиака, сероводорода и других веществ.
Таким образом, основные изменения, происходящие в белках при их нагревании в процессе кулинарной обработки, можно представить такой схемой:

|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 2774; Нарушение авторских прав?; Мы поможем в написании вашей работы!