
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Белки мяса
|
|
|
|
Строение мышечной ткани мяса. Мышечная ткань мяса состоит из очень тонких длинных мышечных волокон. Толщина их меньше 0,1—0,15 мм, а длина достигает нескольких сантиметров. Сверху мышечные волокна окружены оболочкой — сарколеммой, состоящей из фибриллярных белков. Внутри мышечного волокна находятся студнеобразные нити — миофибриллы и жидкость — саркоплазма. Саркоплазма не только пропитывает студень миофибрилл, но и окружает их (рис. 3).
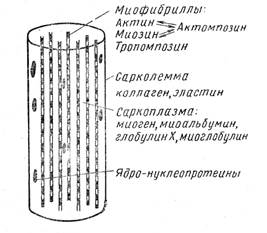
Мышечные, волокна соединяются по нескольку вместе и образуют первичный мышечный пучок. Первичные пучки сгруппировываются в более крупные, вторичные, которые образуют еще более крупные — третичные и т.д., и, наконец, целую мышцу. Все мышечные волокна соединены между собой соединительной тканью, называемой мизием. Она же окружает мышцу сверху оболочкой (пленкой). Между мышечными волокнами внутри первичных пучков находится наиболее нежная соединительная ткань — эндомизий (эндо — внутренний). Эндомизий непосредственно переходит в более грубую
Рис.3 Строение мышечного волокна. соединительную ткань, расположенную между мышечными волокнами — перимизий (промежуточный мизий), а сверху мышца окружена еще более грубой соединительной тканью — эпимизием, т. е. наружной соединительной тканью (рис. 4). 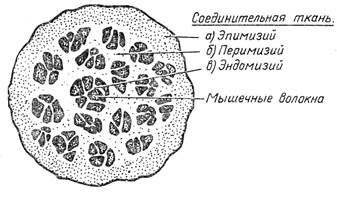
Изменение мышечных белков, при кулинарной обработке. Студнеобразные миофибриллы, расположенные,.внутри мышечных волокон, состоят из глобулярных белков миозина, актиномиозина и других, а также фибриллярного белка актина. Эти белки находятся в состоянии студня.
Жидкое содержимое мышечных волокон
Рис.4 Схема строения мышечной ткани представляет собой водный раствор белков (глобулина, миогена, миоглобина и др.), растворимых азотистых и безазотистых экстрактивных веществ, минеральных солей и т. д.
Количество мышечных белков в мякоти говяжьей туши в среднем составляет около 13,4%, в бараньей и свиной - несколько меньше (за счет большего количества жира). В различных частях туши содержание мышечных белков неодинаково, так, например, у говяжьей туши меньше всего их в голяшках (6—10%), немного больше в грудинке и пашине (11%) и больше всего в толстом и тонком краях, вырезке, мякоти задней ноги (до 14,3%).
Для сравнения на рис. 5 показано содержание мышечных белков и белков соединительной ткани в частях мяса 1-го сорта (мякоть задней четверти: вырезка, тонкий край, задняя нога) и 3-го сорта (голяшка).
Состав мышечных белков следующий: миофибриллы — актин, миозин (актомиозин);
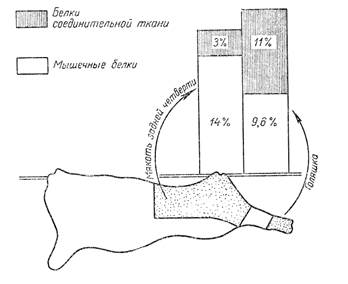
Рис.5 Содержание белков в говядине 1-го и 3-го сортов
саркоплазма — миоген, миоальбумин, глобулин X, миоглобулин;
ядра — неуклеопротеиды; саркоплазма — коллаген, эластин.
Миозин составляет 35% всех белков мышечной ткани; встречается он также в мышцах птиц и рыб. При обработке водой миозин в раствор не переходит, но при добавлении соли (около 2—3%) хорошо растворяется и переходит в раствор. Поэтому добавлять соль в холодную воду (до нагревания) при варке бульонов не рекомендуется.
Актин составляет 12-15 % мышечных белков. Он может существовать в двух формах — глобулярной и фибриллярной.
Актомиозин —белок, из которого в основном построены миофибриллы. Он отличается высокой вязкостью, не растворяется в воде, а только в растворе солей.
Тропомиозин — также структурный белок миофибрилл, не растворяется в воде, но растворяется в солевых растворах.
Глобулин X —в воде нерастворим, но при добавлении соли переходит в раствор.
Миоген и миоальбумин — хорошо растворимы в воде.
Миоглобин сложный белок хромопротеид. При гидролизе он распадается на белок и небелковую группу — гем. От миоглобина зависит окраска мышц. В работающих мышцах его содержится больше. Например, мышцы ног окрашены сильнее, чем спинные; говядина темнее телятины; грудные мышцы у птиц (белое мясо, филе) почти не окрашены.
При тепловой обработке (жаренье, варке) растворенные мышечные белки, содержащиеся в саркоплазме, денатурируют и свертываются, а белки миофибрилл,. находящиеся в виде студня, уплотняются и выпрессовывают содержащуюся в них жидкость вместе с растворимыми в ней веществами.
Денатурация растворимых мышечных белков мяса начинается при 30—35°, и к тому времени, как мясо прогреется до 60— 65°, около 90% всех растворимых белков денатурируют и теряют растворимость. Однако даже прогревание мяса до 95—100° невызывает полной денатурации белков, и некоторая часть их сохраняет способность растворяться.
Уплотнение белковых гелей миофибрилл приводит не, только к выпрессовыванию жидкости, но и уплотнению мышечных волокон, повышению их прочности.
При варке мяса и птицы, пока продукты не прогрелись, часть водорастворимых белков (миоген) переходит в воду, образует очень разбавленный раствор ипри дальнейшем нагревании, свертывается, выделяясь в виде хлопьев на поверхности бульона.
Есливоду, в которой варится мясо или птица, посолить до прогревания продуктов, то в раствор перейдет больше белков за счет глобулинов (растворимых в присутствии солей) и количество пены увеличится). Поэтому при варке мяса воду солят после того, как мясо прогреется и белки потеряют способность растворяться.
Изменение белков соединительной ткани мяса. Соединительная ткань может быть рыхлой (сопровождает кровеносные сосуды, заполняет промежутки между органами, образует подкожную клетчатку), плотной с большим содержащем коллагена (сухожилия, кожные покровы, фасции), плотной с большим содержанием эластина (желтые связки, например выйная). Из коллагеновой ткани состоят и соединительные прослойки между пучкамимышц (мизий).
Чем больше в ткани эластина и меньше коллагена, тем труднее и меньшеона размягчается при тепловой обработке.
| Соединительная ткань мяса, продукты | Содержание, % | ||
| эластина | коллагена | альбуминов и глобулинов | |
| Ножное сухожилие | 2,6 | 31,6 | 0,2 |
| Выйная связка | 31,7 | 7,2 | 0,6 |
| Уши | 2,3 | 17,0 | 4,9 |
| губы | 3,5 | 12,0 | 5,5 |
Сырьё с большим содержанием коллагена (уши, губы) целесообразно использовать для варки студней. Значительное количество коллагеновой ткани и мышечных белков содержат голяшки, поэтому из них также можно варить студень.
Особой разновидностью соединительной ткани является хрящевая, которая состоит из округлых клеток и сильно развитого межклеточного вещества. В зависимости от межклеточного вещества хрящи бывают гиалиновые, эластичные и волокнистые. Они содержат 17—20% -белка, 3—5% жира и небольшое количество гликогена.
Большое значение имеет изменение белков соединительной ткани мышц коллагена и эластина.
Коллаген относится к фибриллярным белкам. В его молекуле, кроме белковой основы, содержатся и углеводы. Коллаген неоднороден; различают три разновидности его: проколлаген, тропоколлаген, обычный или зрелый коллаген.
Тропоколлаген растворяется в растворах нейтральных солей; проколлаген—в слабых растворах кислот. Их больше в соединительной ткани молодых животных. С возрастом животных они переходят в зрелый коллаген, который не растворяется. Однако в соединительной ткани взрослых животных сохраняется незначительное количество биологических предшественников зрелого коллагена — тропо- и проколлаген.
Эндомизий состоит из волокон коллагена, которые располагаются параллельными пучками. Эндомизий во всех частях туши обладает более или менее одинаковыми свойствами.
Перимизий отличается от эндомизия тем, что он состоит не только из волокон коллагена, но и из волокон другого фибриллярного белка — эластина. Перимизий в отдельных частяхтуши неодинаков, и различия в его свойствах в значительноймере определяют кулинарное использование мяса. В такихчастях туши, как вырезка, тонкий и толстый края, верхняя ивнутренняя части задней ноги, он очень нежен и по строению похож на эндомизий, толькоколлагеновые волокна в нем болеетолстые и, наряду с ними имеются волокна эластина. Однако чем грубее мышца, чем больше работала она при жизни животного, темколлагеновые волокна перимизия толще, тем больше в ней эластиновых волокон и сложнее сама структура ткани. Волокна ее ветвятся, образуют сложные переплетения и придают мышцам жесткость (шея, голяшка, пашина).
Больше всего эластина в шейных мышцах, пашине и меньше всего в частях задней четверти (кроме пашины). При нагревании мяса в процессе кулинарной обработки эластиновые волокна изменяются мало.
Коллагеновые волокна имеют следующее строение: отдельные микромолекулы коллагена соединяются в фибриллы, фибриллы объединяются в волокна, которые могут образовывать пучки. Коллагеновые волокна при температуре около 60° свариваются, сокращаясь почти наполовину своей первоначальной длины.
Сокращенные волокна коллагена резко отличаются от нативных. Это связано с денатурацией. Они менее устойчивы против действия пищеварительных ферментов. Сваривание коллагена приводит к следующему: 1) куски мяса при жаренье, варке деформируются; 2) мясной сок вместе с растворимыми белками, экстрактивными веществами и минеральными солями выпрессовывается в окружающую среду.
Чтобы куски мяса, особенно при жаренье, не деформировались, их отбивают или делают насечки, перерезая соединительную ткань. Если мясо измельчить, нарушив непрерывность соединительной ткани, то сок при тепловой обработке изделий не выпрессовывается, и они меньше теряют в весе (варка фрикаделек, жаренье бифштексов рубленых и т. д.).
Одновременно происходит набухание коллагеновых волокон, разрыв водородных связей между отдельными аминокислотными цепочками и постепенное превращение нерастворимого коллагена в растворимое более простое вещество — глютин или желатин. Превращение коллагена в глютин приводит к потере механической прочности, так как связь между мышечными волокнами нарушается.
Скорость распада коллагена зависит от многих причин. Чем грубее соединительная ткань (перимизий), чем сложнее ее строение, тем медленнее распадается в ней коллаген. В связи с этим для размягчения мяса 3-го сорта при тепловой обработке требуется гораздо больше времени, чем для доведения до готовности мяса 2-го или 1-го сорта. Естественно, что, если попытаться жарить мясо 3-го или 2-го сорта, то оно высохнет раньше, чем коллаген успеет превратиться в глютин. Поэтому для жаренья пригодна говядина только 1-го сорта. У мелкого скота различия в строении перимизия в разных частях туши меньше, и поэтому для жаренья пригодно и мясо 2-го сорта.
Распад коллагена в кислой среде происходит быстрее. Это объясняется тем, что, во-первых, коллаген неоднороден и одно из составляющих его веществ (проколлаген) растворимо в подкисленной среде, а, во-вторых, кислота действует как катализатор, ускоряя переход коллагена в глютин. На этом основано маринование мяса перед жареньем и применение кислых соусов для тушения грубых частей мяса. Распад коллагена происходит тем быстрее, чем выше температура. Растворы, содержащие более 1% лютина, способны при охлаждении застывать, превращаясь в студни. На этом основаны приготовление заливных холодных блюд с желатином и варка студней.
Схематически переход коллагена в желатин (глютин) можно представить следующим образом:
коллаген→расщепление поперечных связей (сваривание) →расщепление пептидных связей, отщепление углеводов→дальнейшая частичная потеря структуры волокон.
Желатин (глютин) по своему аминокислотному составу идентичен коллагену. В нем отсутствует триптофан, и поэтому он относится к неполноценным белкам. В костях содержится фибриллярный белок, близкий по строению к коллагену, — осеин. При варке костных бульонов часть его переходит в глютин.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 6023; Нарушение авторских прав?; Мы поможем в написании вашей работы!