
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ферментативні методи
|
|
|
|
Для визначення N -кінцевої амінокислоти використовують лейцинамінопептидазу, С -кінцевої – панкреатичні карбоксипептидази – розрив поліпептидного ланцюга з С -кінця, хроматографія.
Вторинна структура білка – це просторово упорядкована будова поліпептидних ланцюгів, обумовлена водневими зв'язками між групами С=О і N–Н різних амінокислот. Цей процес відбувається не хаотично, а у відповідності з програмою, що закладена у первинній структурі.
Детально досліджені дві основні конфігурації a-спіраль (правозакрученої) та b-конформація.
Одним з основних елементів вторинної структури білків є a-спіраль. Це – права спіраль (запропонована Лайнусом Полінгом і Робертом Кору), що містить 3,6 амінокислотні залишки на виток і з періодом повторюваності (кроком)5,4Ǻ або 0,54 нм. Поліпептидний кістяк утворює щільні витки навколо довгої осі молекули, тоді як бічні радикали виступають назовні. Спіраль утримується внутрішньомолекулярними водневими зв'язками між групами N–Н одного пептидного зв'язку і атомом Оксигену групи С=О, що належить іншому пептидному зв'язку, розташованої через чотири амінокислотних залишки над першою в наступному витку спіралі. Період ідентичності, тобто довжина відрізка спіралі, яка повністю повторюється по ходу її становить 2,7 нм і включає 18 залишків амінокислот. Деякі амінокислоти (аланін, валін, лейцин, метіонін, фенілаланін, тирозин, триптофан, гістидин тощо) здатні до утворення a-спіралі, особливо коли вони розміщені поряд у поліпептидному ланцюгу. Інші амінокислоти такі, як лізин, аргінін, гліцин, серин, треонін, аспарагінова і глутамінова кислоти, сприяють дестабілізації a-спіралі. Разом з цим окремі амінокислоти, зокрема пролін і оксипролін, просторово в спіральну структуру не вкладаються. На цих ділянках напрям поліпептидного ланцюга змінюється на 103°, і спіральна структура порушується.
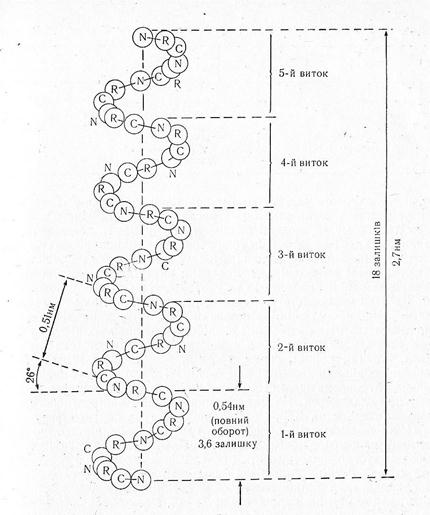
Рис. Вторинна структура білка. α-спіраль
Другим елементом вторинної структури білків єb-конформація. Остов поліпептидного ланцюга в b-конформації виглядає таким чином, що має вже не спіральну, а зиґзаґоподібну, гофровану форму. Вважають, що b-структура може існувати у двох різновидностях. Перша дістала назву антипаралельного складчастого шару. Вона утворена антипаралельними поліпептидними ланцюгами, тобто ланцюгами, N -кінці яких напрямлені в протилежні боки. Друга різновидність b-структури має назву паралельного складчастого шару. Утворюється вона в тому випадку, коли N -кінці поліпептидних ланцюгів напрямлені в один бік. Для b-конформації характернi міжланцюгові водневізв'язки між пептидними

Рис. Вигляд b-структури – складчастий лист, де R-радикали амінокислот
групами сусідніх поліпептидних ланцюгів. Для того, щоб сусідні ділянки білкової послідовності розташувалися в орієнтації, котра сприяє утворенню міжланцюгових водневих зв'язків, між ними має знаходиться неструктурована ділянка, здатна утворити b-вигин. Якщо складчастий ланцюг вигинається робить поворот назад і йде вздовж самого себе назад (антипаралельна b - конформація). Місце повороту – b-вигин.
Вважають, що b-структура може iснувати у двох різновидностях. Перша дістала назву антипаралельного складчастого шару. Вона утворена антипаралельними поліпептидними ланцюгами, тобто ланцюгами, N -кінці яких напрямлені в протилежні боки. Друга різновидність b-структури має назву паралельного складчастого шару. Утворюється вона в тому випадку, коли N -кінці поліпептидних ланцюгів напрямлені в один бік. b-Структура характерна для білків опірних тканин – колагену (білок сухожилля, шкіри), фіброїну (білок шовку), окремих видів кератину (білок шерсті, волосся) та ін. У деяких білках можливі переходи від a-спіралі до b-структури і, навпаки, внаслідок перебудови водневих зв'язків. У багатьох білках одночасно зустрічаються a-спіральні ділянки і ділянки b-структури. Таке поєднання даних видів структур характерне в основному для окремих глобулярних білків.

Рис. Схематичне зображення b-структур: а -паралельні ланцюги, б -антипаралельні ланцюги.

Рис. Антипаралельна b-структура білка та b-вигін.
b-Структура характерна для білків опірних тканин – колагену (білок сухожилля, шкіри), фіброїну (білок шовку), окремих видів кератину (білок шерсті, волосся) та ін. У деяких білках можливі переходи від a-спіралі до b-структури і, навпаки, внаслідок перебудови водневих зв'язків.Наприклад, a-кератин переходить в b-кератин під час миття волосся кучеряве волосся випрямляється. У багатьох білках одночасно зустрічаються a-спіральні ділянки і ділянки b-структури. Таке поєднання даних видів структур характерне в основному для окремих глобулярних білків.
Отже,a-спіраль та b-структура становлять другий порядок, або рівень, структурної організації молекули білка, тобто вторинну структура, в стабілізації якої важливу роль відіграють водневі зв'язки.
Яку саме конформацію приймають ділянки поліпептидного ланцюга (a-спіраль, b - складку, b - вигин або залишаються неструктурованими) у значній мірі визначається первинною послідовністю поліпептидного ланцюга.
Третинна структура білка – це просторова конформація поліпептиду, що має вторинну структуру, і обумовлена взаємодіями між радикалами.
Усі біологічні властивості білків пов'язані з цілістністю їх третинної структури, яку прийнято називати нативною конформацією. Будь-які порушення нативної конформації призводять до часткової або повної втрати біологічної функції.
Структура біополімерів найтіснішим чином пов'язана з їхньою біологічною функцією. Для того, щоб виконувати «будівельні» опорні функції (волосяний покрив, зміцнення стінок клітини, цитоскелет клітини і т.п.) білок повинен мати витягнуту лінійну структуру і не розчинятися у воді. Такі білки називаються фібрилярними.
Структура фібрилярних білків (колаген, кератин волосся, еластин судин) Що б володіти витягнутою нитковидною структурою, білок має бути високо структурований, тобто мати вторинну структуру (a-спіральної або b-складчастої) на великому проміжку. Крім того, у первинній структурі повинні переважати неполярні амінокислоти. Високий ступінь структурованості фібрилярних білків не дозволяє їм звертатися в компактні структури (глобули) і гідрофобні радикали амінокислотних залишків експоновані у воду, що забезпечує нерозчинність у воді. Найбільш розповсюдженими структурними мотивами фібрилярних білків є навиті одна на іншу a-спіралі (суперспіраль) або антипаралельні b-шари. Окремо стоїть потрійна спіраль колагену – основного білка сполучної тканини.
Поліпептидні ланцюги коллагена побудовані з блоків, що чергуються, GІу-Х-Рго або Gіу-Х-Нур (Нур – оксипролин). Як пролін, так і оксипролін перешкоджають утворенню a-спіралей і b-складок. Потрійна спіраль коллагена принципово відрізняється від a-спіралі, це дуже слабко закручена (один оберт на 1000 А) ліва спіраль.
|
|
|
|
|
Дата добавления: 2014-10-22; Просмотров: 783; Нарушение авторских прав?; Мы поможем в написании вашей работы!