
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Опыт 2. Зависимость скорости реакции от температуры
|
|
|
|
Опыт 1. Зависимость скорости химической от концентрации реагирующих веществ.
Приборы и реактивы:штатив с пробирками; 2 цилиндра на 20 мл; 0,1М раствор тиосульфата натрия, 0,1М раствор серной кислоты; 3 химических стаканчика на 100мл.
а) Сделайте предварительный качественный опыт. В пробирку с раствором тиосульфата натрия прилейте равный объем раствора серной кислоты. При взаимодействии тиосульфата натрия с серной кислотой выделяется сера, которая вызывает помутнение раствора и служит признаком реакции.
Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2 + S¯
Время от начала реакции (момент приливания одного реактива к другому) до выделения серы (помутнение) характеризует скорость данной реакции.
б) 1. Возьмите пипеткой в три пробирки по 15 мл 0,1М раствора тиосульфата натрия.
2. В три стаканчика цилиндром отмерьте: в первый – 15мл 0,1М раствора H2SO4; во второй – 10мл раствора H2SO4 и 5мл воды; в третий – 5мл раствора H2SO4 и 10мл воды (воду брать дистиллированную).
3. Заметив время, прилейте в первый стаканчик 5мл раствора тиосульфата натрия и быстро перемешайте полученную смесь. Отметьте время появления мути и запишите его в заранее подготовленную таблицу 1.
Таблица 1.
| № опыта | Объём, мл | Время начала помутнения раствора, сек. | |||
| H2SO4 | Н2О | Na2S2O3 | |||
| - | |||||
Проделайте то же самое с двумя оставшимися стаканчиками.
4. Сделайте выводы относительно зависимости скорости реакции от концентрации реагирующих веществ.
Приборы и реактивы: штатив с пробирками; 2 цилиндра на 20 мл; 0,1М раствора тиосульфата натрия; 0,1М раствор серной кислоты; 3 химических стаканчика на 100мл; термометр.
1. Отмерьте в три пробирки по 10мл 0,1М раствора тиосульфата натрия, а в три другие пробирки – по 10 мл 0,1М раствора серной кислоты.
2. Отметьте температуру воздуха в комнате. В первую пробирку с раствором Na2S2O3 прилейте раствор H2SO4. Отметьте по секундомеру промежуток времени от момента сливания раствора до появления мути.
3. Поместите одну пробирку с раствором Na2S2O3 и одну пробирку с раствором H2SO4 в водяную баню. Когда температура растворов будет превышать комнатную на 100С смешайте их и определите время начала помутнения растворов (температуру измеряйте термометром).
4. Повторите опыт, повысив температуру ещё на 100С.
5. Результаты запишите в таблицу 2.
Таблица 2.
| № опыта | Объём, мл | Температура опыта, 0С | Время начала помутнения раствора, сек. | |||
| H2SO4 | Na2S2O3 | |||||
Во сколько раз возрастает скорость реакций в данном опыте при повышении температуры на 100С?
6. По правилу Вант – Гоффа (при g=2) 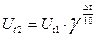 , получаем что при повышении температуры на 100С скорость реакции увеличивается в 2 раза, на 200С – в 4 раза, на 300С – в 6 раз и т. д.
, получаем что при повышении температуры на 100С скорость реакции увеличивается в 2 раза, на 200С – в 4 раза, на 300С – в 6 раз и т. д.
7. Рассчитайте значение температурного коэффициента g, исходя из опытных данных. Сравните их с теоретическими.
Сделайте вывод о зависимости скорости реакции от температуры.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 501; Нарушение авторских прав?; Мы поможем в написании вашей работы!