
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
VIII. 7. Производство магния и титана 2 страница
Бокситы содержат ряд окислов — окись алюминия, или глинозем (до 70%), окиси железа, кальция, титана, кремнезем и воду. В алюминиевой промышленности используются те бокситы, в которых содержание глинозема превышает 40 % •
Нефелины содержат окиси алюминия (до 30%), натрия, калия
и кремнезем. '
Алуниты представляют собой соединение основных сульфатов алюминия и калия.
Среди окислов, входящих в состав бокситов и нефелинов, глинозем является наиболее стойким, что делает невозможным прямое восстановление алюминия из руды (образуется сплав металлов и
кремния). Первоначально из бокситов выделяют глинозе.ж,„а.лослбД' ний затем подвергают электролизу. С технологической точки зрения эти два процеса резко отличаются друг от друга и могут быть территориально разобщены. Производство глинозема осуществляется в районах добычи сырья, так как расход его составляет 3,5—4 х на 1 т.,глинозема, а производство металлического алюминия размещается в центрах дешевой электроэнергии, в основном у крупных ГЭС.
Производство глинозема. Получение глинозема осуществляется несколькими способами —щелочными, кислотными др. В СССР используются только щелочные способы получения глипозема. Выбор способа получения глинозема зависит от состава сырья и особенно от количества в нем кремнезема.
При щелочном способе (здесь рассматривается так называемый мокрый щелочной способ производства глинозема — способ Байера) используются бокситы с •содержанием не более 2—4% кремнезема и 30% раствор едкого натра. Размолотый и цросушенный боксит смешивается с каустической содой, и образовавшаяся пульпа загружается в автоклав. Через нижнюю часть автоклава подается перегретый пар, с помощью которого в автоклаве поддерживается давление 1—35 атмосфер (в зависимости от качества боксита) и температура 105—240°. Пульпа в автоклаве перемешивается, а сам технологический процесс совершается в течение четырех часов.
Каустическая сода вступает в соединения с глиноземом бокситов и образует алюминат натрия. Другие окислы металлов, содержащиеся в бокситах, в реакцию со щелочью не вступают. Кремнезем же взаимодействует с каустической содой с образованием силиката натрия, вступающего в реакцию с частью алюмината натрия с образованием нерастворимого натриевого алюмосиликата, который выпадает в осадок и удаляется. В осадок выпадают также окиси железа и титана. Таким образом, с помощью щелочи большая часть алюминия переводится в растворимое соединение и отделяется от других соединений.
Недостатком этого способа получения глинозема является то, что щелочь расходуется и для связи кремнезема, а силикат натрия, соединяясь с алюминатом натрия, ведет к безвозвратным потерям снизанного алюминия. Потери щелочи и глинозема находятся в прямой зависимости от количества кремнезема в бокситах. Поэтому по щелочному способу перерабатываются бокситы с небольшим содержанием кремнезема.
Алюминат натрия фильтруется и загружается в специальные ча-1П.1, в которые подается вода. Под воздействием воды алюминат натрия охлаждается и. распадается с выделением гидрата окиси алюминия и слабого едкого натра:
NaAlO2 + 2Н2О = Al (OH)3 -f NaOH
Едкий натр после выпаривания воды и повышения его концентрации снова используется для получения алюмината натрия. Гидроокись же алюминия подвергается прокаливанию в трубчатых иращающихся печах или печах с «кипящим слоем». При этом гпдро-
 окись алюминия теряет воду и образуется окись алюминия, или глинозем.
окись алюминия теряет воду и образуется окись алюминия, или глинозем.
Бокситы с высоким содержанием кремнезема перерабатываются сухим щелочным способом, предложенным в 1916 г. русским ученым А. А. Яковкиным.
По этому способу измельченный боксит смешивается с кальцинированной содой и известняком. Образовавшаяся смесь подвергается прокаливанию во вращающихся печах. Кремнезем вступает в соединение с известняком, и образовавшийся шлам удаляется. Окислы металлов (алюминия и железа) и остатки кремнезема вступают в соединение с содой с образованием алюмината натрия и других соединений. Путем ряда операций отделяется алюминат натрия, который подвергается дальнейшей переработке по выше рассмотренному способу с получением глинозема.
С 1952 г. в нашей стране впервые в мире стали применяться нефелины в качестве сырья для алюминиевой промышленности. Переработка нефелинов начинается со спекания их с известняком. Из полученного продукта выщелачивается алюминат с помощью воды и осаждается в нерастворимое соединение углекислым газом, "который образуется при спекании нефелинов с известняком.
После отделепия соединений алюминия в растворе остаются растворы поташа и соды. Путем кристаллизации они также разделяются. Шлам же — сырье для цементной промышленности. Таким образом, при переработке нефелинов практически не образуется отходов: получают четыре ценных продукта — глинозем, соду, поташ и сырье для производства цемента. На 1 т глинозема выход других продуктов составляет: соды — до 1 т, поташа — около 1 т и цемента — до 10 т. Комплексное использование нефелинового сырья делает производство экономически эффективным, несмотря на низкое содержание глинозема (20—30%). Комплексной переработке также подвергаются алуниты, содержащие до 37% глинозема и 11—12% связанного калия. Отходы переработки алунитов, могут быть использованы для получения калийных удобрений.
Получение алюминия из глинозема. Глинозем является стойким окислом, имеющим температуру плавления 2050°. Поэтому получение алюминия осуществляется электролитическим путем, в электролизерах, выложенных внутри огнеупорным материалом. Для уменьшения тепловых потерь в электролизер загружают криолит, который растворяет глинозем и имеет в 2 раза меньшую температуру плавления (1000°). Кроме того, в криолит добавляют небольшой процент фторида кальция, что уменьшает температуру плавления криолита до 930—950°. При этой температуре и производится электролиз глинозема.
Анодом являются угольные пластины, а катодом — дно электролитической ванны, выложенное угольными блоками, куда вставляются катодные шины.
В электролит загружается глинозем в количестве 8—10% от веса электролита и постепенно добавляется по мере его расхода при электролизе. При пропускании постоянного тока через электролит
80 '
па дне ванны (катоде) оседает расплавленный алюминий, который удаляется один раз в сутки с помощью вакуум-ковша. Освобождающийся кислород выделяется на аноде и реагирует с угольной пластиной, образуя углекислый газ. Это ведет к большому расходу угольных пластин.
Электролиз глинозема — электроемкий процесс. Расход электроэнергии составляет 17—19 тыс. кВт • ч на 1 т алюминия, из которых примерно 30% идет для непосредственного выделения алюминия, а 70% Для поддержания электролита в жидком состоянии. Расход сырья составляет: глинозема — около 2 т, криолита — 0,1 т, угольных анодов — 0,6—0,65 т.
Полученный алюминий подвергается хлорированию с целью удаления неметаллических примесей — криолита, глинозема. Расход хлора составляет 1 кг на 1 т алюминия.
Производство алюминия в силу большой электроемкости размещается, как правило, у крупных ГЭС.
Магний относится к числу наиболее легких металлов (удельный вес —1,74). Он обладает такими свойствами, как пластичность и ковкость. Температура плавления магния (651°) близка к температуре плавления алюминия, а температура кипения почти в 2 раза ниже (1104°). В химическом отношении магний — довольно активный металл — па воздухе он окисляется, а при нагревании до 500— 600° энергично горит белым ослепительным пламенем.
В чистом виде магний применяется в пиротехнике, фотоделе, для получения магнийорганичееких соединений. Подавляющая часть магния применяется в виде сплавов.
Сплавы магния находят применение в авиационной промышленности, в тех отраслях машиностроения, где требуются легкие узлы и детали, в атомной технике. Важной областью применения магния является цветная металлургия, где с помощью магния восстанавливаются некоторые металлы, например титан. Поэтому не случайно производство титана и магния, как правило, концентрируется в одном месте.
Сырьем для получения магния являются магнезит, доломит, бнпгофит, карналлит. Получение магния и его руд осуществляется двумя способами — электролитическим и термическим. Наиболее распространен электролитический способ производства магния.
Электролитический способ получения основан на электролизе хлористого магния. Природный бишофит после обезвоживания подвергается электролизу. Углекислые соединения магния переводятся и хлориды магния, а карналлит разделяется на соединения магния и калия. Углекислые соединения магния прокаливают. При этом образуются окись магния и углекислый газ. Затем окись магния хлорируют в присутствии углерода. При этом образуются хлористый магний и угарный газ.
Электролиз хлористого магния производится в герметизировап-
ных электролизерах при полном разделении анодного и катодного отделений во избежание соприкосновения металлического магния и хлора. В качестве электролита служит расплавленный хлористый магний. В электролите постоянно поддерживается концентрация хлористого магния, равная 10—16% от веса электролита.
При пропускании постоянного тока в катодном пространстве выделяется жидкий металлический магний, а в анодном — газообразный хлор. Магний и хлор отсасываются и очищаются путем рафинирования. Из магния делают трапециевидные отливки, а хлор поступает для хлорирования окиси магния. На 1 т магния расходуется электроэнергии 14—15 тыс. кВт • ч, обезвоженного хлористого магния — 4,5 т, карналлита — 15 —16 т.
На размещение предприятий магниевой промышленности оказывает влияние ряд факторов, и прежде всего сырьевой и энергетический. Магниевые заводы тяготеют к районам сырья, хорошо обеспеченным дешевой электроэнергией. По термическому способу магний восстанавливается из окиси магния в ретортах под вакуумом. Для восстановления применяют ферросилиций и карбид кальция. Температура в ретортах поддерживается па уровне, превышающем температуру кипения магния. Восстанавливаемый магний в виде паров отводится в кристаллизатор и охлаждается.
Производство титана. Титан, будучи легким металлом (удельный вес — 4,5) и имея в то же время высокую температуру плавления (1668°), превышающую температуру плавления чугуна и стали, обладая антикоррозийностыо, получил широкое применение как важнейший конструкционный материал для создания авиационной, ракетной и атомной техники.
Для получения титана используются ильменит, или титановый железняк, и рутил, или двуокись титана.
Руды титана первоначально подвергаются обработке углеродом и одним из галогенов, чаще хлором. (Предварительно титановые руды обогащаются, плавятся для получения титанового шлака, который затем хлорируется.) Путем такой обработки получают четы-реххлористый титан. Последний вводится в реторту, куда до этого был помещен металлический магний, нагретый до 750—1000°С. Магний, как химически более активный элемент, вступает в соединение с хлором и освобождает титан. Хлористый магний отсасывается под вакуумом, а титан в виде губки извлекается из реторты. Титановая губка промывается подкисленной водой, просушивается и измельчается. Затем измельченный титан или прессуют, или сплавляют в тиглях.
Что касается хлористого магния, то он подвергается электролизу по вышерассмотренному способу с образованием" магния и хлора, которые повторно используются для восстановления титана из его руд. Комбинирование магниевого ц титанового производства дает определенные экономические выгоды. Предприятия титановой промышленности при размещении комбинируются с магниевыми заводами в центрах, хорошо обеспеченных дешевой электроэнергией.
ГЛАВА IX. ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ
IX. 1. Состав химической промышленности
Химическая промышленность является одной из ведущих отраслей народного хозяйства, значение которой все более возрастает.
Химические производства подразделяются па следующие специализированные отрасли:
А. X и м и ч е с к а я промышленность
1. Горно-химическая промышленность.
2. Основная химия.
3. Промышленность химических волокон.
4. Промышленность синтетических смол и пластических масс.
5. Промышленность пластмассовых изделий.
6. Лакокрасочная промышленность.
7. Промышленность синтетических красителей.
8. Промышленность химических реактивов и особо чистых г.е-
ществ.
9. Фотохимическая промышленность.
10. Промышленность бытовой химии.
11. Другие отрасли химической промышленности.
Б. Нефтехимическая промышленность
1. Производство синтетического каучука.
2. Производство продуктов основного органического синтеза.
3. Сажевая промышленность.
4. Резиноасбестовая промышленность.
Каждая из указанных подотраслей имеет свою сырьевую базу, технологию и специфику производства, а производимая продукция — свое экономическое назначение.
IX. 2. Производство серной кислоты
Серная кислота представляет собой тяжелую (удельный вес — 1,84) маслянистую жидкость, легко растворимую в воде.
I Трудно найти такую отрасль народного хозяйства, где бы она по! применялась. Крупнейшим потребителем серной кислоты является туковая промышленность — производство минеральных удобрений. На производство суперфосфата и сульфата аммония расходуется более 50% производимой серной кислоты. Серная кислота применяется в больших количествах для производства других кислот и солей, в очистке нефтепродуктов, в различных производствах органического синтеза, в гидролизной, пищевой и текстильной промышленности, в цветной металлургии, в машиностроении и других отраслях промышленности.
Сырьем для получения серной кислоты являются: природная сера, серный колчедан, или пирит, углекислый колчедан, отделяемый при обогащении углей, медный колчедан, отходящие газы в
|
| 01 Щ |
Цветной металлургии и сера, извлекаемая при очистке нефти и природного газа. Основное место в сырьевом балансе занимают отходящие газы цветной металлургии и серный колчедан. Содержание серы в колчедане составляет от 46 до 53%.
Если для получения серной кислоты используется сера или сероводород, то они предварительно сжигаются в специальных печах или котлах. Серный колчедан первоначально подвергается обжигу с целью получения сернистого газа. Обжиг колчедана производится в печах «кипящего слоя» или в многоиодовых печах. При обжиге серного колчедана образуются сернистый газ и окись железа. Сернистый газ подвергается очистке от огарковой пыли в электрофильтрах или в циклон-аппаратах. Очищенный сернистый газ поступает в сернокислотные цехи для получения серной кислоты.
Поскольку серная кислота представляет собой соединение серного ангидрида с водой, а сам этот процесс протекает довольно активно, то вся сложность в производстве серной кислоты сводится к получению серного ангидрида, т. е. доокислению сернистого газа. В обычных условиях этот процесс идет крайне медленно. В зависимости от способа окисления сернистого газа существуют два способа получения серной кислоты — башенный (нитрозный) и контактный.
Башенный способ получения серной кислоты применяется в нашей стране с 1805 г. В качестве окислителя применяются окислы азота, которые растворяются в серной кислоте.
В результате их взаимодействия образуется раствор, называемый нитрозой. Процесс окисления сернистого газа нитрозой производится в башнях, имеющих высоту 15—18 м и диаметр 4—10 м, футерованных изнутри кислотоупорным материалом (андезитом). В верхней части башни разбрызгиваются нитроза и вода. Поступающий сернистый газ в результате взаимодействия с нитрозой образует серный ангидрид, который здесь же соединяется с водой с образованием серной кислоты. Расход нитрозы составляет 1—2% от веса вырабатываемой серной кислоты.
Готовая серная кислота (обычно 75% концентрации) из первой башни поступает по змеевику в холодильник, поскольку имеет высокую температуру (до 250°). Охладившись, она поступает в сборник. Затем серная кислота может поставляться потребителю или подвергаться концентрации путем выпаривания из нее. воды. С помощью выпаривания воды ее концентрация доводится до 93—98%. Серная кислота, имеющая концентрацию до 93% —купоросное масло.
Контактный способ (является основным в производстве серной кислоты) основан на применении твердого окислителя, в качестве которого чаще выступает пятнокись ванадия.
Установки и аппаратура для получения серной кислоты этим способом отличаются от тех, что применяются при нитрозном способе (имеются дополнительные газоочистительные аппараты, помещенные в башнях, и др.). Дополнительная очистка газа в основном от окисей мышьяка и селена связана с тем, что вышеуказанные окислы «отравляют» катализатор, а это замедляет или даже прекращает ход реакции,
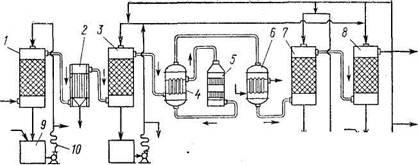
Рис. 10. Схема получения серной кислоты контактпым способом:
/ — промывная башня; 2 — мокрый электрофильтр; 3 — сушильная башня; 4 — теплообменник; 5 — контактный аппарат; 6 — холодильник; 7 — поглотительные башни; 8 — сборник; 9 — холодильник для кислот; 10 — змеевик
Очищенный сернистый газ в смеси с воздухом подается в контактный аппарат (рис. 10), где поддерживается температура около 450°. При таком температурном режиме пятиокись ванадия окисляет сернистый газ в серный ангидрид. Восстановившись, ванадий сразу же превращается в окись за счет кислорода, воздуха, снова отдает кислород и снова окисляется. Образующийся' серный ангидрид поглощается разбавленной серной кислотой (30%), разбрызгиваемой в специальной абсорбционной башне, и ее концентрация увеличивается до 98% и более.
Преимущество контактного способа получения серной кислоты
перед нитрозцым в том, что он дает.возможность получать высоко-
концентрированную серную кислоту, не требующую выпаривания
воды, тт более длительное время использовать аппаратуру. Недостат
ком же его является то, что он более дорогой, главным образом за
счет большего (в 2—2,5 раза) расхода электроэнергии на 1 т полу
чаемой кислоты. Использование природной серы в качестве сырья
но контактному способу значительно упрощает производство, уско
ряет технологический процесс и снижает себестоимость продукции
(табл.6)., ■
Таблица 6
| Расход сырья и материалов на 1т серной | кислоты | |
| Башенный способ | Контактный | |
| Сырье и энергия | (с учетом выпарки) | способ |
| Серный колчедан (45%), т | 0,8 | 0,85 |
| Окислы азота в пересчете | ||
| на 100%-ную азотную кисло- | ||
| ту, кг | 16—20 | —- |
| Вода, м3 | 35—45 | 50—55 |
| Электроэнергия, кВт ■ я | 50—60 | 60—100 |
| Жидкое топливо, кг | 50—55 | — |
| Пар, кг | 20—25 |
_ Расход серы — 0,3—0,35 т или серного колчедана — 0,7 т для производства 1 т серной кислоты, т. е. меньше выхода готовой продукции. Это обстоятельство и малая транспортабельность серной кислоты определяют целесообразность размещения ее производства в районах потребления. Серная• кислота производится на всех суперфосфатных заводах, а также в цехах других предприятий, которые потребляют ее в большом количестве. Сернокислотное производство, работающее на базе отходящих газов, образующихся при обжиге концентратов цветных металлов, комбинируется с предприятиями цветной металлургии. Потребители серной кислоты в этом случае создаются в местах ее производства.
IX. 3. Производство минеральных удобрений
Производство минеральных удобрений (туковая промышленность) является самой многотоинажной отраслью химии. Она в основном производит фосфорные, азотные и калийные удобрения. Их производство в 1975 г. составило 90,2 млн. т, а в 1979 г.— 94,5 млн. т (в пересчете на условные единицы).
Для %получения суперфосфата используется измельченный фосфорит или апатит, или их смеси и серная кислота 68—70%-пой концентрации. То и другое в определенной пропорции загружается в реакторы непрерывного действия. (Чаще всего это медленно вращающиеся барабаны.) В результате взаимодействия серной кислоты с фосфоритом и апатитом происходят следующие конечные реакции:
Са3 (РО4)2 + 2H2SO4 = Са (Н2РО4)2 + 2CaSO4 ЗСа3 (РО4) 2 + CaF2 + 7H2SO4 = ЗСа (Н2РО4)2 + 7CaSO4 + 2HF
На первом этапе реакции образуются фосфорная кислота и гипс, а часть фосфорита или апатита не реагирует с серной кислотой. На втором этапе образовавшаяся фосфорная кислота взаимодействует с фосфоритом или апатитом и переводит их в кислые фосфаты. Второй этап (вызревание суперфосфата) происходит в камерах хранения в течение нескольких (10—20) суток.
После вызревания суперфосфат содержит кислый фосфат кальция Са(НгРО4)2, гипс (CaSC^) и небольшую часть непрореагировавшего фосфорита или апатита. Последние два компонента (80% и более по весу) являются балластом, с чем и связано низкое содержание усваиваемой растениями части в простом суперфосфате. Расход серной кислоты при использовании апатитов составляет 0,36 т на тонну простого суперфосфата (в переводе па моногидрат) и 0,53 т — при использовании фосфоритов. Эти обстоятельства определяют и размещение производства простого суперфосфата в районах потребления, а суперфосфатные заводы имеют сернокислотные цехи.
Двойной суперфосфат содержит в 2 раза больше питательного вещества и поэтому более транспортабелен.
Для получения двойного суперфосфата на фосфорит или апатит воздействуют фосфорной кислотой, в результате образуется кислый фосфат кальция:
Са3 (РО4)2 + 4Н3РО4 + ЗН2О = 3 [Са (Н2РО4)2 ■ Н2О]
Фосфорная кислота получается путем воздействия на фосфатное сырье кислотами, главным образом серной:
Са3 (РО4)2 + 3H2SO4 + 6Н2О = 2Н3РО4 + 3 (CaSO4 • 2Н2О)
Можно вообще не применять серную кислоту, использовав орто-фосфорную кислоту, полученную нд базе фосфора. В этом случае фосфор получают возгонкой из его соединений, расходуя до 20 тыс. кВт • ч электроэнергии на производство тонны продукции. Этот путь получения двойного суперфосфата более дорогой.
1 Для того чтобы суперфосфат, как и некоторые другие виды удобрений, по слеживался, его гранулируют в комки во вращающихся барабанах с добавлением в суперфосфат небольшого количества воды. Гранулированный суперфосфат легче транспортировать, удобнее вносить в почву, а его потери при перевозках значительно сокращаются. Размещается производство суперфосфата в районах ^тотребления.
Азотная промышленность включает производство аммиака, азотной кислоты, азотных удобрений и некоторых других азотных соединений. Важное значение в азотной промышленности имеет производство аммиачной селитры, важнейшего удобрения сельскохозяйственных полей.
Рассмотрим получение синтетического аммиака. Азот для синтеза аммиака получают из воздуха, отделяя его от кислорода методом глубокого охлаждения и используя разность температур кипения азота- (—196°) и кислорода (—183°).
Второй компонент — водород получают сейчас в основном из метана. Для этой цели используют также попутный и коксовый газы.
Природный газ — метан смешивается с водяным паром, и при определенных условиях происходит реакция конверсии:
СН4 + 2Н2О=4Н2 + СО2
Расход природного газа в расчете на 1 т аммиачной селитры составляет 400 м3. Синтез аммиака из азота и водорода происходит it специальных колоннах при давлении от 100 до 1000 атмосфер и температуре 450 и более градусов при наличии катализаторов..Часть аммиака идет на получение азотной кислоты, которая исполь-Ьуется для получения аммиачной селитры путем воздействия на аммиак:
Производство азотных удобрений имеет несколько вариантов размещения: в угольных районах (Донбасс, Кузбасс, где ранее использовался для получения водорода и аммиака коксовый газ), в газовых районах (Узбекистан, Северный Кавказ, Поволжье, Украина) и па путях газовых магистралей (БССР, Прибалтика, Центр it др.), в центрах металлургической промышленности при использо-нашга аммиака, получаемого при коксовании угля, азота, извлекаемого из воздуха при производстве кислорода для доменного процесса.
Для производства калийных удобрений в качестве сырья используется ряд минералов, содержащих калий: сильвинит (KCl + NaCl), где содержится 30% хлористого натрия, карналлит (КС1- MgCl2- 6H2O) и др.
Основным сырьем калийной промышленности является сильвинит. Его добыча осуществляется открытым или шахтным способом в Белоруссии и Пермской области.
Добытый сильвинит размалывается и поступает на химическую фабрику для разделения входящих в него солей. Этот процесс основан на разности температур их растворения и кристаллизации. При нагревании раствора солей (маточного раствора) способность растворяться и образовывать перенасыщенный раствор у хлористого калия значительно выше, чем у хлористого натрия (табл. 7). ;
Таблица 7
Связь между температурой и растворимостью хлористого натрия и калия
| Соли на i л воды, г | ||
| Температура, "О | ||
| NaCl | КО | |
| . 390 |
Из таблицы видно, что при повышении температуры растворимость хлористого калия резко растет, а у хлористого натрия, наоборот, понижается. При охлаждении раствора хлористый калий кристаллизуется и выпадает в осадок.
После охлаждения маточного раствора с помощью центрифуг хлористый калий отделяется от него. Этот процесс повторяется многократно.
Подобным же образом происходит разделение карналлита с получением хлористого калия и хлористого магния. Последний используется для получения магния, а имеющиеся примеси в карналлите (бром, йод) также извлекаются. Хлористый калий имеет большую влажность и для ее удаления просушивается.
Работниками Березниковского 3-го калийного комбината разработан флотационный способ получения хлористого калия. Сущность его сводится к тому, что размолотый сильвинит обрабатывается флото-реагентом. Флотореагент выборочно воздействует на частицы хлористого калия и делает их не смачиваемыми водой. Во флотационных машинах при пропускании воздуха через пульпу частицы хлористого калия поднимаются на поверхности и таким образом отделяются от хлористого натрия, который имеет чистоту до 98% и может быть использован для получения хлора и соды.
|
|
Дата добавления: 2014-10-31; Просмотров: 793; Нарушение авторских прав?; Мы поможем в написании вашей работы!