
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электростатика 1 страница
|
|
|
|
I
| Толқындардың шағылуы және сынуы | Екі ортаның шекарасындатолқынныңаздаған бөлігі шағылып, бір бөлігі екінші ортаға өтеді(өту көрсеткіші ортаның кедергісіне байланысты) |
АО – түскен сәуле;
ОВ – шағылған сәуле;
ОС – сынған сәуле;
α – толқынның түсу бұрышы;
γ – сыну бұрышы;
β – шағылу бұрышы.

| Шағылу заңы 1) Түскен сәуле, шағылған сәуле, түсу нүктесіне түсірілген перпендикуляр бір жазықта жатады. 2) Түсу бұрышы шағылу бүрышына тең |
Сыну заңы
1) Түскен сәуле, сынған сәуле, түсу нүктесіне түсірілген перпендикулярбір жазықтық тажатады
2) Түсу бұрышының синусының, сыну бұрышының синусына қатынасы берілген екі орта үшін тұрақты және таралу жылдамдықтарының қатынасына тең.
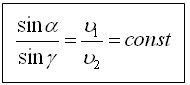
|
II. 
Когерентті толқындардың қосылу салдарынан кеңістіктің әртүрлі нүктелерінде толқындардың күшею және әлсіреу құбылысының уақыт өтуімен тұрақты көрінісінің пайда болуы.
Когерентті толқындар – жиілігі бірдей және фазалар айырымы тұрақты толқындар.
Интерференция кезінде толқынның күшею, әлсіреу шарттары:

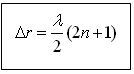
Δr – толқындардың жол айырымы.
III. 
| Толқындар жолында бөгетті кездестіргенде түзу сызықты таралу бағытынан ауытқиды (толқындардың бөгетті орап өтуі). Шарты: бөгеттің өлшемі толқын ұзындығымен шамалас болуы қажет. | 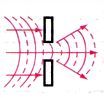
| 
|
IV. 
Көлденең толқындардың белгілі бір бағытының бөлініп алынуы (поляризатордың көмегімен).
Молекулалық физика (анықтама)
Молекулалық физика - дененің ішкі құрылысын және заттың ішінде өтетін жылулық процесстерді зерттейтін физиканың бөлімі.

Молекула-кинетикалық теория негіздері
ХІХ ғасырдың екінші жартысы мен ХХ ғасырдың басында экспериментік негіздеудің нәтижесінде молекулалардың өзара әрекеттесуін және қозғалыстарын сипаттайтын келісті теория молекула-кинетикалық теория жасалды.
Молекула-кинетикалық теорияның негізгі қағидалары
Заттардың құрылысы туралы молекула-кинетикалық теорияның негізгі қағидалары:
1.
| Барлық дене (зат) белгілі бір арақашықтықта орналасқан бөлшектерден тұрады (молекула, атом, иондар). |
| Тәжірибелік дәлелдеу (негіздеу) - заттың ұсақталуы, - заттардың араласуы (диффузия), - сұйықтың булануы, - тунелді микроскоптың суретке түсіруі. |
2.
| Заттың құрамындағы атомдар мен молекулалар үздіксіз хаосты қозғалыста болады. |
3.
| Бөлшектер арасында молекулалық өзара әсерлер болады (тартылу, тебілу). |
| Тәжірибелік негіздеме: - Қатты дене пішінінің сақталуы. - Бөлшектер белгілі арақашықтықта болуы. - Денелердің серпімділігі. - Денелердің өңделген беттерінің жабысуы. |
Молекулалардың негізгі сипаттамалары
Молекулалардың негізгі сипаттамаларының бірі – олардың өлшемі мен массасы. Молекулалардың өлшемі соншалықты кіші болғандықтан, олардың саны кез келген денеде өте көп болады.
| Молекула (грек. – кішкентай масса) | Химиялық қасиеті бар заттың кішкентай орнықты бөлшегі. Молекула атомдардан құралады |
| Атом | Химиялық элементтің ең кіші бөлшегі, оның қасиеттерін тасымалдаушы |
| Авогадро саны NA (1/моль) | 12 г көміртегіндегі (12С) атомдар саны (заттың 1 моліндегі бөлшектер саны) | NA ≈6,02∙1023 
|
| Зат мөлшері ν [моль] | 1 моль – 12 г көміртегінде қанша атом болса, сонша атомы бар заттың мөлшері | |
| N – бөлшек саны (молекула, атом) |
| Молярлық масса μ [кг/моль] | 1 мольдегі заттың массасы | 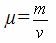
|
| µ=Mr ·10-3, кг/моль Mr – заттың салыстырмалы молекулалық (атомдық) массасы (Менделеев кестесінде) | = ·NA – бір бөлшектің массасы (атом, молекула) |
| Бөлшектің массасы (атом, молекула) [кг] | 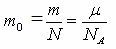
| 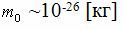
|
| Концентрация (шоғыр) п [1/м3] | 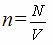
|
| (бірлік көлемдегі бөлшектердің саны) |
| Бөлшектер саны N | 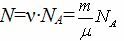
|
| Атомдар өлшемі | 
|
Молекула-кинетикалық теорияның негізгі теңдеуі
Молекулалардың хаосты қозғалысының нәтижесі:
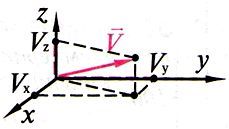
1. Барлық молекулалар әртүрлі жылдамдықтармен қозғалатын болғандықтан орташа квадраттық жылдамдық  ұғымын ендіреміз
ұғымын ендіреміз
2. Барлық бағыттары бірдей 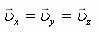
3. Бүкіл көлемде молекулалар бірдей таралады
4. Квадраттық жылдамдықтың орташа мәні
| 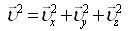
| 
|
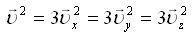
|
МКТ-ның негізгі теңдеуі
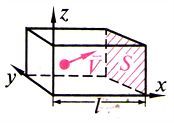
| газ қысымы –молекулалардың бірлік ауданға соғылу күштерінің қосындысы. (N ‒ соғылысқан молекулалар саны; F1 ‒ бір молекуланың соғылу күші). |

Молекулалардың жылулық қозғалысының энергиясы
1) Макроскопиялық параметрлер молекулалардың үйкелісін ескермеген жағдайда, дененің (газ) күйін сипаттайтын параметрлер: қысым Р [Па], көлем V [м3], температура Т [К].
Жылуалмасу бір денеден (қыздырылған) екінші денеге (суық) жылудың (энергияның) берілуі.
Жылулық тепе-теңдік барлық денелердің температурасы бірдей макроскопиялық параметрлері тұрақты денелер жүйесінің күйі.
2) Температура - температурасы 0-ге баланған (қызу ережесі) басқа денемен салыстырғандағы жылулық тепе-теңдігінің ауытқуын білдіретін физикалық шама tº [С], Т [К].

3) Жылулық тепе-теңдіктегі газдар үшін тәжірибелік факты: әр түрлі газдармен, мысалы, сутегімен, гелиймен және оттегімен толтырылған көлемдері бірдей ыдыстарды жылулық тепе-теңдік орнағанша және газдар қысымының өзгеруі тоқталғанша еріп жатқан мұзға салып қою керек. Газдардың массалары белгілі болғандықтан, әр ыдыстағы молекулалар саны белгілі. Сонымен газ қысымы мен көлемі көбейтіндісінің молекулалар санынан қатынасы тек температураға байланысты. Белгілі бір температурада бұл қатынас барлық газдар үшін бірдей және сиретілген газдар үшін орындалады.
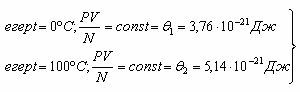
| 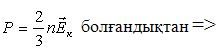
| 
|
n=N/V- молекулалардың шоғыры
Энергетикалық бірліктермен өрнектелетін θ температураның орнына өзімізге үйреншікті градустармен өлшенетін Т температураға тура пропорционал деп есептейміз θ=kΤ. Мұндағы k-пропорционалдық коэффициент, Т-абсолют температура деп аталады.
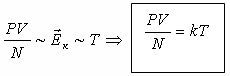
| Больцман тұрақтысы

|
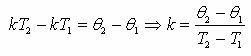
|
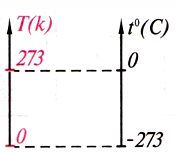
4) Абсолюттік температура Кельвин шкаласы бойынша өлшенген температура (температураның физикалық мағынасын көрсетеді) Т [К].
Абсолюттік ноль молекулалар қозғалысы тоқталатын температура (қозғалыссыз материя болуы мүмкін емес) Т=0 [К].
| Кельвин шкаласы
| 
|

| 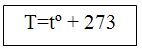
| |
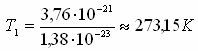
|
   
|
 температура орташа кинетикалық энергияның өлшеуіші
температура орташа кинетикалық энергияның өлшеуіші 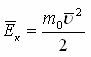 газ молекуласының орташа кинетикалық энергиясы. 1920 жылы О. Штерн газ молекулаларының жылдамдығын тәжірибе жүзінде анықтаған. Жоғарыдағы екі теңдікті пайдаланып
газ молекуласының орташа кинетикалық энергиясы. 1920 жылы О. Штерн газ молекулаларының жылдамдығын тәжірибе жүзінде анықтаған. Жоғарыдағы екі теңдікті пайдаланып 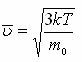 немесе
немесе 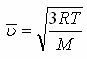 өрнектерін алуға болады. Мұндағы m0- молекуланың массасы,
өрнектерін алуға болады. Мұндағы m0- молекуланың массасы, 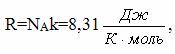 M-молярлық масса.
M-молярлық масса.
Идеал газ күйінің теңдеуі. Газ заңдары.
Идеал газ - молекулалар арасындағы өзара әсерлесу ескерілмейтін реал газдың физикалық моделі.
Идеал газдардың негізгі қасиеттері:
а) Молекулалар – материалды нүктелер (абсолют серпімді шарлар)
ә) Молекулалар қозғалысы Ньютон заңдарына бағынады
б) Молекулалар арасында өзара әсер жоқ (Ер=0; Ек≠0)
в) Молекулалар хаосты қозғалыста
г) Қарастырылып отырған ең аз көлемде бөлшектер (молекулалар) саны көп мөлшерде болады. Авогадро санымен салыстырылады
Идеал газдың жайын МКТ тұрғысынан үш макроскопиялық шамалардың (P,V,T) арасындағы байланысты қарастыратын теңдеу - идеал газ күйінің теңдеуі деп аталады.
Бұл теңдеуді орыс ғалымы Д.И. Менделеев қорытып шығарды.
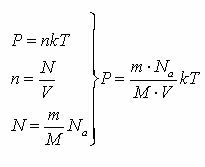
| 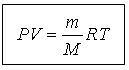 - -
| идеал газ күйінің теңдеуі |
| Идеал газ күйінің теңдеуі (Менделеев-Клапейрон) газ күйін сипаттайтын негізгі шамалар қысым (Р), көлем (V) және температура (Т) арасындағы байланысты тағайындайды. |
| Универсал газ тұрақтысы | 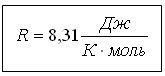
| 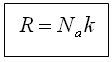
|
Газ күйінің өзгеруі
| Р1, V1, Т1 – бастапқы қалыпта Р2, V2, Т2 – соңғы қалыпта | 
| - Менделеев-Клапейрон теңдеуі |

Суреттегі аспаптың көмегімен идеал газ күйінінің теңдеуін және газ заңдарын тәжірибе жүзінде тексеруге болады. Сығылған және сиретілген газдарды пайдалану механикаландырылынған саймандарды пайдаланбайтын қол жұмыстармен салыстырғанда, сығылған ауа негізінде жұмыс атқаратын пневматикалық құралдар (балғалар, қазық қаққыштар, бұрғылайтын және тегістейтін машиналар) еңбек өнімділігін алты еседен артық асыруға жәрдемдеседі.
Изопроцестер – макроскопиялық параметрлердің біреуі тұрақты болғанда қалған екеуінің арасындағы өтетін процесстер. Газдың бір параметрінің мәні тағайындалып, қалған екі мәні арасындағы байланысты сипаттайтын заңдарды газ заңдары деп атаймыз.
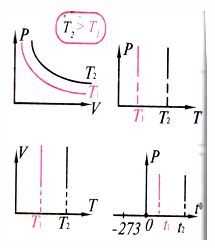
| Изотермиялық процесс | 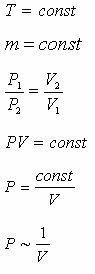
| 1667 ж. Бойль (ағылшын) Мариотт (француз) Бойль-Мариотт заңы Берілген газдың, берілген мас- сасы үшін тұрақты темпера- турадағы қысым мен көлемнің көбейтіндісі тұрақты шам | Изотермалар
|
| Изобаралық процесс | 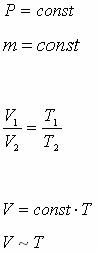
| 1802 ж. Гей-Люссак (француз)
Гей-Люссак заңы
Газдың берілген массасының тұрақты қысымда көлемі температураға тура пропорционал (түзу сызықты байланыста)
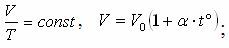 α– көлемдік ұлғаюдың температуралық коэффициенті.
Барлық газдар үшін
α– көлемдік ұлғаюдың температуралық коэффициенті.
Барлық газдар үшін 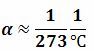
| Изобаралар
|
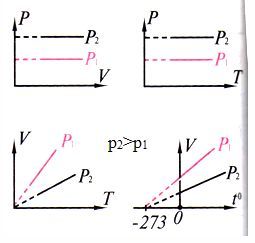
| Изохоралы процесс | 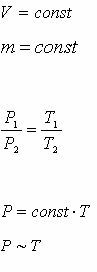
| 1787 ж. Шарль (француз) Шарль заңы Газдың берілген массасы үшін тұрақты көлемде қысымның температураға қатынасы тұрақты шама | 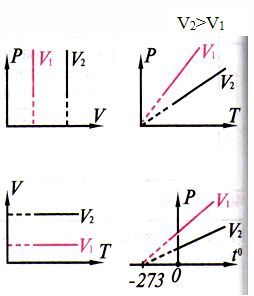
|
Сұйықтар мен газдардың өзара айналуы
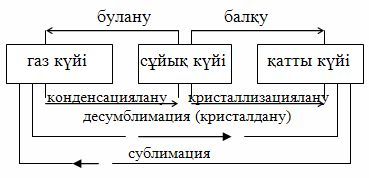
МКТ заттың неліктен газ тәрізді, сұйық және қатты күйлерде бола алатындығын түсіндіріп қана қоймай, сонымен бірге заттың бір күйден екінші күйге көшу процессін түсіндіру мүмкіндігін береді. Сұйық молекулалары ретсіз қозғалады. Сұйықтың температурасы неғұрлым жоғары болса, кинетикалық знергиясы соғұрлым артады. Бір мезетте кейбір молекулалардың кинетикалық энергиясының көп болатыны сонша, олар басқа молекулалардың тартылыс күшін жеңіп сұйықтан ұшып шығу мүмкіндігіне ие болады, яғни буланады. Ретсіз қозғала отырып молекулалар ашық ыдыстағы сұйық бетінен бір жола кетіп қалуы мүмкін немесе сұйыққа қайта оралуы да мүмкін. Мұндай процесс конденсация деп аталады.
Булану - заттың сұйық күйден газ тәрізді күйіне айналуы (жұтылған энергия молекулалар арасындағы байланысты үзуге жұмсалады).

| Кебу кезкелген температурада сұйықтың еркін бетінде болатын булану | 
| Қайнау белгілі tº (қайнау температурасы) темпера-турада сұйықтың барлық көлемінде өтетін булану |
| Кебу кезінде сұйық температурасы төмендейді | Қайнау кезінде температура өзгермейді. Қайнау температурасы: 1. сұйықтың тегіне 2. атмосфералық қысымға тәуелді РА↓=>tº↓ |
Өз сұйығымен динамикалық тепе-теңдікте болатын бу (уақыт бірлігінде сұйықтан ұшып шығатын молекулалар саны, қайта оралатын молекулалар санына тең) қаныққан бу деп аталады.
-Қаныққан будың концентрациясы көлеміне тәуелді емес (tº ‒ const).
-Қаныққан бу қысымы (Рқ) тек температураға тәуелді.

| 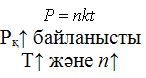
| 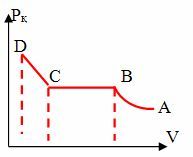
| АВ ‒ қанықпаған будың сығылуы ВС ‒ V↓Рқ‒const (будың қаныққан буға айналуы) CD‒сұйықтың сығылуы |
Егер температура өзгермеген жағдайда кәдімгідей қысу арқылы газды сұйыққа айналдырсақ оны қаныққан бу дейді.
Қайнау кезінде сұйықтың барлық көлемі бойынша тез ұлғаятын бу көпіршіктері пайда болады, олар сұйық бетіне қалқып шығады. Көпіршіктердегі қаныққан будың қысымы сұйық бетіндегі қысыммен теңелген кезде қайнау басталады. Бұл температура қайнау температурасы деп аталады. Сұйықтың қайнау температурасы тұрақты болады.
Сыртқы қысым неғұрлым жоғары болса, қайнау температурасы соғұрлым жоғары болады. Керсінше, қысымды азайту арқылы қайнау температурасын төмендете аламыз.
Кризистік температура Тк (К) - сұйық пен қаныққан бу арасындағы физикалық қасиеттерінің айырмашылығы жойылатын температура.
| Тк-температурада ρбу‒ максимал ρсұйық‒ минимал | 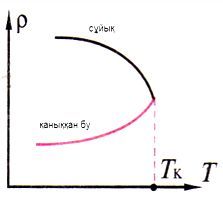
|
Т < Тк ‒ қанықпаған
Т > Тк ‒ ешқандай қысымда газ сұйыққа айналмайды
Кризистік температурадан жоғары температурада қандай қысымда болмасын газды сұйыққа айналдыру мүмкін емес. Кризистік температураның ерекше маңыздылығы осында.
Атмосфера түрлі газдардың және су буының қоспасы болып табылады. Егер басқа газдардың барлығы жоқ десек, онда су буының түсіретін қысымы парциал қысым деп аталады. Абсолют ылғалдылық - берілген температурадағы су буының парциал қысымы (су буының ауадағы тығыздығы)
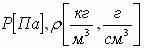
Паскаль заңы. Сұйық пен газ бөлшектерінің еркін қозғалғыштығы – сұйық пен газға түсірілген қысымның, олардың әрбір нүктесіне таралуы арқылы түсіндіріледі. Сұйыққа немесе газға түсірілген қысым сол сұйықтың немесе газдың әрбір нүктесіне өзгеріссіз беріледі. Бұл қағида Паскаль заңы деп аталады. Сұйықтың ыдыстың түбіне түсіретін қысымы сұйық бағанның биіктігіне және тығыздығына тура пропорционал:  мұндағы ρ – сұйықтың тығыздығы, h – биіктігі.
мұндағы ρ – сұйықтың тығыздығы, h – биіктігі.
Бізді қоршап тұрған ауа қабығы атмосфера (гректің «атмос» - бу, ауа және сфера – шар деген екі сөзінен құралған). Жер бетіндегі әрбір дене сияқты ауаға да ауырлық күші әсер етеді, ауаның салмағы бар. 1 м3ауаның салмағы 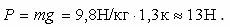
Атмосфералық қысымды ХVІІ ғасырда Итальян ғалымы Галилейдің шәкірті Торричелли өлшеді. Атмосфералық қысым биіктігі 760 мм-ге жуық сынап бағанының қысымына тең. Сондықтан атмосфералық қысым бірлігі ретінде 1 мм сынап бағаны (1 мм сын. бағ.) алынады. Яғни формуласынан 1 мм сын. бағ.=133,3 Па. Атмосфералық қысымды барометрмен өлшейді. Қалыпты атмосфералық қысым 101 000 Па≈105 Па, бұл биіктігі 760 мм сынап бағанының қысымына тең, 0º температурадағы атмосфералық қысым.
Гидравликалық пресс. Атмосфералық қысымнан артық немесе кем қысымдарды өлшеу үшін – манометрлер (гректің «манос» - сирек, тығыз емес, «метрео» - өлшейтін деген сөзінен шыққан) дейтін аспаптар пайдаланылады. Паскаль заңына сүйеніп гидравликалық машиналар деп аталатын құрылғылар жұмыс істейді. Олардың жұмыс істеу принципі сұйықтардың қозғалыс және тепе-теңдік заңдарына негізделген. Бұл машиналардың негізгі бөлігі – түтікпен өзара жалғастырылған, диаметрлері әртүрлі екі цилиндр. Поршендар астындағы кеңістік пен түтікке толтыра сұйық құйылады. Паскаль заңы бойынша тыныштықтағы сұйықтың барлық нүктелеріндегі қысым бірдей, яғни 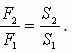 Демек, үлкен поршенның ауданы кіші поршеннің ауданынан неше есе үлкен болса, екінші поршенге әсер ететін қысым күші бірінші поршенге әсер ететін қысым күштен сонша есе артық.
Демек, үлкен поршенның ауданы кіші поршеннің ауданынан неше есе үлкен болса, екінші поршенге әсер ететін қысым күші бірінші поршенге әсер ететін қысым күштен сонша есе артық.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 5114; Нарушение авторских прав?; Мы поможем в написании вашей работы!