
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Опыт 7. Получение и свойства гидроксида никеля (II)
|
|
|
|
К осадку гидроксида кобальта (III), полученному в опыте 9, прибавить несколько капель концентрированного раствора соляной кислоты. Над отверстием пробирки подержать фильтровальную бумагу, смоченную раствором йодида калия.
Опыт 6. Свойства гидроксида кобальта (III) (показательный)
Опыт 5. Получение и свойства гидроксида кобальта (II)
В пробирку с 3 каплями раствора соли железа (III) добавить 1-2 капли раствора иодида калия (KI).
Опыт 4. Окислительные свойства железа (III)
- Отметить, какие изменения происходят в пробирке …….
- Составить уравнение реакции, учитывая, что одним из продуктов реакции является I2.
FeCl3 + KI → …
- как изменилась степень окисления железа ………………, йода…………………
- Указать окислитель…………., восстановитель…………………..;
- Рассчитать ЭДС реакции: ЭДС = φок. – φвос. =
- возможно ли самопроизвольное протекание реакции при стандартных условиях…
- Ион Fe3+ проявляет …………………… свойства
- Вывод
В три пробирки поместить по 2 - 3 капли раствора соли кобальта (II) и добавлять по каплям раствор гидроксида натрия; сначала появляется синий осадок основной соли, который затем становится розовым, что указывает на образование гидроксида кобальта (II). К осадку в первой пробирке добавить несколько капель 2 н раствора соляной кислоты, осадок во второй пробирке тщательно размешать стеклянной палочкой, а в третью - прибавить 2-3 капли 3%-ного раствора пероксида водорода (сохранить для опыта 10).
– охарактеризовать внешний вид осадка……..
- составить уравнения реакции образования гидроксида кобальта(II) в молекулярной и ионной форме
CoSO4 + NaOH → …
- отметить, с каким раствором - соляной кислоты или гидроксида натрия - взаимодействует гидроксид кобальта(II)………….
- составить уравнение реакции гидроксида кобальта(II) с соляной кислотой в молекулярной и ионной форме
Co(OH)2 + HCl → …
- отметить, как изменяется внешний вид осадка Co(OH)2 во второй пробирке при хранении на воздухе ……………
- составить уравнение реакции медленного окисления гидроксида кобальта(II) на воздухе
Co(OH)2 + O2 + … → …
- Быстрое окисление гидроксида кобальта (II) наблюдается в пробирке с …………
- Составить уравнение реакции окисления гидроксида кобальта(II) перекисью водорода до гидроксида кобальта(III).
Co(OH)2 + Н2О2 ®
- Указать окислитель…………., восстановитель…………………..;
- Рассчитать ЭДС реакции: ЭДС = φок. – φвос. =
- Сравнить полученные результаты с результатом опыта по окислению гидроксида железа (II)
-Указать какой ион - Co2+ или Fe2+ - является более сильным восстановителем …….
- сделать вывод о свойствах гидроксида кобальта (II)
- Отметить, какие изменения происходят в пробирке ………………
………………………………….на фильтровальной бумаге………………
- Составить уравнение реакции, учитывая, что одним из продуктов реакции является Cl2.
Co(OH)3 + HCl → …
- как изменилась степень окисления хлора ………………, кобальта…………………
- Указать окислитель…………., восстановитель…………………..;
- Рассчитать ЭДС реакции: ЭДС = φок. – φвос. =
- возможно ли самопроизвольное протекание реакции при стандартных условиях…
- Co(OH)3 проявляет …………………… свойства
- Вывод
В четыре пробирки поместить по 2-3 капли раствора соли никеля(II) и добавить по каплям раствор гидроксида натрия до выпадения осадка гидроксида никеля(II). В первую пробирку внести несколько капель 2 н раствора соляной кислоты, во второй пробирке осадок тщательно размешать стеклянной палочкой, в третью - добавить 2-3 капли 3% - ного раствора пероксида водорода. В четвертую пробирку прибавить одну каплю бромной воды (сохранить для опыта 12).
– охарактеризовать внешний вид осадка……..
- составить уравнения реакции образования гидроксида никеля(II) в молекулярной и ионной форме
NiSO4 + NaOH → …
- отметить, с каким раствором - соляной кислоты или гидроксида натрия - взаимодействует гидроксид никеля (II)………….
- составить уравнение реакции гидроксида никеля (II) с соляной кислотой в молекулярной и ионной форме
Ni(OH)2 + HCl → …
- отметить, изменяется ли внешний вид осадка Ni(OH)2 во второй пробирке при хранении на воздухе ……………
- отметить, изменяется ли внешний вид осадка Ni(OH)2 во второй пробирке с перекисью водорода ……………
- быстрое окисление гидроксида никеля (II) наблюдается в пробирке ……………..
- Написать уравнение реакции окисления гидроксида никеля (II) бромной водой до гидроксида никеля (III).
Ni(OH)2 + Br2 ®
- Указать окислитель…………., восстановитель…………………..;
- Сравнить полученные результаты с результатами опытов по окислению гидроксида железа (II) и гидроксида кобальта (II)
- Сравнить значения стандартных окислительно-восстановительных потенциалов
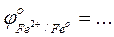
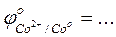
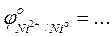
-Указать какой ион - Ni2+, Co2+, или Fe2+ - является более сильным восстановителем …….
-Указать, какой ион - Ni3+, Co3+, или Fe3+ - является более сильным окислителем …….
- сделать вывод о свойствах гидроксида никеля (II)
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 3297; Нарушение авторских прав?; Мы поможем в написании вашей работы!