
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Природные спирты
|
|
|
|
Как правило, это терпены и их производные.
Ментол. Главный вторичный метаболит растений семейства яснотковые, получают синтетически или выделяют из мятного эфирного масла (до 80%). Прозрачное кристаллическое вещество, легко плавится. Существует 8 пространственных изомеров (четыре диастереомера) с довольно близкими свойствами. Основной природный изомер (-)-ментол имеет (1R,2S,5R)-конфигурацию. Обладает слабым местноанестизирующим свойством, стимулирует холодовые рецепторы кожи и слизистых, слабый антисептик. Имеет наиболее выраженный мятный вкус и запах. Широко используется в медицине и пищевкусовой промышленности.
На рисунке т.н. “минус”-изомеры:
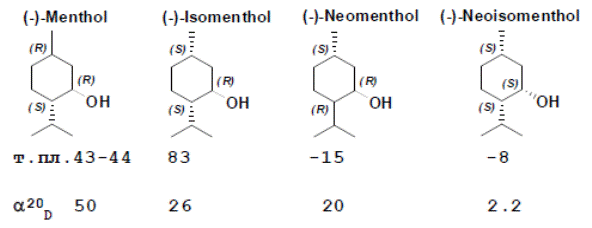
В соединениях природного происхождения изопропильная группа транс-ориентирована по отношению к метильной и спиртовой группе. В самом ментоле все 3 объемные группы находятся в конформации “кресло” в наиболее удаленных друг от друга экваториальных положениях, что делает (-)-ментол наиболее стабильным изомером из 4 возможных. Существуют 2 кристаллические формы рацемического ментола с т.пл. 28 °C и 38 °C. Чистый (-)-ментол имеет 4 кристаллические формы, наиболее стабильна α-форма.
Борнеол. М 154.25, бесцветные кристаллы с камфорно-хвойным запахом. Известны 2 изомера: собственно борнеол и изоборнеол, имеющие соответственно эндо- и экзо-конфигурацию гидроксильной группы. Легко сублимируются (ниже т-ры плавления), не растворим в воде, хорошо - в эфире, петролейном эфире, этаноле, бензоле.
Борнеолы и их сложные эфиры широко распространены в природе (входят в состав многих эфирных масел). (+)-Борнеол содержится, в выделениях и эфирном масле тропического дерева дриобаланопс (Dryobalanops aromatica), или борнейского лавpa, произрастающего на островах Борнео и Суматра. (-)-Борнеол, или “нгай-камфора”, - главный компонент эфирного масла растения Blumea balsamifera. Рацемат борнеола обнаружен во многих эфирных маслах, тогда как изо -борнеол встречается редко (лишь в эфирном масле растения Juniperus exelsa).
Борнеол получают гидратацией пиненов (нагреванием с Н3ВО3, фталевой или тетрагидрофталевой к-той) и омылением образующихся борниловых эфиров. изо-Борнеол получают действием на камфен АсОН или НСООН в присутствии кислотного катализатора и омылением образующегося эфира. Омылением эфирного масла сибирской пихты Abies sibirica, содержащего 30-40% (-)-борнилацетата, получают (-)-борнеол, восстановлением камфоры - смесь изомеров (при действии Na в спирте преобладает борнеол, при каталитическом гидрировании - изо-борнеол). Для разделения смеси используют большую скорость омыления кислых фталатов борнеола или большую легкость превращения изо-борнеола в метиловый эфир в присутствии МеОН и H2SO4. Очищают борнеол возгонкой.
Борнеол, выделяемый из эфирных масел, синтетический изо-борнеол, а также их эфиры (изоборнилацетат) - душистые вещества в парфюмерии, в производстве туалетного мыла, пищевых эссенций.

В древней Персии, Индии и Китае борнеол долгое время считался панацеей от многих заболеваний. Он использовался как средство от чумы и при других инфекциях, а также при заболеваниях желудка и кишечника. В Китае борнеол употребляли для бальзамирования. В тринадцатом веке о нем писал Марко Поло, называя “бальзамом от всех болезней”. На Востоке его использовали при различных церемониях, а в Китае - в похоронном ритуале. Запах борнеола отпугивает насекомых, и потому древесина борнейского лавра используется при постройке зданий.
Камфора. Белые кристаллические куски, бесцветный кристаллический порошок, или спрессованные плитки с кристаллическим строением, легко режущиеся ножом и слипающиеся в комки. Обладает сильным характерным запахом и пряным, горьким, затем охлаждающим вкусом. Правовращающую камфору добывают из камфорного дерева Cinnamomum camphora (L.) Nees et Eberm., которое произрастает в субтропических поясах Китая и Японии. Имеется и другой вид камфоры – “борнейская камфора” (левовращающий изомер), которая содержится в выделениях дерева Dryobalanops camphora, произрастающего на островах Борнео и Суматра. Камфору также получают из розмарина, лаванды и базилика камфорного (Ocinum canum Sims.). Еще одним источником левой камфоры является пихта сибирская.
С медицинской целью применяют правовращающую натуральную камфору, либо синтетическую левовращающую, получаемую из пихтового масла, либо камфору рацемическую. Камфора является одним из основных представителей аналептических средств. При введении под кожу растворы камфоры в масле тонизируют дыхательный центр, стимулируют сосудодвигательный центр. Камфора оказывает также непосредственное действие на сердечную мышцу, усиливая обменные процессы в ней и повышая ее чувствительность к влиянию симпатических нервов. Под влиянием камфоры суживаются периферические кровеносные сосуды. Выделяясь из организма через дыхательные пути, камфора способствует отделению мокроты.
Название смолы камфорного дерева “kafur” – арабского происхождения и попало в европейские языки примерно в XIV веке, где оно преобразовалось в camphor.
Ещё один метод расщепления рацематов, входящих в рассматриваемую группу - кинетическое расщепление. Метод основан на том, что в реакциях с оптически активными реагентами (или в присутствии хиральных катализаторов или хиральных растворителей) скорость превращения одного энантиомера не равна скорости превращения другого. Если в подобную реакцию ввести рацемат и прервать ее полного завершения, то один из энантиомеров, реагируя быстрее, будет преобладать в продукте реакции, другой - в непрореагировавшем остатке. Пример - расщепление рацемического (пара-толил) мезитилсульфоксида восстановлением под действием реагента, полученного из оптически активного 1-фенилэтиламина и А1Н3.
Закончим главу ещё один интересным приёмом, широко применяемым при разделении рацематов. Известно, что α-фенэтиламин и α-фенилэтанол являются жидкостями и даже при затвердевании не образуют конгломераты. Зато рацемические сульфат и циннамат амина и 3,5-динитробензоат спирта – хорошо кристаллизуются в виде конгломератов.
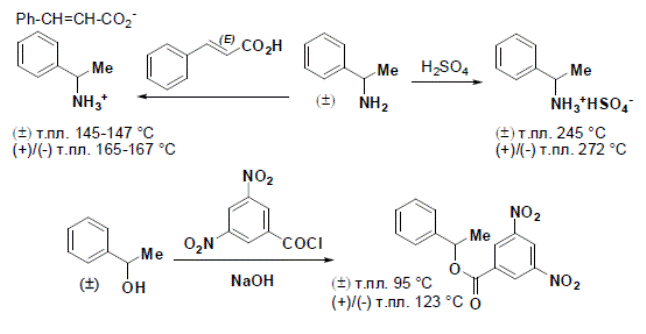
Таким образом, если имеется образец энантиомерно обогащённых спирта или амина, то после превращения их производные, мажорный изомер может быть легко отделён от рацемической смеси единственной перекристаллизацией.
Рацемизация. Рацематы образуются также в результате рацемизации оптически активных соед., представляющей собой обратимое взаимное превращение энантиомеров. В отсутствие асимметризующих факторов этот процесс заканчивается установлением динамич. равновесия между ними при строго эквимолярном содержании энантиомеров в смеси.
При рацемизации происходит обмен местами к.-л. двух атомов или радикалов, связанных с элементом хиральности. Рацемизация - часто не самопроизвольный процесс; она вызывается, например, действием кислот, щелочей, повышением температуры.
Скорость и механизм рацемизации зависят от строения оптически активных соед. и от условий ее проведения (т-ры, р-рителя, катализатора и т.д.). Кинетически рацемизация обычно описывается ур-нием для необратимой р-ции первого порядка:
k= (2,3/t)lgα0/αt,
где k-константа скорости рацемизации, α0 и αt-величины соотв. первонач. оптич. вращения и ко времени t. В зависимости от природы элементов хиральности молекулы энан-тиомера рацемизация м. б. либо химической, либо физической.
Хим. рацемизация наиб. характерна для соед., в молекулах к-рых хиральным центром является асим. атом углерода. Отрыв от него одного из заместителей приводит к образованию плоского карбкатиона и потере хиральности. Послед. присоединение этого же заместителя происходит равновероятно с обеих сторон плоскости карбкатиона, что приводит к образованию Р. По др. механизму рацемизация протекает с промежут. образованием карбаниона, напр. в результате отрыва протона от асим. атома С. При термич. рацемизации в результате гомолитич. разрыва связи асим. атома с одним из заместителей образуются радикалы, к-рые при рекомбинации дают Р.
Легкость протекания рацемизации зависит от типа функц. групп, связанных с асим. атомом С. Легко рацемизуются соед., содержащие в качестве заместителей при асим. центре атом водорода и сильный акцептор электронов, напр, молочная к-та СН3—СНОН—СООН, дикетоны R—СО— —CHR'—COR: и т.д. У дикетонов хиралъность исчезает в результате енолизации. В то же время соед., не склонные к образованию промежут. ионов или таутомерным превращениям, напр. алканы, устойчивы к рацемизации. Существуют соед., к-рые хотя и образуют промежут. ионы, не подвергаются рацемизации, вследствие стерич. особенностей структуры их молекул. Напр., у производных камфоры или триптицена, в молекулах к-рых асим. атом С находится в вершине циклич. системы, присоединение протона к промежут. карбаниону возможно только со стороны, противоположной циклич. системе:
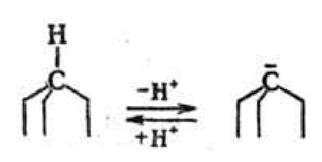
Физ. рацемизацию наиб. легко проследить на примерах таких родственных соед., как амины, фосфины, арсины, стибины 3R1R2R3. Молекулы этих соед. имеют неподеленную пару электронов, и при наличии разл. заместителей у гетероатома для них возможна оптич. изомерия. Рацемизация знантиомерных форм этих соед. обусловлена пирамидальной инверсией. В случае аминов вследствие быстрой инверсии выделить оптич. изомеры обычно не удается; амины существуют только в виде Р. Исключения - циклич. соед. (основания Трегера, азиридины, диазиридины) и третичные амины NR1R2R3, содержащие в радикалах R элект-роотрицат. заместители. С ростом размера гетероатома в ряду N < Р < As < Sb величина энергетич. барьера инверсии для соед. 3R1R2R3 возрастает, соотв. увеличивается и устойчивость этих соед. к рацемизации. Стибины вполне стабильны и при нормальных условиях могут существовать в виде Р. и отдельных энантиомеров.
Без к.-л. хим. р-ций происходит рацемизация соед. с мол. асимметрией. Такие соед. рацемизуются в результате взаимного перемещения (гелицены) или вращения (производные дифенила) отдельных фрагментов их молекул. Если энергетич. барьер этих перемещений достаточно высок, соед. устойчивы к рацемизации (производные дифенила с четырьмя объемистыми заместителями в орто-положениях или гелицены, содержащие в молекуле более шести конденсир. колец), в случае же малых энергетич. барьеров рацемизация осуществляется достаточно легко.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 3929; Нарушение авторских прав?; Мы поможем в написании вашей работы!