
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Застосування сульфатів 1 страница
|
|
|
|
- CuSО4 · 5Я2О — мідний купорос, використовується в сільському господарстві, у виробництві фарб.
- FeSO4 · 7H2O - залізний купорос, використовується в сільському господарстві для боротьби із шкідниками; як антисептичний засіб.
- CaSO4 · 2H2O - гіпс, у будівництві, медицині.
- Na2SO4 · 10H2O - глауберова сіль, в медицині як проносний засіб.
- Na2SO4 - сульфат натрію, у виробництві скла.
- K2SO4 - сульфат калію, як добриво.
- (NH4)2SO4 - сульфат амонію, як добриво.
- BaSO4 - сульфат барію, у виробництві паперу, гуми, у медицині.
Контрольні запитання:
1. Яка за характером сульфатна кислота? (Сильна, двохосновна, киснева.)
2. Записати молекулярну, графічну та електронну формули сульфатної кислоти.
3. Охарактеризувати фізичні властивості сульфат-ної кислоти. (Важка, безбарвна, масляниста рідина, гігроскопічна, активно вбирає воду, змішується з водою у будь-яких співвідношеннях.)
4. Техніка безпеки під час роботи з кислотами.
5. Правила розчинення кислот у воді.
6. Як розпізнати кислоти серед інших розчинів?
7. Які йони змінюють забарвлення індикатора?
8. Чи є сульфатна кислота електролітом?
9. Напишіть рівняння реакцій, які відбуваються у процесі добування сульфатної кислоти в техніці. Обґрунтуйте оптимальні умови їх здійснення.
10. Поясніть терміни «моногідрат» і «олеум».
11. Як ви гадаєте, чому перед надходженням суміші газів у контактний апарат її ретельно очищують?
Лекція 4 (заняття 5)
Тема 2.4 Склад, фізичні властивості, добування і застосування амоніаку. Солі амонію. Якісна реакція на йони амонію. Ортофосфатна і нітратна кислоти.
План:
2.4.1.Властивості амоніаку.
2.4.2.Добування амоніаку.
2.4.3.Хімічні властивості.
2.4.4. Солі амонію.
2.4.5. Добування амоніаку в промисловості.
2.4.6.Застосування амоніаку.
2.4.7. Ортофосфатна і нітратна кислоти.
2.4.1.Властивості амоніаку.
Амоніак – безбарвний газ з різким запахом. При температурі, нижчій за –33,4ОС, він переходить у рідкий стан.
Маса 1 л амоніаку за нормальних умов дорівнює 0,77 г.
При охолодженні до 33,4ОС амоніак під звичайним тиском перетворюється у
прозору рідину, що твердне при – 77,8ОС.
Структурна формула амоніаку.
2.4.2.Добування амоніаку.
У лабораторії амоніак добувають, нагріваючи амоній хлорид гашеним
вапном.
Амоніак, що утворився висушують СаО.
Амоніак добре розчинний у воді: 1:700.
Розчинність амоніаку у воді зумовлена утворенням водневим зв’язків між
їхніми молекулами.
2.4. 3.Хімічні властивості.
Для амоніаку характерні реакції приєднання і окислення.
1.Взаємодіє з водою і утворює гідрати NH3.H2O, 2NH3.Н2:
NH3+H2O=NH4OH.
Водний розчин NH3 – амоній гідроксид (слабка основа). Фенолфталеїн –малинове забарвлення, розчин NH3 10% нашатирний спирт.
2. Взаємодія з кислотами.
Утворюються солі амонію:
NH3+HCl=NH4Cl; 2NH3+H2SO4=(NH4)2SO4
3.Відновні властивості (при нагріванні).
а) згорає у кисні:
4NH3+3О2=2N2+6Н2О;
б)каталітичне окислення:
4NH3+5О2=4NО+6Н2О;
в)реагує з окислювачами:
4H3N +3Br2=6НBr+3N2; 2NH3+3CuO=3Cu+N2+3H2O.
2.4.4. Солі амонію.
Солі амонію складаються з катіона амонію та аніана кислоти.
Солі амонію добувають при взаємодії амоніаку або амоній гідроксид з
кислотами:
NH3+NHО3=NH4NО3;
2NH3+H2SO4=(NH4)2SO4;
NH4OH+HNO3=NH4NO3+H2O.
Солі амонію виявляють загальні властивості солей:
Всі амонійні солі добре розчиняються у воді. У водних розчинах солі
добре гідролізують.
+H2O=NH4OН+H+
1) взаємодія з лугами:+H2O
виділяється амоніак.
2.4. 5. Добування амоніаку в промисловості.
У промисловості амоніак синтезують з простих речовин Н2 і N2. Реакція
азоту з воднем екзотермічна, вона відбувається із виділенням теплоти.
Тому для зміщення рівноваги в оборотній системі слід зменшувати
температуру. Таке зменшення допускається до 450оС, при нижчій
температурі швидкість реакції дуже мала. Рівновага в системі зміщуєтьсяв бік утворення амоніаку при підвищенні тиску, тому процес проводять притиску 30Мпа.
Для збільшення швидкості реакції у виробництві амоніаку використовують
каталізатори – залізо з добавками алюміній і калій оксидів.
Суміш азоту і водню за допомогою компресора стискується до необхідного
тиску. Потім вона очищується, проходячи у контактний апарат, де
знаходиться каталізатор. З контактного апарату виходить газова суміш,
газів N2 і Н2, що не прореагували. Амоніак легко виділяється з суміші:
він зріджується значно легше ніж азот і водень, що не прореагували.
Рідкий амоніак добувають у холодильнику і збирають у збірнику.
1 – компресор; 2 – фільтр; 3 – контактний апарат; 4 – холодильник; 5 –
збірник.
2.4. 6.Застосування амоніаку.
Значну частину NH3 переробляють на НNO3 і її солі. Амоніак застосовують у виробництві соди. Рідкий амоніак, його водний розчин, солі амонію (NH4).
2.4. 7. Ортофосфатна і нітратна кислоти.
Ортофосфорна кислота (ортофосфатна, фосфатна або фосфорна кислота), Н3PO4 - безбарвна кристалічна речовина. Густина - 1,87 г/см3. Температура плавлення 42,35°С. У воді розчиняється дуже добре і у водному розчині є кислотою середньої сили. У практичному відношенні ортофосфатна кислота важливіша за метафосфатну, тому її часто називають фосфатною кислотою.
У водному розчині ортофосфатна кислота дисоціює ступінчасто:
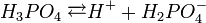
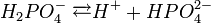
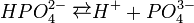
В промисловості її одержують при дії сульфатної кислоти на розмелений фосфат кальцію:
Ca3(PO4)2 + 3H2SO4 = 3CaSO4 ↓ + 2Н3PO4
Сульфат кальцію як мало розчинна речовина виділяється в осад, а фосфатна кислота залишається у розчині.
Харчова промисловість
Ортофосфорна кислота зареєстрована у якості харчової добавки Е338. Застосовується як регулятор кислотності у газованих напоях. Є відомості, що вона призводить до вимивання кальціюіз організму людини уже за годину після споживання.
Фізичні властивості нітратної кислоти. Безводна (100%-на) кислота — безбарвна рідина, що сильно пахне, температура кипіння. У разі зберігання на світлі поступово забарвлюється в бурий колір, внаслідок розкладання та утворення вищих нітроген оксидів, у тому числі й бурого газу. Добре змішується з водою в будь-яких співвідношеннях.
Хімічні властивості фосфатної кислоти. Виявляє всі типові властивості кислот. Фосфатна кислота — триосновна, утворює два ряди кислих солей — дигідрофосфати і гідрофосфати.
Хімічні властивості нітратної кислоти. Нітратна кислота — сильний окисник.
1) Дисоціація:
2) Взаємодія з оксидами металів:
3) Взаємодія з основами:
4) Взаємодія із солями:
5) Взаємодія з металами. При взаємодії з металами концентрованої і розведеної нітратної кислоти утворюється сіль (нітрат), нітроген оксиди, азот або амоніак і вода.
Застосування ортофосфатної й нітратної кислот.
Ортофосфатна кислота широко використовується у виробництві мінеральних добрив. Вона не отруйна й використовується в харчовій промисловості для виготовлення сиропів, напоїв (кока-коли, пепсі-коли).
Нітратна кислота витрачається на виробництво нітратних добрив, вибухових речовин, ліків, барвників, пластмас, штучних волокон та інших матеріалів. Концентрована нітратна кислота застосовується в ракетній техніці як окисник ракетного палива.
Нітрати
Солі нітратної кислоти — нітрати. Це тверді кристалічні речовини, добре розчинні у воді, токсичні. Натрій, Калій, Кальцій і амоній нітрати називають також селітрами.
Застосування нітратів. В основному нітрати застосовуються у виробництві добрив, вибухових речовин, нітратної кислоти, а також скла, ліків, для обробки та консервування харчових продуктів.
Фосфати
Солі фосфатної кислоти — фосфати. Ортофосфатна кислота — триосновна кислота, тому вона утворює три ряди солей: середні — фосфати і два ряди кислих солей — гідрофосфати і дигідрофосфати. Кислі солі розчиняються у воді краще, ніж середні.
Застосування фосфатів. Фосфати в основному застосовуються як мінеральні добрива, а також для виробництва фосфатних кислот, фосфору.
Контрольні запитання:
1. Які солі називають солями амонію?
2. Опишіть фізичні властивості солей амонію.
3. Які специфічні властивості солей амонію?
4. Як проходить процес розкладу солей амонію?
5. Опишіть галузі застосування солей амонію.
Тест:
1.Алотропія – це:
а) руйнування металів кислотами й лугами;
б) розкладання речовин під дією електричного струму;
в) існування хімічних елементів у вигляді кількох простих речовин.
2. Для Оксигену характерна валентність:
а) 1; б) 2; в) 4.
3. Для того щоб розчинити сульфатну кислоту, необхідно влити:
а) кислоту у воду; б) воду у кислоту; в) до кислоти додати луг.
4. Білий фосфор - це:
а) речовина схожа на графіт, з металевим блиском;
б) м’яка кристалічна речовина з запахом часнику;
в) темний порошок без запаху.
5. Нашатирний спирт - це:
а) розчин сірководню у воді;
б) розчин аміаку в соляній кислоті;
в) розчин аміаку у воді.
6. За стандартних умов азот – це:
а) газ без кольору і запаху;
б) безбарвний газ з різким запахом;
в) безбарвна кристалічна речовина.
7. Яка речовина потрапляючи у повітря викликає утворення «кислотних дощів»?
а)SO3;
б) SO2;
в) СО2.
СРС
Тема 2.5 Охорона навколишнього середовища від забруднення викидами сульфуровмісних та нітрогеновмісних речовин. Проблема вмісту нітратів у харчових продуктах
План:
2.5.1. Захист біосфери.
2.5.2. Забруднення нітратами та нітритами.
2.5.3. Забруднення продуктів харчування пестицидами.
2.5.4. Використання харчових добавок.
2.5.1.Захист біосфери
Захист біосфери від забруднення викидами хімічних виробництв — найважливіша проблема сучасності. У виробництві сульфатної кислоти можуть бути втрати якоїсь кількості діоксиду S02 і триоксиду сульфуру S03 та викидання їх в атмосферу, що спричинює кислотні дощі. Вони сприяють підвищенню кислотності ґрунтів і зниженню врожаїв, збільшенню кислотності водойм і загибелі його мешканців. Кислотні дощі спричинюють корозію металів, руйнують лакофарбові покриття. Під їх згубною дією руйнуються будівельні матеріали, пам'ятники архітектури.
Щоб запобігти утворенню кислотних дощів і забезпечити охорону здоров'я працівників, намагаються не допускати викидання оксиду сульфуру (ІV) S02 в атмосферу і в цехи заводу. З цією метою своєчасно ремонтують апаратуру, встановлюють фільтри, поглиначі, вентиляцію, суворо додержують технологічного режиму, використовують засоби індивідуального захисту працівників, удосконалюють й автоматизують виробничі процеси, герметизують устаткуваньня та апаратуру, впроваджують принцип безвідхідності та ефективні методи очищення відхідних газів. З них тепер вловлюють S02 і знову повертають його у виробництво. Застосовують також методи добування цінних побічних продуктів з промислових відходів.
Над проблемою повної утилізації та переробки відходів виробництва сульфатної кислоти нині працюють інженери техніки. Адже реалізація принципу безвідхідності дає змогу не тільки істотно збільшувати вихід кислоти, підвищувати ефективність виробництва, а й охороняти здоров 'я людей зберігати чистоту навколишнього середовища.
2.5.2. Забруднення нітратами та нітритами.
Нітрати – це солі азотної кислоти, які є природними сполуками і добре розчиняються у воді, а при нагріванні можуть переходити у нітрити з виділенням кисню. Вони входять в склад мінеральних добрив, а також являються натуральним компонентом харчових продуктів рослинного походження. У рослини нітрати надходять з ґрунту. Концентрація нітратів в продуктах харчування залежить в основному від неконтрольованого використання азотних добрив. Основним джерелом нітратів у сировині та продуктах харчуванні крім азотовмісних з’єднань являються нітратні харчові добавки, які вводять у м’ясні вироби для покращення їх харчових показників і подавлення деяких мікроорганізмів.
В Україні майже шоста частина сільськогосподарської плодоовочевої продукції містить нітрати у дозах, які перевищують максимально допустимий рівень. У першу чергу надмірний вміст нітратів у харчових продуктах сприяє розвитку онкологічних і алергічних захворювань. Надмір нітратів у плодоовочевій продукції не лише наслідок неправильного використання азотних добрив, а й результат сорбції окисів азоту безпосередньо з атмосфери, які утворюються при спалюванні різних видів палива. Основними причинами надміру нітратів у овочах із закритого ґрунту (парники, теплиці та ін.) є недостатнє освітлення, загущення посівів.
Вміст нітратів у рослинах залежить і від видових і сортових особливостей, часу збирання та ін. За однакових умов невелику кількість їх нагромаджують баклажани, томати, цибуля; підвищену – салати, капуста, ревінь, петрушка, редька, редиска. При звичайному вирощуванні нітрати не нагромаджуються в яблуках, ягодах, вишні, сливі, смородині, аґрусі. Менше нітратів містять дозрілі рослини. У харчових м’ясо-молочних продуктах наявність нітратів залежить від їх рівня в організмі тварин, а в кормових культурах – від видового складу, сорту, дози внесення азотних добрив, грунтово-кліматичних умов вирощування та інших агротехнічних факторів.
Велике значення для зниження нітратів має технологічна обробка сільськогосподарських продуктів. Так, при митті кропу, салату, петрушки й інших зелених культур кількість нітратів знижується на 20 %, а після двогодинного вимочування у воді на 30 – 60 %. Відварювання до готовності картоплі, буряків, моркви (після чистки і миття) дозволяє знизити концентрацію цих речовин відповідно на 65, 35, 25, 70 %.
Допустима доза нітратів для людини при надходженні в організм з продуктами харчування і водою за добу становить 5 мг/кг.
Через загрозу забруднення нітратами продуктів повністю забороняється застосування азотних мінеральних добрив при вирощуванні картоплі і овочево-баштанних культур на сильно кислих ґрунтах, на ґрунтах з високим вмістом мінерального азоту, на замерзлому або вкритому снігом ґрунті, при внесенні під овочеві культури і картоплю вапна, у заплавних ґрунтах з низьким вмістом калію та на території зони санітарної охорони джерел господарсько-питного постачання. Забороняється також вносити під картоплю та овочі селітру і безводний аміак.
Забруднення продуктів метаболітами мікроорганізмів. Одним з видів забруднювачів харчових продуктів є грибкові метаболіти. Пліснява вражає продукти як рослинного так і тваринного походження на будь-якому етапі їх отримання, транспортування та зберігання, в виробничих та домашніх умовах. Несвоєчасний збір врожаю або недостатня сушка його до зберігання, зберігання і транспортування продуктів при недостатньому захисті від вологості приводять до розмноження мікроміцетів і утворенню в продуктах харчування токсичних речовин. Мікотоксини можуть попадати в організм людини з харчовими продуктами – з м’ясом і молоком тварин, яких годували кормами забрудненими пліснявою.
Розмножуючись у продуктах харчування більшість плісняви не тільки забруднює їх токсинами, а й погіршують їх властивості, знижують їх харчову цінність, призводять до псування, роблять їх непридатними для технологічної обробки. Використання в тваринництві кормів, забруднених пліснявою веде до гибелі чи захворюванню скота та птиці. Щорічний збиток в світі від розвитку пліснявих грибків на сільськогосподарських продуктах і промисловій сировині складає 30 млрд. $.
Запобігання росту плісені на всіх стадіях заготівлі, переважно шляхом висушування або використання анти грибних препаратів (протонової кислоти) є найкращим засобом обмежити забруднення харчових продуктів афлатоксинами та мікотоксинами.
2.5.3. Забруднення продуктів харчування пестицидами.
Пестициди (лат. Pestis – зараза; sidus – вбиваючий) – загальна назва різних хімічних засобів, призначених для боротьби із шкідливими організмами рослинного і тваринного походження. Але вони надають лише тимчасову допомогу, оскільки з часом сприяють виробленню стійкості до постійно застосовуваних засобів. Це викликає необхідність використання нових, ще сильніших речовин, які паралельно посилюють негативний вплив на грунт, воду, повітря, якість продукції, на корисну флору і фауну, тим самим прискорюючи процес порушення біологічної рівноваги в природному середовищі. Дослідження показують, що в посівах кукурудзи майже 30 видів бур'янів, раніше чутливих до гербіцидів, набули до них стійкості. Виживаючи навіть після посиленого обробітку посіву кукурудзи гербіцидами, вони спричиняють значні втрати врожаю. Зараз налічується понад 400 видів комах і 7 видів гризунів, включаючи щурів, нечутливих до пестицидів. Розповсюдження пестицидів у навколишньому середовищі відбувається як фізичним, так і біологічним шляхом. Перший спосіб — розсіювання з допомогою вітру в атмосфері та поширення через водотоки. Другий — перенесення живими організмами по шляху харчування. Із просуванням організмів до вищих ланок харчового ланцюга концентрації шкідливих речовин зростають, нагромаджуючись у внутрішніх органах, переважно в печінці та нирках.
Пестициди поділяють на: гербіциди – речовини, призначені для знищення бур’янів і альгіциди – для знищення водоростей та іншої водяної рослинності; інсектициди – для знищення комах; фунгіциди – для знищення грибів (збудників хвороб); акарициди – для знищення кліщів; зооциди – для знищення гризунів; овіциди – для знищення яєць комах; родентициди – для знищення мишей, пацюків та інших гризунів; овіциди – для боротьби зі шкідливими птахами та інші.
До організму людини вони потрапляють через шкіру, дихальні шляхи чи шлунково-кишковий тракт; при безпосередній роботі з пестицидами або через їжу. Пестициди можуть міститися не лише в продуктах рослинного походження, а й у молочній та м’ясній продукції, тому що в організмах сільськогосподарських тварин залишаються пестициди, що були присутні у кормі. Разом з талими, дощовими та ґрунтовими водами ці речовини у великій кількості потрапляють до водойм. За даними минулорічного дослідження якості дніпровської води, пестициди присутні в усіх видах риб, причому рівень токсичних речовин в організмах річкових жителів значно вищий, ніж у самій воді.
Таким чином, в людському організмі опиняється незначна кількість шкідливих речовин, що мають властивість накопичуватись й викликати різноманітні хронічні захворювання шлунково-кишкового тракту чи нервової системи, а також дерматити та розлад дихання. Деякі пестициди здатні передаватися з молоком матері. Наприклад ДДТ, який хоч і заборонений зараз у багатьох країнах, міститься “всередині” кожного жителя планети, успадкований від попереднього покоління.
Обіг пестицидів в світі виріс за 5 років на 17 %, з 26,8 млрд. доларів в 1991р. до 31,3 млрд. в 1996р. До 2001 року обіг пестицидів становить 38,5 млрд. Цей ріст обумовлений збільшенням потреб у використанні пестицидів В 1996 році в світі було вироблено 2,4 млн. тон пестицидів. Основними їх виробниками та споживачами є країни Північної Америки (30 % обігу), Західної Європи (26 %), Японії і Китаю (24 %), обіг пестицидів у країнах Східної Європи і країнах СНГ (5 %).
В світі щорічно проводять досліди приблизно 500 тис. різних хімічних з’єднань на пестицидну активність, причому із цього величезного числа практичний вихід отримують приблизно 10...15 нових пестицидів. В економічно розвинених країнах витрати на науково-дослідницькі роботи складають приблизно 2 млрд. дол., що складає 10...15 % від суми реалізації готової продукції.
Інтенсивне забруднення природного середовища значною мірою є наслідком нераціонального сільськогосподарського виробництва. Щороку з мінеральними добривами на сільськогосподарські угіддя надходить 193 тис. т фтору,. 1,6 тис. т цинку, 620 тис. т міді та 622 т калію. У 90-ті роки залишкова кількість пестицидів у продуктах харчування, рослинах і тваринах зросла (порівняно з 60-ми роками) більш ніж у 9 разів. Отруйні речовини, які знаходяться у мінеральних добривах, хімічних меліорантах й отрутохімікатах, проникають в організми людей, викликаючи їх захворювання.
Застосування великих доз добрив може погіршити якість продукції, ґрунтових вод, що зумовлює забруднення близьких річок і водойм. Використання мінеральних добрив дало змогу певною мірою підвищити врожайність культур, однак подальше збільшення їх доз уже не сприяло її зростанню, що пов'язано із зменшенням запасів гумусу в грунті. Зростання врожайності неможливе без удосконалення технології внесення добрив. Безконтрольне їх застосування призводить до забруднення навколишнього середовища, що загрожує здоров'ю людини. Особливо небезпечне неправильне або надмірне використання пестицидів. Причому деяка їх частина трансформується, тобто виникають нові токсичні речовини (вторинна токсикація). Дати оцінку всіх наслідків впливу пестицидів неможливо через недосконалість методів дослідження.
На думку екологів, найактуальнішою з “пестицидних” проблем для України є забруднення довкілля хімікатами, що зберігаються на складах, які іноді навіть не мають власників. На території нашої держави зараз накопичено, за різними даними, від 15 до 25 тис. тонн непридатних пестицидів. Серед них є й ті, що входять в так звану “брудну дюжину” хімікатів, заборонених для використання (або призначених для обмеженого використання) в 127 країнах світу, які в 2001 р. підписали Стокгольмську конвенцію ООН зі стійких забруднювачів.
Доведено, що речовини з “брудної дюжини” (серед них пестициди ДДТ, алдрин, хлордан, дільдрин, ендрин, гептахлор, гексахлорбензол, мірекс, токсафен) здатні викликати рак та природжені дефекти у людей і тварин. Вони десятиріччями зберігаються в природі й накопичуються в жирових тканинах. Стійкі органічні забруднювачі розносяться по світові повітряними й океанськими течіями, вони виявлені навіть в організмах пінгвінів і ведмедів Антарктики. Хлорорганічні поєднання (ДДТ в тому числі) були знайдені в тканинах чорноморських дельфінів, і в такій кількості, що Чорне море може отримати першість за вміст хлорорганіки. Саме з впливом стійких забруднювачів вчені пов'язують низький рівень виживання яєць і скручені дзьоби у птахів, деформовані кінцівки у ссавців, порушення репродуктивної системи та розвитку. Деякі з них вважаються гормонально активними сполуками і вносять безлад в ендокринну та імунну системи, дію інших пов'язують із затримкою розумового розвитку.
У світі щорічно реєструється від 500 тис. до 2 млн. випадків отруєння людей пестицидами, більшість яких припадає на сільських жителів.
Підвищення токсичності суміші хімічних сполук у результаті посилення дії її компонентів на організм називають синергізмом фізіологічного типу, а в результаті взаємодії компонентів між собою – синергізмом хімічного типу. Зниження токсичності суміші в результаті протилежної дії характеризує антагонізм фізіологічного типу, а в результаті взаємодії компонентів між собою – антагонізм хімічного типу. Особливо часто проявляється адитивна дія – просте підсумування токсичної дії компонентів, які входять до суміші і мають незалежний механізм біологічної активності. У ряді випадків цей факт спостерігають на рівні низьких концентрацій.
Різноманітність хімічного складу і характеру дії пестицидів потребує уніфікації токсикогігієнічної термінології.
Залишкова кількість пестицидів у харчових продуктах, кормах, ґрунті, воді – активна частка пестицидного препарату, його похідні, а також неминучі хімічні домішки у пестицидному препараті, які мають біологічну активність і можуть шкідливо діяти на організм.
Біоконсентрація – нагромадження пестицидів або їх похідних у біосубстратах людини і тварин. Залишки пестицидів можуть бути наслідком безпосередньої обробки певного об’єкта (рослина, тварина, сховище, водоймище, ґрунт), міграції у природі або випадкового забруднення при внесенні пестицидів.
Фактична забрудненість пестицидами продуктів харчування, корму і об’єктів навколишнього середовища – це вміст залишків пестицидів (у момент їх визначення) у харчових продуктах рослинного та тваринного походження, рослинах, ґрунті, воді, повітрі, які зумовлені безпосереднім використанням пестицидів або транс локацією.
Частота проявлення залишків пестицидів у процентах до початкової кількості досліджених проб.
Рівень вмісту залишків, мг/кг (середній, мінімальний, максимальний), розраховують у міліграмах на добовий раціон.
Допустима добова доза для людини – добова кількість, щоденне надходження якої протягом усього життя не повинно негативно діяти на організм. Визначається в міліграмах на 1 кг маси тіла людини за добу. ДДД використовується при розробці гігієнічних нормативів допустимого вмісту пестицидів у різних середовищах, а також при оцінці рівня надходження в організм людини.
Підпорогова доза – максимальна кількість пестициду, яка не діє шкідливо на організм найчутливішого виду тварин при хронічному надходженні. Визначають за допомогою високочутливих тестів у мг/кг маси тіла тварини.
Тимчасово допустима добова доза встановлюється на суворо обмежений строк, потрібний для того, щоб можна було одержати додаткові дані, необхідні для визначення допустимої добової дози. Тимчасово допустиму дозу встановлюють з великим коефіцієнтом запасу, величину якого вибирають з урахуванням токсичної дії сполуки і ступеня її небезпеки. Коефіцієнт при цьому має бути вищим ніж при звичайному визначенні ДДД.
Умовно допустиму дозу встановлюють для пестицидів з метою тимчасового і обмеженого його використання в тих чи інших випадках, коли немає можливості замінити його безпечнішим препаратом.
Потенційно можлива допустима добова доза визначається розрахунком, виходячи з прийнятого рівня допустимого залишку пестициду з урахуванням добових норм споживання, які входять у добовий раціон.
Максимально допустимий рівень залишків пестицидів у харчових продуктах встановлюється на рівні фактичного змісту пестицидів при умові дотримання гігієнічно обґрунтованих регламентів використання. Контролюють порівнянням з ДДД. Одиниці виміру – міліграм на 1 кг. МДР не повинен перевищувати ДДД.
Гранично допустима концентрація – гігієнічний норматив, який обмежує концентрацію пестицид них препаратів у об’єктах навколишнього середовища на безпечному для здоров’я людини рівні.
Термін очікування у рослинництві – період від обробки до збирання врожаю у днях). Встановлюється для кожної окремої культури з урахуванням МДР пестициду.
Фонові допустимі залишки – допустима залишкова кількість стійких пестицидів, які неминуче присутні у продуктах харчування внаслідок їх використання в минулому і зумовлені процесами міграції у природних умовах.
Фізико-хімічним властивостям сполук останнім часом приділяють багато уваги. Майже всі пестициди, за винятком поодиноких, добре розчиняються у жирі й тому легко вільно проходять через шкіру тварин. На ступінь токсичності впливає форма пестицидів: масляні розчини деяких речовин токсичніші, ніж водні емульсії, дусти або гранульовані форми.
2.5.4. Використання харчових добавок.
Харчові добавки у широкому розумінні цього слова використовуються людиною віками, а то й тисячоліттями.
Широке використання харчових добавок, у сучасному розумінні почалось лише в кінці 19 ст., і швидко досягло максимального розповсюдження в наші дні у всіх країнах світу.
Не дивлячись на існуюче в багатьох переконання, харчові добавки по гостроті, частоті і тяжкості можливих захворювань треба віднести до розряду речовин мінімального риску.
Термін „харчові добавки” в справжній час не має одного тлумачення. В більшості випадків під харчовими добавками розуміють групу речовин природного чи штучного походження, які використовуються для покращення технології отримання продуктів спеціалізованого призначення. До харчових добавок, як привило, не відносять з’єднання, котрі збільшують харчову цінність продуктів (вітаміни, мікроелементи і тд.). Не являються харчовими добавками і речовини, котрі забруднюють продукти, потрапляючи з навколишнього середовища.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1287; Нарушение авторских прав?; Мы поможем в написании вашей работы!