
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Застосування сульфатів 2 страница
|
|
|
|
Харчові добавки можуть бути внесені в продукт на різних етапах його виробництва, зберігання і транспортування з ціллю покращення та полегшення виробничого процесу, збільшення стійкості продукту до різних видів псування, зберігання структури і зовнішнього виду продукту. Харчові добавки можуть залишатися в продуктах повністю чи лише частково в незмінному вигляді чи у вигляді, речовин, які отримуються в результаті хімічної взаємодії добавок з компонентами харчових продуктів.
Більшість харчових добавок, як правило, не мають харчового призначення і являються біологічно інертними для організму. Однак відомо, що любе хімічне з’єднання чи речовина в окремих умовах може бути токсичним. Отже, харчова добавка тоді вважається безпечною, коли у ній відсутня гостра і хронічна токсичність, мутагенні, тератогенні і гонадотропні властивості. Тому до харчових добавок ставлять тверді потреби.
Класифікація харчових добавок:
Е100-І182 Барвники - підсилюють або відновлюють колір продукту.
Е200-І299 Консерванти - підвищують строк зберігання продуктів, захищаючи їх від мікробів, грибків, бактеріофагів, хімічні добавки, що стерилізують, при дозріванні вин.
Е300-І399 Антиокислювачі - захищають від окислювання, наприклад, від прогоркания жирів і зміни кольору.
Е400-І499 Стабілізатори - зберігають задану консистенцію. Згущувачі - підвищують в'язкість.
Е500-І599 Емульгатори - створюють однорідну суміш фаз, що не змішують, (наприклад, води й олії).
Е600-І699 Підсилювачі смаку й запаху.
Е900-І999 Піногасники - попереджають або знижують утворення піни.
У ці групи, а також у нову групу - Е1000 - входять глазурувателі, ппідсоложувачі, розпушувачі й інші добавки. Цей вид добавок повністю заборонений в Україні
Харчові добавки, заборонені в Україні
Е121 - Барвник червоний цитрусовий 2.
Е123 - Червоний амарант.
Е240 - Консервант-формальдегід.
Харчові добавки, не дозволені в Україні
Заборона цих добавок пов'язана з тим, що весь комплекс випробувань ще не завершений.
Е103, Е107, Е125, Е127, Е128, Е140, Е153-155, Е160, Е166, Е173-175, Е180, Е182. Е209, Е213-219, Е225-228, Ее230-233, Е237, Е238, Ее241, Е263, Е264, Е282, Е283. Е302, Е303, Е305, Е308-314, ЕЕ317, Е318, Е323-325, Е328, Е329, Е343-345, Е349-352, Е355-357, Е359, Е365-368, Е370, Е375, Е381, Е384, Е387-390, Е399. Е430, Е408, Е409, Е418, Е419, Е429-436, Е441-444, Е446, Е462, Е463, Е465, Е467, Е474, Е476-480, Е482-489, Е491-496. Е505, Е512, Е519, Е521-523, Е535, Е537, Е538, Е541, Е542, Е550, Е554-557, Е559, Е560, Е574, Е576, Е577, Е580. Е622-625, Е628, Е629, Е632-635, Е640, Е641. Е906, Е908-911, Е913, Е916-919, Е922, Е923, Е924, Е925, Е926, Е929, Е943, Е944-946, Е957, Е959. Е1000, Е1001, Е1105, Е1503, Е1521.
Небезпечні харчові добавки:
Ті, що викликають злоякісні пухлини: Е103, Е105, Е121, Е123, Е125, Е126, Е130, Е131, Е142, Е152, Е210, Е211, Е213-217, Е240, Е330, Е447.
Ті, що викликають захворювання шлунково-кишкового тракту: Е221-226, Е320-322, Е338-341, Е407, Е450, Е461-466.
Алергени: Е230-232, Е239, Е311-313.
Ті, що викликають хвороби печінки й нирок: Е171-173, Е320-322.
Розглядаючи яскраву етикетку на пакеті, банці або пляшці, ми нерідко забуваємо прочитати те, що надруковано дрібним шрифтом де-небудь в куточку і те що не кидається в очі. А саме там знаходиться цінна інформація про продукцію, яку ми маємо споживати в їжу. При чому, якщо привабливий зовнішній вигляд упаковки прямо таки говорить: “З’їж мене”, то цей скромний напис частенько говорить протилежне “А чи варто?”. Виною всьому – велика кількість харчових добавок, які збільшуються із року в рік. Колись список продуктів, які людина “винайшла” сама, а не просто взяла у природи в готовому вигляді, був дуже коротким. В нього входив хліб, кисломолочні продукти, вино, цукор, пиво... Це, мабуть, і все. Науково-технічний прогрес порушив цю ідилію. Все простіше і дешевше стає синтезувати бажаний смак, колір і запах їжі, ніж добитися цього шляхом покращення якості продукту. Але чим приходиться розраховуватись за таке “прискорення”? Продукти “з пробірки” володіють багатьма винятковими властивостями. Наприклад, не псуються місяцями, навіть якщо лежать на сонці, зберігають товарний вигляд і зовнішню привабливість. А, щодо вмісту... Застережемо відразу: якщо у продукту дуже великий термін зберігання, занадто яскравий колір чи дуже різкий запах, то на смак його краще не куштувати.
В нас час існує велика кількість синтетичних продуктів, що виготовлені на основі синтезу органічних речовин. До них відносяться і харчові добавки які вносяться в продукти харчування для самих різноманітних цілей. Наприклад, щоб надати бажаний аромат, смак або колір, створити необхідну консистенцію продукту. Харчові добавки також використовують для повної або часткової заміни натуральної сировини. Без деяких добавок сучасна харчова промисловість не могла б існувати. Наприклад, без лимонної кислоти, яка є незамінна при виробництві безалкогольних напоїв. А нітрити калію і натрію використовують при виробництві сирокопчених та напівкопчених ковбас. По своїй дії харчові добавки діляться на структуроутворюючі, смакоароматичні і ті, що використовують при технологічній необхідності.
По походженню розрізняють природні добавки – такі, як цукор, сіль і вітаміни; лабораторні аналоги природних речовин – наприклад, ванілін; синтетичні – сахарин, аспартам.
Що ж являють собою харчові добавки? В Законі України “Про якість та безпеку харчових продуктів і продовольчої сировини” сказано, що харчова добавка – це “природна чи синтетична речовина, яка спеціально вводиться у харчовий продукт для надання йому бажаних властивостей”.
В нашій країні перелік харчових добавок дозволений для використання при виробництві продуктів харчування затверджений 4 січня 1999 року Кабінетом Міністрів України. Оскільки весь час з’являються нові добавки, перелік цей систематично переглядається і поповнюється. На сьогоднішній день він включає декілька сотень речовин. З них приблизно половина – натуральні, решта – синтетичні. В різних країнах світу на сьогоднішній день використовують біля 500 харчових добавок. До них відносяться барвники, консерванти, регулятори кислотності, антиоксиданти, стабілізатори, емульгатори та інші. В Україні існує перелік продуктів, що не підлягають забарвленню (підбарвленню), а саме: всі види мінеральної води, борошно, крохмаль, хліб і вироби з хліба, макаронні вироби, томатна паста, томатний соус, консерви з томатів, риба, молюски, ракоподібні та інші.
Всі існуючі добавки позначаються літерою “Е” і відповідним числом, які схвалені Європейською спільнотою, як безпечні харчові добавки. Їх індекси офіційно визнані в нашій країні. У відповідності з технологічним призначенням їх можна розділити на три групи:
– добавки, які забезпечують необхідний зовнішній вигляд і органолептичні властивості продукту. По-перше, це барвники (посилюють і відновлюють колір продукту). По-друге, добавки, які покращують консистенцію продукту. До них відносяться стабілізатори (сприяють загустінню і підвищенню в’язкості продукту);
– емульгатори (створюють однорідну суміш продуктів, що не змішуються – наприклад, води і масла);
– харчові добавки, які попереджують псування продуктів. Це антимікробні засоби – хімічні і біологічні, які підвищують терміни зберігання і захищають продукт від бактерій. А також антиоксиданти – перешкоджають хімічне псування продукту.
Крім цього, є цілий ряд харчових добавок, необхідних в технологічному процесі при виробництві продуктів харчування. Це – прискорювачі технологічного процесу, розрихлювачі, піноутворювачі, підсолоджувачі і т.д.
Проблема вмісту харчових добавок в їжу хвилює сьогодні всіх – вчених, виробників. А в першу чергу – мільйони простих споживачів продуктів харчування. Яким чином здійснюється в Україні і зокрема у ДП “Волиньстандартметрологія” контроль за безпекою харчових добавок?
Відповідними державними органами України забезпечується постійний контроль за безпечністю продуктів харчування. Встановлено, що харчові добавки повинні використовуватись при виробництві харчових продуктів в мінімально необхідних для досягнення технологічного ефекту кількостях. При цьому не повинні перевищувати встановлені максимально допустимі рівні. Продукти вітчизняного виробництва перш ніж попасти на прилавки магазинів, проходять гігієнічну експертизу. Виготовлення, застосування і реалізація харчових добавок на території України дозволяється тільки на основі позитивного висновку державної санітарно-гігієнічної експертизи. Застосування харчових добавок дозволяється лише в тих випадках, коли вони при довгому зберіганні не стають небезпечними для життя і здоров’я людини.
На етикетках багатьох товарів виробники часто пишуть дивні позначки, букви з цифрами, незрозумілі для пересічного споживача. Для людей без медичної освіти слова «стабілізатори», «консерванти», «емульгатори» мало про що кажуть. Проте на етикетках вони позначаються просто буквою «Е». Це загальноприйнята позначка, скорочена від слова Europa. Нею позначають харчові добавки, які використовуються у харчовій промисловості, щоби продукт довше зберігався, краще виглядав, мав відповідний колір тощо. Добавки нумеруються залежно від того, яку функцію виконують. Наприклад, Е від 100 до 200 – барвники, від 200 до 300 – консерванти, від 300 до 400 – антиокислювачі, далі нумеруються згущувачі, емульгатори, піногасники, підсилювачі смаку й аромату. Але така класифікація умовна, оскільки ті самі речовини можуть бути, скажімо, і консервантами, і антиокислювачами водночас (сульфіт натрію Е221).
Є харчові добавки природного походження. Наприклад, Е330 – лимонна кислота, а Е160а – каротин, Е101 – вітамін В2 (рибофлавін) міститься у томатах, з морських водоростей виділяють Е400 – альгінат натрію тощо.
Розповіді про побічний вплив деяких харчових добавок з жахливими наслідками для людини лякають. Наприклад, можна зустріти інформацію, що добавки Е103, Е105, Е121, Е123, Е125, Е126, Е152, Е210, Е211, Е213-217 та інші можуть спричинити злоякісні пухлини; Е221-226, Е320-322, Е338-341, Е407, Е450 – спричинюють захворювання шлунково-кишкового тракту; Е230, Е231, Е232, Е239 – містять алергени, а Е171-173, Е320-322 – можуть стати причиною захворювання нирок та печінки.
Добавки також бувають натуральними, наближеними до натуральних або синтетичними (штучними). Натуральні ароматизатори отримують із фруктів, квітів, листя. Їх сушать, дистилюють, чавлять, концентрують. Але їхні «недоліки» – недовговічність, вони розкладаються за температури, вищої 50 градусів, дороговизна – примусили виробників масово використовувати штучні добавки. Найвідомішою штучною ароматичною добавкою, яку використовують у кондитерській галузі, є етилванілін (замінник ванілі й ваніліну). Отже, якщо ви купили плитку натурального шоколаду, не полінуйтеся прочитати на звороті обгортки його вміст. Справжній шоколад готується на основі какао-масла, додають і терте какао. У продукті його має бути щонайменше 25 відсотків. Якщо ж какао-масло виробники «розвели» пальмовою, кокосовою, соєвою, соняшниковою олією, є ароматизатори та підсолоджувачі, то від справжнього шоколаду залишиться лише кондитерська глазур. На смак натуральне какао-масло моментально тане, а суміш – тягнеться, липне.
Найчастіше використовуються:
- Е100-182 – барвники. Підсилюють чи відновлюють колір продукту.
- Е200-299 – консерванти. Підвищують термін зберігання продуктів, дезінфікують, захищають їх від мікробів, грибків, бактеріофагів, а також хімічно стерилізують добавки під час дозрівання вин.
- Е300-399 – антиокислювачі. Захищають від окислення, наприклад, від згіркнення жирів і зміни кольору продуктів.
- Е400-І499 – стабілізатори. Зберігають задану консистенцію. Згущувачі. Підвищують в’язкість.
- Е500-І599 – емульгатори. Створюють однорідну суміш продуктів, що не змішуються, наприклад води й олії.
- Е600-І699 – підсилювачі смаку й аромату.
- Е900-І999 – піногасники. Запобігають утворенню піни чи знижують її рівень.
Поняття безпечності речовини, використовуваної в якості харчової добавки, уточнює спосіб його вживання. Вирішальне значення має добова кількість речовини, яка потрапляє організм, тривалість його споживання, режим харчування, шляхи потрапляння речовини в організм.
Крім того, слід враховувати, що дорослі люди, діти, люди літнього віку, вагітні мають різний рівень чуттєвості та захисних сил, тому проблеми використання харчових добавок набуває ще більшого гігієнічного значення. Не менш важливим фактором є також можлива взаємодія харчових добавок з шкідливими хімічними речовинами, котрі потрапляють в організм людини з навколишнього середовища.
Таким чином, харчові добавки можуть бути використані в харчовій промисловості тільки після усестороннього вивчення перекислених властивостей і встановлень повної безпеки використання кожної окремої добавки.
Гігієнічне регламентування харчових добавок в продуктах харчування виконується в чотири етапи.
Перший етап – проведення початкового токсико-гігеєнічної оцінки регламентованої речовини – харчової добавки. На основі інформації, отриманої виробником, визначають раціональну і товарну назву речовини її назву, технологію отримання, хімічну структуру та фізико-хімічні властивості. Встановлюють наявність і характеристику методів кількісного встановлення харчової добавки в харчових продуктах і різних середовищах. Встановлюють область і масштаби використання харчової добавки, її можливе розповсюдження в зовнішньому середовищі. Орентирно враховують ту дозу харчових добавок, яка може в реальних умовах поступати в організм людини з їжею. На основі цих даних складають програму подальших випробувань харчової добавки.
Другий етап випробувань харчової добавки є основним. В результаті проведення хронічного експерименту встановлюють порогову та максимально недіючу дозу харчової добавки по загально токсичній дії. Для цього використовують два виду модельних лабораторних тварин, в організмі яких метаболізм вивчаймого хімічного з’єднання ідентичний з метаболізмом людини. Тривалість експерименту складає зазвичай 9...18 місяців.
По закінченню хронічного експерименту на тваринах підвипробуваних груп і контролю роблять висновок про наявність чи відсутність у харчової добавки токсичності.
Під генетичною токсичністю речовини розуміють його здатність заподіювати шкідливий вплив на спадковість, тобто визивати небажані мутації. Розрізняють генні, хромосомні і геномні мутації.
Генні мутації виникають в наслідок змін випробуваної речовини структури окремих генів.
Хромосомні мутації виникають при зміні структури хромосом. Речовини, які визивають ці мутації, називаються мутагенами.
Геномні мутації поділяються на анеуплодії та поліплоїдії. Анеуплодією називають зміну кількості окремих хромосом. Поліплоїдія – це збільшення числа хромосомних наборів соматичних клітин у порівнянні з звичайним диплоїдним.
Контрольні запитання:
1.Охорона навколишнього середовища
2. Забруднення викидами сульфуровмісних та нітрогеновмісних речовин
3. Проблема вмісту нітратів у харчових продуктах
4. Захист біосфери.
5. Забруднення нітратами та нітритами.
6. Забруднення продуктів харчування пестицидами.
7. Використання харчових добавок.
Лекція 5 (заняття 7)
Тема 2.6 Карбонатна кислота і карбонати. Силікатна кислота і силікати.
План:
2.6.1 Карбонатна кислота
2.6.2 Карбонати
2.6.3 Силікатна кислота
2.6.4 Силікати
2.6.1 Карбонатна кислота
Карбонатна кислота, вугільна кислота, H2CO3 - нестійка, слабка, двоосновна кислота. Утворюється при розчинненні діоксиду вуглецю (карбон діоксиду) у воді:
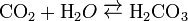
При цьому в хімічну реакцію вступає лише близько 1% розчиненого газу, а решта його залишається у вигляді молекул CO2. Карбонатна кислота дуже нестійка і тому може існувати лише в дуже розбавлених розчинах. Вона легко, особливо при нагріванні, розкладається на вихідні продукти:
H2CO3 = H2O + CO2↑
Карбонатна кислота належить до слабких кислот. Будучи двоосновною, вона дисоціює ступінчасто:
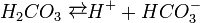
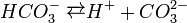
і в дуже незначній мірі.
2.6.2 Карбонати
Утворює два ряди солей: кислі солі з аніоном НСО3- і нормальні — з аніоном СО32-. Нормальні солі називають карбонатами, а кислі — гідрогенкарбонатами. Солі значно стійкіші за кислоту і можуть існувати в чистому вигляді.
Хім. властивості:
дисоціація;
взаємодія карбонатної кислоти з кислотами;
розкладання солей при нагріванні
Карбонати (рос. карбонаты, англ. carbonates, нім. Karbonate n pl) - солі й ефіри вугільної кислоти (напр., сода, поташ).
Розрізняють нормальні (середні) солі з аніоном СО32- (напр., К2СО3) та кислі (гідрокарбонати) з аніоном НСО3-(напр. КНСО3). У воді розчинні нормальні солі лужних металів, амонію й талію і майже всі гідрокарбонати. К. можна поділити на штучні (одержувані в технологічних процесах) та природні. Поширені природні К. мінерали кальцит і доломіт. За походженням більшість природних К. є продуктами вивітрювання і седи-ментації. Значна частина їх виникає також при ендогенних процесах у гідротермальних жилах. Застосовують К. у будівництві, хімічній промисловості, в оптиці тощо.
Усі карбонати, за винятком карбонатів лужних металів і амонію, у воді нерозчинні. Більшість карбонатів при нагріванні розкладаються, не плавлячись, на оксид відповідного металу і діоксид вуглецю. Наприклад:
MgCO3 = MgO + CO2↑
Карбонати лужних металів у термічному відношенні значно стійкіші і їх можна нагрівати до плавлення без розкладу.
Гідрокарбонати, на відміну від карбонатів, у воді розчинні. Вони можуть утворюватись при сумісній дії CO2 і H2O (H2CO3) на нормальні карбонати. Наприклад:
CaCO3 + CO2 + H2O = Ca(HCO3)2
У термічному відношенні гідрокарбонати менш стійкі за карбонати і вже при незначному нагріванні розкладаються, переходячи в нормальні солі:
2NaHCO3 = Na2CO3 + H2O + CO2 ↑
Ca(HCO3)2 = CaCO3 + H2O + CO2 ↑
При дії на карбонати і гідрокарбонати сильних кислот вони, як солі слабкої і нестійкої кислоти, легко розкладаються з виділенням діоксиду вуглецю:
BaCO3 + 2HCl = BaCl2 + H2O + CO2 ↑
ΝaHCO3 + HCl = NaCl + H2O + CO2 ↑
З солей карбонатної кислоти найбільше практичне значення мають карбонат натрію (сода кальцинована) Na2CO3, карбонат калію (поташ) K2CO3, гідрокарбонат натрію (питна сода) NaHCO3 ікарбонат кальцію (вапняк, крейда, мармур) CaCO3.
2.6.3 Силікатна кислота
Силікатна кислота H2SiO3 - сполука кремнію, назву якої утворено від латинської назви елемента Silicium. Силікатна кислота дуже слабка. Вона слабша навіть за карбонатну кислоту.
Силікатну кислоту можна одержати дією будь-якої кислоти на розчини силікату калію або натрію, наприклад:
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
При цьому вона виділяється у вигляді білого драглистого осаду, який містить значну кількість води. У воді H2SiO3 нерозчинна, але у подрібненому стані має властивість утворюватиколоїдний розчин. При нагріванні силікатна кислота поступово зневоднюється, а при прожарюванні повністю втрачає воду і перетворюється на силікатний ангідрид SiO2.
Взагалі силікатних кислот існує багато. Їх формули заведено записувати як сполуки силікатного ангідриду з водою, зв'язуючи формули крапкою. Наприклад, формулу метасилікатної кислоти H2SiO3 записують так: SiO2 • H2O. Формулу ортосилікатної кислоти H2SiO4 записують: SiO2 • 2H2O.
Крім мета- і ортосилікатної кислоти існує багато так званих полісилікатних кислот, в молекулах яких міститься більше одної молекули силікатного ангідриду. Їх позначають такою загальною формулою: (SiO2)n • (H2O)m. Наприклад,
H2Si2O5, або 2SiO2•H2O;
H4Si3O8, або 3SiO2•2H2O;
H2Si4O9, або 4SiO2•H2O
2.6.4 Силікати
Солі силікатної кислоти називають силікатами, а полісилікатних - полісилікатами. Їх зазвичай зображують формулами окремих оксидів, що входять до складу полісилікату, зв'язуючи формули оксидів крапками в єдину формулу полісилікату:
олівін - MgO•FeO•SiO2.
Силікати - солі силікатної кислоти.
Силікати (і полісилікати) у воді нерозчинні, за винятком силікатів натрію Na2SiO3 і калію K2SiO3.
Розчинне скло
Силікати натрію і калію одержують сплавленням кремнезему з твердими лугами або з карбонатами калію і натрію:
SiO2 + 2KOH = K2SiO3 + H2O ↑
SiO2 + Na2CO3 = Na2SiO3 + CO2 ↑
Одержувані при цьому сплавлені солі мають вигляд склоподібної маси. Тому силікати натрію і калію називають розчинним склом, а водні їх розчини — рідким склом. Розчинне скло додають до цементу і бетону, щоб зробити їх водонепроникливими. Ним просочують тканини і дерево для надання їм вогнестійкості. З розчинного скла виготовляють вогнестійкі замазки, силікатний клей тощо.
Природні сполуки силіцію
Більшість природних сполук силіцію являють собою похідні полісилікатних кислот. Коли до складу полісилікатів входить алюміній, тоді їх називають алюмосилікатами. Більшість гірських порід складаються з алюмосилікатів. До найпростіших полісилікатів і алюмосилікатів належать
азбест CaMg3Si4O12, або CaO • 3MgO • 4SiO2;
польовий шпат (ортоклаз) K2Al2Si6O16, або K2O • Al2O3 • 6SiO2;
каолін H4Al2Si2O9, або Al2O3 • 2SiO2 • 2H2O;
калійна слюда H4K2Al6Si6O24, або K2O • 3Al2O3 • 6SiO2 • 2H2O.
Природні силікати під впливом вологи і вуглекислого газу повітря повільно руйнуються (вивітрюються). Наприклад, розклад польового шпату (ортоклазу) схематично можна представити таким рівнянням:
K2O • Al2O3 • 6SiO2 + CO2 + 2H2O = K2CO3 + Al2O3 • 2SiO2 • 2H2O + 4SiO2
Поташ вимивається водою, а каолін утворює глину з домішками піску. Оскільки польовий шпат у природі дуже поширений, то і глина утворюється в дуже значних кількостях.
Контрольні запитання:
1.Яка основність карбонатної кислоти?(двоосновна)
2.Скільки видів солей вона утворює?(середні-карбонати:СаСО3, Na2CO3,K2СО3; кислі - гідрогенкарбонати: Са(НСО3)2, NaНСО3 та ін..).
При нагріванні відбувається взаємне перетворення цих солей:
MgCO3 MgO + CO2 Mg(HCO3)2 MgCO3+CO2+H2O
3.У першу порцелянову чашку насипали карбонат кальцій в другу — нітрат калію, в третю — хлорид натрію і почали прожарювати, забувши позначити вміст чашок. Як можна, спостерігаючи процес прожарювання і випробовуючи продукти реакції розпізнати взяті солі?
4. Як здійснити такі перетворення:
а) Са → Са(ОН)2 → СаС03 → СаО → Са(ОН)2 → СаСl2;
б) MgCl2 → MgC03 → Mg(HC03)2 → MgC03 → C02 →Na2C03?
Напишіть відповідні рівняння реакцій.
5. Як, маючи у розпорядженні тільки хлоридну кислоту розпізнати карбонат барію, сульфат барію, сульфіт барію? Відповідь проілюструйте рівняннями реакцій.
6. Як позбутися тимчасової твердості води? Відповідь проілюструйте рівняннями реакцій у молекулярній та йонній формах.
7. Крізь розчин їдкого натру пропустили 5,6 л (н.у.) оксиду карбону(IV). Маса утвореного гідрокарбонату натрію становить
(а) 21 г; (б) 42 г; (в) 84 г; (г) 168 г.
8. Внаслідок термічного розкладу 1 моль гідрокарбонату натрію, масова частка домішок в якому становить 2 %, утворюється вуглекислий газ об'ємом (н.у.)
(а) 5,5 л; (б) 11 л; (в) 22 л; (г) 22,4 л.
9. Для аналізу вапняку на вміст карбонату кальцію взяли наважку 5 г. На розчинення карбонату, який міститься у цій пробі, витрачено 100 мл 0,9 М розчину хлороводню. Яка масова частка карбонату кальцію у вапняку?
10. Суміш карбонату і гідрокарбонату натрію масою 146 г нагрівали доти, поки не припинилось зменшення маси. Маса залишку, що утворився після нагрівання, становить 137 г. Обчисліть масову частку карбонату натрію у цій суміші.
Лекція 6 (заняття 9)
Тема 2.7Практичне значення неметалів та їх сполук. Будівельні матеріали..
План:
2.7.1 Практичне значення неметалів та їх сполук
2.7.2 Будівельні матеріали.
2.7.3 Застосування будівельних матеріалів
2.7.1 Практичне значення неметалів та їх сполук
Неметали –прості речовини, які не мають властивостей металів, а саме: металічного блиску, непридатні для кування, погано проводятьтепло, електричний струм.
За електронною будовою зовнішнього енергетичного рівня атомів більшість неметалічних елементів є р-елементи, а Гідроген і Гелій - s-елементами. На зовнішньому енергетичному рівні мають від 4 до 8 електронів. У хімічних реакціях атоми неметалів, як правило, прєднуютьелектрони і перетворюються на негативно заряджені йони - аніони. Неметалічний характер елементів і хімічна активність неметалів посилюються в періодах зліва направо, а в головних підгрупах - знизу догори.
До неметалів зараховують 22 хімічних елементи: водень (гідроґен), азот, арсен, силіцій, кисень (оксиґен), флуор, хлор, інертні гази, бром, карбон, фосфор, сульфур, селен, йод, астат, телур,бор. Типові оксиди неметалів є ангідридами. Різкої межі між металами, металоїдами та неметалами немає.
Частина неметалів має атомну будову. Із окремих атомів складаються інертні гази - гелій, неон, аргон, криптон, ксенон і радон. У графіті, алмазі, силіції, борі, червоному фосфорі всі атоми сполучені один з одним. Водень, азот, кисень, фтор, хлор, бром, йод мають двохатомні молекули. Більшу кількість атомів містять молекули озону О3, білого фосфору Р4, сірки S8, фулеренуС60. Атоми в неметалах сполучені ковалентними неполярними зв'язками.
2.7.2 Будівельні матеріали.
Із природних матеріалів, що містять Силіцій, виготовляють скло,
кераміку, цемент.
Скло—це твердий прозорий матеріал. Найпоширенішим є силікатне скло,основний компонент якого — оксид силіцію(ІУ) 8Ю2.
Сировиною для виробництва звичайного скла є сода Na2CO3, вапняк СаСО3, пісок SiO2. Усі складові частини очищають, змішують і сплавляють за температури близько 1400 °С.
Фактично до складу скла входять силікати натрію і кальцію, а також надлишок SiO2. Тому склад звичайного віконного скла можна подати такою
спрощеною формулою: NajO • СаО • 6SiO2.
Змінюючи склад шихти, додаючи різні добавки, одержують скло з наперед заданими властивостями. Так, якщо замість соди NajCOj взяти поташ К2СО3, то можна добути високоякісне тугоплавке скло, з якого виготовляють хімічний посуд. А якщо взяти поташ К2СО3, кремнезем SiO2 і оксид плюмбуму(П) РЬО, то утвориться кришталь.
Особливий вид скла —кварцове скло. Воно являє собою склоподібну форму чистого кремнезему SiO2. Таке скло зовсім не чутливе до різких коливань температури, воно має цінні оптичні властивості (пропускає ультрафіолетові промені).
Скло широко використовують майже у всіх галузях промисловості та в побуті. З нього виготовляють труби, тару, лабораторний посуд, деталі оптичних приладів, художні вироби, побутовий посуд. На основі скла виготовляють скловолокно, яке застосовують для пошиття спецодягу, а також склопластики, зокрема склотекстоліт. Цей склопластик — чудовий будівельний матеріал (міцний, не гниє, легко обробляється).
Склотекстоліт використовують як конструкційний матеріал у машинобудуванні, а в електроніці — як ізолятор. На основі скла створюють мікрокристалічні матеріали—ситали. Вони дуже міцні, хімічно й термічне стійкі, а тому використовуються для виготовлення апаратури для хімічних виробництв, деталей машин і механізмів, труб, електроізоляторів тощо.
Сучасна промисловість виробляє спеціальне скло, стійке проти дії радіоактивного випромінювання.
Кераміка. Вироби з глини називають керамікою, а керамічне виробництво—гончарним. Найпоширеніша кераміка та, що складається з різних оксидів, у тому числі —оксиду силіцію(ІУ) SiO2. Із керамічних виробів важливе значення мають порцеляна і фаянс.
Порцеляна — один із видів тонкої кераміки — білий матеріал, складається в основному з SiO2, А12О3 і K2O. Як сировину для добування порцеляни використовують білу глину — каолін, кварцовий пісок і польовий шпат (K2O• Al2O3 • 6SiO2). Порцеляна має невелику пористість, через що вона водо-газонепроникна, доволі високу механічну міцність і термостійкість, електроізоляційні властивості. З неї виготовляють санітарно-технічні вироби, електроізолятори, предмети побуту і художні вироби. Фаянс — керамічний матеріал, схожий на порцеляну, покритий тонкою склоподібною плівкою — поливою. Містить ті самі компоненти, що й порцеляна, але в інших співвідношеннях. Із фаянсу виготовляють облицювальну плитку, посуд, художні вироби.
Будіве́льні матеріа́ли — це різні за складом, структурою, формою та властивостями речовини, застосовувані безпосередньо для будівництва споруд або для виготовлення з них збірних елементів на спеціалізованих підприємствах.
Найпростіші будівельні матеріали — пісок, глина, деревина, природний камінь, гравій.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 947; Нарушение авторских прав?; Мы поможем в написании вашей работы!