
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Застосування сульфатів 3 страница
|
|
|
|
Азбе́стова промисло́вість — промисловість з видобування азбестової руди і виробництву азбесту. Азбестове волокно з давніх-давен застосовувалося для виготовлення неспалимих ґнотів,одягу та ін. виробів. Сучас. азбестова промисловість виробляє понад 2 000 видів продукції.
2.7.3 Застосування будівельних матеріалів
Азбест широко використовується для виробн. азбестоцементних покрівельних матеріалів, водопровід. і каналізац. труб та ін. виробів і конструкцій, азбестотех. виробів для різних галузеймашинобудування, тепло- і електроізоляц. матеріалів.
Генеза виробництва
У Росії виробн. азбесту виникло на Уралі на початку 18 ст. В кін. 19 ст. запроваджено механізацію збагачення азбесту. В 1913 було вироблено 23 тис. т азбесту.
Виробництво в СРСР
В СРСР на основі використання великих ресурсів азбесту на Уралі, механізації гірничих робіт і введення в дію великих збагачувальних фабрик виробництво азбесту в 1940 досягло 143 тисяч т. За післявоєнні роки проведено дальшу технічну реконструкцію азбестових рудників, розширено діючі і збудовано нові потужні збагачувальних фабрики. Випуск азбесту в 1957 становив 801 тисяч т проти 241 тисяч т в 1950.
Тенденції
А. п. широко впроваджуються високопродуктивне гірничотранспортне устаткування, автоматизація виробництва, радіозв'язок та ін. На кінець семирічки на базі родовищ азбесту на Уралі і в Казахстані випуск азбесту досягне бл. 2 млн т (без 7-го сорту). В Україні в азбестоцементній та ін. галузях промисловості широко використовується азбест, завезений в основному з Уралу.
А. п. у інших країнах
Порівняно великі ресурси азбесту має КНР, де випуск його становить понад 20 тис. т на рік і намічається дальший розвиток цього вироби.
Haйбільш розвинуте виробн. азбесту в Канаді, а також в Південно-Африканському Союзі, Пд. Родезії, США, Свазіленді, Італії.
Контрольні запитання:
1. Що таке попередньо напружений залізобетон і які його переваги в порівнянні зі звичайним залізобетоном?
2. У яких трьох перерізах вивчається будова деревини, і які основні елементи можна розрізнити в її торцевому перерізі за допомогою лупи?
3. Як виготовляють мінеральну вату?
4. Назвіть основні звукоізоляційні матеріали
5. Чим відрізняються будівельні розчини від бетонів?
6. Назвіть основні гідроізоляційні матеріали, одержувані на основі полімерів і бітумополімеров
Лекція 7 (заняття 10)
Розділ 3. Металічні елементи та їх сполуки
Тема 3.1 Загальна характеристика металічних елементів. Метали як прості речовини. Металічний зв'язок. Поняття про корозію.
План:
3.1.1 Загальна характеристика металічних елементів
3.1.2 Класифікація металів
3.1.3 Сплави металів
3.1.4 Коро́зія металів
3.1.5 Боротьба з корозією
3.1.1 Загальна характеристика металічних елементів
Мета́ли (від грец. μέταλλον (métallon) — шахта, кар'єр, добування з надр землі) — клас хімічних елементів і речовин з наступними хімічними іфізичними властивостями: добре проводять електрику і тепло, непрозорі, але можуть відбивати світло (мають металічний блиск); ковкі, що дозволяє надавати виробам з них потрібної форми і розвальцьовувати у плоскі пластинки, пластичні, що дає можливість витягати їх у тонкий дріт.
Історична довідка
В стародавні часи і в середні віки вважалося, що існує лише сім металів: золото, срібло, мідь, олово, свинець, залізо, ртуть. За уявленнямиалхіміків, метали зароджувалися в земних надрах під впливом променів планет і поступово украй повільно удосконалювалися, перетворюючись на срібло і золото. Алхіміки вважали, що метали — речовини складні, що складаються з «металічного начала» (ртуті) і «начала горючості» (сірки). На початку 18 століття набула поширення гіпотеза, за якою метали складаються із землі і «вогняної субстанції» — флогістону.
В кінці 18 століття А. Л. Лавуазьє спростував гіпотезу флогістону і показав, що метали — прості речовини. У 1789 Лавуазьє у посібнику з хімії дав список простих речовин, в який включив всі відомі тоді 17 металів (Sb, Ag, As, Bi, Co, Cu, Sn, Fe, Mn, Hg, Mo, Ni, Au, Pt, Pb, W, Zn). У міру розвитку методів хімічного дослідження число відомих металів зростало. У першій половині 19 століття були відкриті елементи супутники платини —платиноїди, отримано шляхом електролізу деякі лужні і лужноземельні метали, відкриті невідомі метали при хімічному аналізі мінералів.
У 1860-63 роках методом спектрального аналізу були відкриті Cs, Rb, Tl, In. Відкриття радіоактивності наприкінці 19 ст. дало поштовх успішним пошукам природних радіоактивних металів. І, нарешті, методом ядерних перетворень починаючи з середини 20 століття штучно отримано радіоактивні метали, зокрема, трансуранові елементи.
3.1.2 Класифікація металів
Металами є прості речовини більшості хімічних елементів (приблизно 80 % елементів періодичної системи елементів). Найпоширенішим хімічним елементом-металом, у земній корі є алюміній.
Групи металів за використанням
Широко використовуються такі типи металів:
чорні метали — залізо, манган, хром, використовуються як основні метали у чорній металургії, а їх сплави у всіх галузях машинобудування;
-дорогоцінні метали: золото, срібло і платина, використовуються переважно в ювелірній промисловості;
-важкі метали: мідь, цинк, олово і свинець, застосовуються в машинобудуванні, енергетиці;
-рідкісні важкі метали: нікель, кадмій, вольфрам, молібден, манган, кобальт, ванадій, вісмут, використовуються в сплавах з чорними металами як легуючі елементи;
-легкі метали: алюміній, титан і магній, використовуються в авіації, космічній галузі;
-лужні метали: калій, натрій і літій використовуються переважно у сполуках у вигляді солей та електролітів;
-лужноземельні метали: кальцій, барій і стронцій, застосовуються в хімії
У техніці найбільшого застосування набули залізо, алюміній, мідь, свинець, цинк, олово, нікель. Вони ще мають назву «технічні метали».
3.1.3 Сплави металів
Металевими сплавами називають речовини, які складаються не менше, як з двох компонентів і одним з них обов’язково повинен бути метал. Сплавиметалів відіграють велику роль, так як вони мають вищі механічні і технологічні властивості, ніж їхні складові компоненти чисті метали. Компонентами називають хімічні елементи або їх сполуки у складі сплаву. За кількістю компонентів сплави поділяють на подвійні, потрійні і т.д.
У техніці найчастіше застосовуються сплави на основі заліза (чавун, сталь), і сплави кольорових металів на основі міді (латунь, бронза), алюмінію (силумін, дюралюміній), свинцю, цинку, олова, нікелю. Деякі сплави створюють на основі вольфраму, титану, ванадію, молібдену й інших металів.
Залежно від природи компонентів, з яких складається сплав, розрізняють наступні різновидності сплавів:
-механічна суміш компонентів — ці суміші неоднорідні, вони є найдрібнішою сумішшю кристалітів компонентів;
-необмежений твердий розчин компонентів — однорідний, може утворюватися при різному співвідношенні компонентів;
-обмежений твердий розчин компонентів — -однорідний, може утворюватися при різному але обмеженому співвідношенні компонентів;
-хімічна сполука компонентів — однорідний, може утворюватися при чітко визначеному співвідношенні компонентів.
У твердих розчинах атоми розчиненої речовини заміщають атоми розчинника у кристалічній решітці або проникають у неї; хімічні сполуки утворюють нову відмінну кристалічну решітку. Після кристалізації сплаву утворюється або одна фаза (твердий розчин, хімічна сполука), або сплав, який містить суміш фаз. Фазою називають однорідну частину системи, відділену від інших складових (фаз) поверхнею поділу.
Будова
Всі метали мають кристалічну будову. Розташовані тим або іншим способом, атоми утворюють елементарну комірку просторової кристалічної ґратки. Тип ґратки залежить від хімічної природи і фазового стану металу.
У заліза, хрому, молібдену, вольфраму і деяких інших металів елементарна комірка є кубом із атомами у вершинах і додатковим — у центрі (об'ємноцентрована кубічна ґратка). При температурі понад 910°С у кристалічній структурі заліза відбувається перебудова, число атомів у елементарній комірці збільшується до 14-ти. В результаті перебудови симетрія елементарної комірки змінюється — атоми розміщуються у вершинах куба й додатково в центрі кожної грані (гранецентрована кубічна ґратка). Існування одного металу в декількох кристалічних формах називається поліморфізмом, чи алотропією, а температура, при якій метал переходить з одного стану в інший — температурою поліморфного перетворення. Залізо, наприклад, має дві температури поліморфного перетворення: 910 °C і 1400 °C. Цинк, магній, титан мають елементарну комірку в формі шестигранної призми. Як і залізо, олово, нікель, титан,кобальт та деякі інші метали зі зміною температури змінюють тип своїх ґраток. Наприклад, нікель може мати кубічну гранецентровану чи гексагональну ґратки, а кальцій — кубічну гранецентровану, гексагональну і кубічну об'ємно-центровану.
Елементарні комірки кожного даного кристала однаково орієнтовані в просторі, розташовуючись послідовно, вони мають загальні з сусідніми комірками атоми й утворюють разом просторову ґратку. Проте різні метали з ідентичною кристалічною ґраткою мають різні параметри, тобто відстані між сусідніми атомами. Параметр решітки (сторона куба або шестигранника) у міді 0,36 нм, в алюмінію 0,405 нм, у цинку 0,267 нм і т. д.
Перехід з рідкого стану у твердий для металів — це процес перетворення неупорядкованого розташування атомів у закономірне з утворенням кристалічних ґрат і, отже, кристалів. Такий процес називається первинною кристалізацією.
Установлено, що кристалізація складається з двох елементарних процесів, перебіг яких відбувається одночасно: перший — зародження центрів кристалізації, другий — ріст кристалів з цих центрів. У звичайних умовах кристали не можуть набути правильної форми тому, що їхній ріст обмежується суміжними кристалами. Кристали, що мають неправильні зовнішні обриси, називаються кристалітами, або зернами. Внутрішня будова зерен кристалічна.
На швидкість кристалізації та форму кристалів у процесі затвердіння металу важливий вплив роблять швидкість і напрям відводу тепла. У напрямку відводу тепла кристали ростуть швидше, утворюючи осі, від яких відгалужуються численні відростки. Такі деревоподібні кристали називають дендритами. Дендритна будова характерна для литого металу.
3.1.4 Коро́зія металів
Коро́зія металів — процес хімічного руйнування металів і сплавів при їх взаємодії з зовнішнім середовищем: повітрям, водою, розчинами електролітів тощо. Розрізняють два види корозії: хімічну і електрохімічну.
Різновиди корозії
Хімічна корозія відбувається в середовищах, які не проводять електричного струму. Вона обумовлюється дією на метали неелектролітів (спирту, бензину, мінеральних масел тощо) і сухих газів (кисню, оксидів азоту, хлору, хлороводню, сірководню і ін.) при високій температурі (так звана газова корозія).
У результаті взаємодії металів із зовнішнім середовищем їх поверхня вкривається тонким шаром (плівкою) різних хімічних сполук (продуктів корозії): оксидів, хлоридів, сульфідів і т. д. Інколи цей шар такий щільний, що крізь нього не може проникати агресивне середовище. В таких випадках з часом швидкість корозії зменшується, а то й зовсім припиняється. Наприклад, алюміній в атмосфері повітря кородує значно повільніше від заліза, хоч за своїми хімічними властивостями він активніший від заліза. Це пояснюється тим, що поверхня алюмінію вкривається суцільною, досить щільною і міцною оксидною плівкою, яка ізолює метал від доступу кисню, а оксидна плівка заліза, навпаки, є крихкою і ламкою, містить багато пор і тріщин, через що кисень повітря крізь неї легко проникає до поверхні заліза, і тим обумовлюється безперервне його руйнування.
Електрохімічна корозія більш поширена і завдає значно більшої шкоди, ніж хімічна. Вона виникає при контакті двох металів у середовищі водних розчинів електролітів. На відміну від хімічної електрохімічна корозія супроводжується переміщенням валентних електронів з одної ділянки металу на іншу, тобто виникненням місцевих електричних струмів внаслідок утворення на кородуючій поверхні так званих гальванічних пар.
Для кращого розуміння механізму електрохімічної корозії розглянемо докладніше процес розчинення металу в розчині електроліту з виділенням водню, наприклад розчинення цинкової пластинки в розведеній сульфатній кислоті без контакту і в контакті з мідною пластинкою.
При зануренні цинкової пластинки в кислоту атоми цинку з її поверхні поступово переходять у розчин у вигляді іонів Zn2+, а їх валентні електрони залишаються на поверхні металу. Внаслідок цього на границі метал—електроліт утворюється подвійний електричний шар. Внутрішню обкладку цього шару утворюють негативні заряди надлишкових електронів (позначених знаком —), а зовнішню обкладку — позитивні заряди іонів цинку (позначених знаком +). Внаслідок взаємного притягання між протилежними зарядами іони цинку, що переходять у розчин, містяться поблизу поверхні металу. Дальший процес розчинення цинку стає можливим лише завдяки тому, що іони водню підходять до поверхні цинку і приєднують надлишкові електрони. При цьому іони цинку перестають утримуватись у подвійному електричному шарі негативними зарядами і вільно дифундують у глибину розчину, а на їх місце з поверхні металу переходять нові іони цинку і т. д. Таким чином, приєднання надлишкових електронів з поверхні металу іонами водню електроліту забезпечує безперервний перехід іонів цинку в розчин, тобто його розчинення, (кородування).
З цього виходить, що процес розчинення цинку в кислоті складається з двох паралельних процесів: з віддачі атомами цинку валентних електронів (окиснення цинку) і переходу іонів-цинку в розчин:
(Метал) 2e <- Zn0 -> Zn2+ (Розчин)
і з приєднання надлишкових електронів іонами водню (відновлення іонів водню) і виділення вільного водню:
(Метал) 2е + 2Н+ -> 2Н° -> Н2 ↑
Обидва ці процеси відбуваються на поверхні того самого металу — на цинковій пластинці. Але при певних умовах їх можна просторово роз'єднати. Так, коли поряд з цинковою пластинкою занурити в розчин мідну і обидві пластинки з'єднати металічним провідником, то перший процес (розчинення цинку) буде відбуватися на цинковій пластинці, а другий (відновлення іонів водню) — на мідній.
Мідь, як відомо, з розведеною сульфатною кислотою не взаємодіє. Тому іони міді не переходять у розчин і на її поверхні не буде надлишків електронів. Але коли обидві пластинки з'єднати мідною дротиною, то концентрація надлишкових електронів, (цинкової пластинки) почне вирівнюватись на обох пластинках і електрони з цинкової пластинки почнуть переміщатися на мідну. Якщо в систему включити гальванометр, то він покаже наявність електричного струму. Однак концентрація електронів, на обох пластинках не може бути однаковою. Це пояснюється тим, що іони водню легше розряджаються (приєднують електрони) на поверхні міді, ніж на поверхні цинку. Через це процес відновлення іонів водню і виділення вільного водню буде відбуватися практично лише на мідній пластинці, а на цинковій; майже зовсім припиниться. Але швидкість розчинення цинку при цьому значно збільшиться, оскільки надлишкові електрони, з поверхні цинку будуть швидко переміщатися на мідну пластинку і там приєднуватися іонами водню.
Приклад розчинення цинку, що перебуває в контакті з міддю, у розчині сульфатної кислоти є прикладом утворення і роботи гальванічних пар, які лежать в основі електрохімічної корозії. Гальванічні пари можна утворювати з будь-яких двох металів, які контактують між собою і занурені в розчин електроліту. При цьому швидкість кородування активнішого металу значно збільшується, а менш активний метал зовсім не кородує. На ньому відбувається лише відновлення іонів водню тими електронами, що прибувають з поверхні активнішого металу.
Електрохімічна корозія металів виникає не тільки в присутності сильних, а й слабких електролітів і навіть тонкого шару вологи, якою вкриваються металічні конструкції в атмосфері повітря. Будучи дуже слабким електролітом, вода теж дисоціює, утворюючи іони Н+ і ОН-, хоч і в незначній кількості. Але при розчиненні в ній різних солей, що містяться в повітрі у вигляді пилу, і газів — CO2, SO2 і ін., концентрація різних іонів, у тому числі й іонів водню, збільшується і стає достатньою для виникнення і перебігу електрохімічної корозії.
Як приклад електрохімічної корозії в присутності вологи, повітря розглянемо процес кородування залізної конструкції з мідними заклепками. Коли така конструкція вкривається шаром вологи (розчином електроліту), то залізні і мідні ділянки її поверхні утворюють гальванічні пари. При цьому атоми заліза як більш активного металу переходять у розчин у вигляді двовалентних іонів Fe2+, а втрачені ними валентні електрони переміщаються на мідь і там приєднуються катіонами водню, відновлюючи їх до вільного водню. Процес кородування заліза в контакті з міддю схематично можна зобразити такими рівняннями:
дисоціація води: 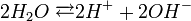
втрата атомами заліза валентних електронів і перехід іонів у розчин: (Метал) 2е <- Fe0 -> Fe2+ (Розчин)
відновлення катіонів водню (на поверхні міді) і виділення вільного водню: 2Н+ + 2е -> 2Н° —> Н2 ↑;
утворення дигідроксиду заліза: Fe2+ + 2OH- -> Fe(OH)2;
окиснення двовалентного заліза до тривалентного розчиненим киснем повітря: 4Fe(OH)2 + O2 + 2H2O -> 4Fe(OH)3;
часткова втрата води тригідроксидом заліза і перетворення його в гідроксид-оксид заліза:
В результаті цих реакцій залізо вкривається шаром іржі, яка складається головним чином з FeO(OH), а також з гідроксидів заліза Fe(OH)2 і Fe(OH)3.
Гальванічні пари на кородуючій поверхні можуть утворюватись не лише при контакті двох металів з великими поверхнями, а й при контакті основного металу з нерозчинними в ньому домішками інших металів, які завжди містяться в технічних металах. У таких випадках на кородуючій поверхні металу утворюється безліч невеликих за розмірами так званих мікро-гальванічних пар, роботою яких обумовлюється електрохімічне кородування основного металу. Як при контакті двох різних металів (утворенні макрогаль-ванічних пар), так і при наявності в основному металі нерозчинних домішок інших металів (утворенні мікрогальванічних пар) потік електронів (електричного струму) спрямований від більш активного металу до менш активного. Більш активний метал кородує (руйнується), а менш активний не кородує. На ньому лише відновлюються іони водню тими електронами, що прибувають від атомів активнішого металу. Швидкість електрохімічної корозії тим більша, чим більше утворюється на кородуючій поверхні гальванічних пар, тобто чим більше є контактів основного металу з іншими менш активними металами або чим більше він забруднений домішками менш активних металів. Чим чистіший метал, тим менше він піддається корозії, а дуже чисті метали майже зовсім не кородують.
Швидкість електрохімічної корозії залежить також від різниці активності металів, що утворюють гальванічні пари. Чим більш віддалені ці метали один від одного в електрохімічному ряді напруг, тим більша швидкість корозії. На швидкість корозії впливає також електроліт і температура. Чим сильніший електроліт, тобто чим більше міститься в ньому іонів, зокрема іонів водню, і чим вища температура, тим більша швидкість електрохімічної корозії. Боротьба з корозією. Корозія металів завдає величезних збитків народному господарству. Внаслідок корозійного руйнування втрачається близько 10% щорічного видобутку металів. Тому заходам боротьби з корозією приділяється значна увага. Способів боротьби з корозією багато і вони досить різноманітні.
Біокорозія — корозія металів, спричинювана мікроорганізмами або продуктами їх життєдіяльності.
3.1.5 Боротьба з корозією
Одним з найбільш поширених способів боротьби з корозією є покриття металу (головним чином заліза) масляними фарбами. Захисна дія фарби основується на тому, що оліфа, піддаючисьполімеризації, утворює на поверхні металу суцільну еластичну плівку, яка ізолює метал від дії атмосферних хімічних агентів. Інколи для захисту металу від корозії (наприклад, алюмінію і деяких стальних виробів) штучно створюють оксидну плівку обробкою їх поверхні сильними окисниками.
Значного поширення одержав також спосіб покриття одного металу іншим. Наприклад, дахове залізо покривають тонким шаромцинку. З цією метою залізні листи занурюють на короткий час у розплавлений цинк. Сам по собі цинк в атмосфері повітря не піддається корозії, оскільки на його поверхні утворюється досить стійка захисна оксидна плівка ZnO. При пошкодженні цинкового шару (тріщини, подряпини тощо) цинк з залізом у присутності вологи повітря утворює гальванічну пару. При цьому електрохімічному корозійному руйнуванню піддається цинк як активніший метал, а залізо не руйнується доти, поки не буде зруйнований весь захисний шар цинку.
На цьому ж принципі основується і так званий протекторний спосіб захисту металів від корозії. Суть цього способу полягає в тому, що металеву конструкцію сполучають металічним провідником з активнішим металом, який піддається корозійному руйнуванню. Наприклад, у парові котли інколи вводять листи цинку, які сполучають залізними стержнями з стінками котла. При цьому утворюється в середовищі води гальванічна пара, внаслідок чого цинк, як активніший метал руйнується, а залізні стінки котла не піддаються корозії. Так само можна захищати і підземні трубопроводи.
Інколи металеві вироби вкривають захисним шаром менш активного металу. Прикладом цього може служити біла жерсть, з якої виробляють консервні банки. Її одержують зануренням на короткий час залізних листів у розплавлене олово. Олово дуже добре захищає залізо доти, поки його шар суцільний. Але коли захисний шар пошкоджується і залізо приходить у дотик з агресивним середовищем, воно з оловом утворює гальванічну пару і залізо як активніший метал піддається корозійному руйнуванню. При цьому залізо кородує значно скоріше, ніж у тому випадку, коли воно не вкрите шаром олова.
Досить поширеним є гальванічний спосіб покриття одного металу іншим (шляхом електролізу). Цим способом покривають нікелем (нікелювання), хромом (хромування), міддю (міднення), сріблом (сріблення), золотом (золочення) і іншими металами. Гальванічним способом можна наносити дуже тонкий і рівномірний шар захищаючого металу. Гальванічні покриття не тільки захищають металічні вироби від корозії, а й надають їм гарного зовнішнього вигляду.
Для боротьби з корозією в середовищі рідин застосовують спеціальні добавки, так звані інгібітори, тобто сповільнювачі корозії. Інгібіторами можуть бути різні речовини: хромат натрію, дихромат калію, фосфат натрію тощо, а також желатин, клей та інші органічні речовини. Інгібітори сприяють утворенню на кородуючій поверхні металу міцної захисної плівки, внаслідок чого швидкість корозії може зменшуватись у десятки і сотні разів. Особливо важливу роль відіграють інгібітори при взаємодії металів з кислотами. Так, наприклад, коли додати деякі інгібітори до хлоридної кислоти, то її можна зберігати в стальній тарі, хоч хлоридна кислота з залізом взагалі реагує досить енергійно. Крім того, останнім часом стали широко застосовувати сплави з високими антикорозійними властивостями. Такі сплави одержують шляхом добавок до основного металу інших металів — нікелю, кобальту, хрому і ін. Прикладом антикорозійних сплавів може служити сталь із вмістом 15—20% Зі. Така сталь цілком стійка до дії кислот. З неї виготовляють різну хімічну апаратуру.
Металі́чний зв'язо́к — тип хімічного зв'язку, при якому валентні електрони атомів делокалізуються і починають взаємодіяти з атомними остовамиусього тіла.
При встановленні металічного типу зв'язку з атомів утворюється метал, в якому позитивно заряджені іони занурені в електронний газ. Незважаючи на заряджений стан іонів, взаємодія між ними екранується рухливими електронами, й не поширюється на далекі відстані.
Більшість металів утворює одну з наступних високосиметричних ґраток з щільною упаковкою атомів: кубічну об'ємно центровану, кубічну гранецентрировану і гексагональну. У кубічної об'ємно центрованої ґратки атоми розташовані у вершинах куба і один атом в центрі обсягу куба. Кубічну об'ємно центровану грати мають метали: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba та ін. У кубічної гранецентрованої ґратки атоми розташовані у вершинах куба і в центрі кожної грані. Грати такого типу мають метали: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co та ін. У гексагональної ґратки атоми розташовані у вершинах і центрі шестигранних основ призми, а три атома - у середній площині призми. Таку упаковку атомів мають метали:: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca та ін. Вільно рухомі електрони зумовлюють високу електро-і теплопровідність. Речовини, що володіють металічним зв'язком, часто поєднують міцність з пластичністю, тому що при зміщенні атомів один щодо одного не відбувається розрив зв'язків.
Контроліні запитання:
1. Поняття корозії.
2. Характеристики та сутність корозійних процесів.
3. Класифікація корозійних середовищ.
4. Швидкість корозії.
5. Основи теорії корозії.
6. Класифікація корозійних процесів
7. Методи захисту від корозії.
8. Електрохімічний захист
9. Силікатні покриття
10. Покриття металами
Лекція 8 (заняття 11)
Тема 3.2 Хімічні властивості металів. Сполуки металів з Оксигеном і Гідрогеном.
План:
3.2.1 Хімічні властивості металів
3.2.2 Гідриди
3.2.3 Оксиди
3.2.1 Хімічні властивості металів
Характерною особливістю металів є здатність їх атомів віддавати свої валентні електрони і утворювати позитивно заряджені іони. На відміну від неметалів метали негативно заряджених іонів не утворюють. Отже, вільні метали є відновниками. Чим легше даний метал віддає свої валентні електрони, тим він активніший відновник. За хімічною активністю метали можна розподілити на три групи: сильно активні — калій, натрій, барій, кальцій і ін., середньої активності — цинк, залізо, нікель тощо і мало активні — срібло, золото і платина. Відносну активність металів можна визначити за положенням елемента в періодичній системі Д. І. Менделєєва: металічний характер елементів і хімічна активність металів посилюється в періодах справа наліво, а в головних підгрупах - згори донизу. Типові металічні елементи перебувають у лівому нижньому куті довгого варіанта періодичної системи. Це францій, цезій, радій.
Сильно активні метали з киснем повітря енергійно взаємодіють вже при звичайній температурі, утворюючи оксиди, наприклад:
2Ca + O2 = 2CaO
Тому лужні і лужноземельні метали зберігають під шаром гасу, щоб запобігти їх окисненню киснем повітря. Метали середньої активності окиснюються киснем повітря лише з поверхні, покриваючись тонкою оксидною плівкою, яка запобігає дальшому окисненню металу. Наприклад:
2Zn + O2 = 2ZnO
Але при високій температурі вони енергійно взаємодіють з киснем і перетворюються в оксиди.
Малоактивні (благородні) метали з киснем безпосередньо не реагують взагалі. Більшість металів може безпосередньо реагувати з сіркою, хлором і майже з усіма неметалами, особливо при високій температурі. З водою сильно активні (лужні і лужноземельні) метали взаємодіють вже при звичайній температурі з виділенням водню і утворенням розчинних гідроксидів (лугів), наприклад:
2Na + 2H2O = 2NaOH + H2 ↑
Ba + 2H2O = Ba(OH)2 + H2 ↑
Метали середньої активності, наприклад залізо, реагують з водою (водяною парою) лише при сильному розжаренні:
3Fe + 4H2O = Fe3O4 + 4H2 ↑
Мало активні метали з водою не реагують ні при яких умовах. Відношення металів до кислот визначається їх місцем в електрохімічному ряду напруг (ряду активності). Усі метали, що займають місце в ряду напруг лівіше від водню взаємодіють з кислотами з утворенням солі і виділенням водню (з нітратної кислоти водень не виділяється!) Метали, що займають місце в ряду напруг правіше від водню, водню з кислот не витісняють. Але деякі з них можуть реагувати з концентрованою сульфатною кислотою при нагріванні з утворенням солі і виділенням діоксиду сірки SO2, наприклад:
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 ↑
Що ж стосується нітратної кислоти, то при взаємодії її з усіма металами, незалежно від їх місця в ряду напруг, водень з HNO3 не виділяється, а утворюються оксиди азоту і сіль металу. Наприклад:
3Zn + 2HNO3 + 6HNO3 = 3Zn(NO3)2 + 2NO ↑ + 4H2O
3Ag + HNO3 + 3HNO3 = 3AgNO3 + NO ↑ + 2H2O
3.2.2 Гідриди
Гідри́ди — сполуки Гідрогену і елементів з меншою електронегативністю ніж у Гідрогену. Так, наприклад, сполука Гідрогену з галогенами, Нітрогеном, Оксигеном, Карбоном і Сульфуром не є гідридами.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 604; Нарушение авторских прав?; Мы поможем в написании вашей работы!