
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Застосування сульфатів 5 страница
|
|
|
|
Найважливішими природними сполуками феруму, що мають промислове значення, є магнітний залізняк Fe3O4, червоний залізняк Fe2O3, бурий залізняк Fe2O3 · nH2O та пірит FeS2. Оксиди феруму служать рудами, з яких добувають залізо, а пірит — сировиною для сульфатно-кислотного виробництва.
Розповсюдженість феруму в гірських породах (% за масою): ультраосновні — 9,85; основні — 8,56; середні — 5,85; кислі — 2,70; лужні — 3,60; осадові — 3,33. Відомо понад 300 мінералів, що містять ферум: оксиди, сульфіди, силікати, фосфати,карбонати та ін.
Найважливіші мінерали феруму: гематит Fe2O3 (70% Fe), магнетит Fe3O4 (72,4% Fe), ґетит FeOOH (62,9% Fe), лепідокрокітFeO(OH) (62,9% Fe), лімоніт — суміш гідрооксидів Fe з SiO2 та ін. речовинами (40-62% Fe), сидерит FeCO3 (48,2% Fe),ільменіт FeTiO3 (36,8% Fe), шамозит (34-42% FeO), вівіаніт (43,0% FeO), скородит (34,6% Fe2О3), ярозит (47,9% Fe2О3) та ін.
Багаті родовища магнітного залізняку зосереджено на Уралі поблизу м. Магнітогорська та в Курській області (так званаКурська магнітна аномалія). Родовища червоного залізняку є в Україні поблизу м. Кривий Ріг. Родовища бурого залізняку зосереджені на Керченському півострові. Крім того, потужні родовища залізних руд виявлено і в інших місцях — наКольському півострові, в Сибіру і на Далекому Сході.
Ізотопи
Природне залізо складається з чотирьох стабільних ізотопів: 54Fe (ізотопна поширеність 5,845%), 56Fe (91,754%), 57Fe (2,119%) і 58Fe (0,282%). Також відомо більше 20 нестабільних ізотопів заліза з масовими числами від 45 до 72, найбільш стійкі з яких — 60Fe (період напіврозпаду за уточненими в 2009 році даних становить 2,6 мільйона років), 55Fe (2,737 року),59Fe (44,495 доби) і 52Fe (8,275 години); інші ізотопи мають період напіврозпаду менше 10 хвилин.
Ізотоп заліза 56Fe належить до найстабільніших ядер із найменшою енергією зв'язку у розрахунку на один нуклон. Усі попередні елементи можуть зменшити енергію зв'язку за рахунок синтезу, а всі наступні — шляхом розпаду. Вважають, що залізом закінчується процес синтезу елементів в ядрах нормальних зірок. Раніше вважалося, що всі наступні елементи можуть утворитися тільки в результаті вибухів наднових. Проте за сучасними уявленнями, синтез елементів, важчих заліза, відбувається не лише у наднових, а й у надрах зір-гігантів на пізніх стадіях їх еволюції завдяки s-процесу.
3.5.3 Історія заліза
Використання заліза почалося набагато раніше, ніж його виробництво. Перші залізні вироби мали космічне (метеоритне) походження і були виготовлені з уламків метеоритів ще в III—II тис. до н. е. Час від часу знаходили шматки сірувато-чорного металу, який перековували на кинджал або наконечник списа, що був зброєю міцнішою і пластичнішою, ніж бронза, і довше тримав гостре лезо.
Першим кроком у зародженні металургії заліза було отримання його шляхом відновлення з окису. Руда перемішувалася з деревним вугіллям і закладалася в піч. При високій температурі, створюваної горінням вугілля, вуглець починав з'єднуватися не лише з атмосферним киснем, але і з тим, що пов'язаний з атомами заліза. Після вигоряння вугілля в печі залишалася так звана криця — грудка речовини з домішкою відновленого заліза. Крицю потім знову розігрівали і піддавали обробці куванням, вибиваючи залізо із шлаку. Таке залізо не відрізнялось твердістю та пружністю, тому мало обмежену галузь застосування.
Вперше залізо навчилися обробляти народи Анатолії. Давньогрецька традиція вважала відкривачем заліза народ халібів, для яких традиційно вживалася стійка назва «батько заліза», і сама назва народу бере початок саме від грецького слова Χάλυβας («залізо»).
«Залізна революція» почалася на межі I тисячоліття до н.е. в Ассирії. З VIII століття до н.е. зварне залізо швидко стало поширюватися в Європі. Першими, хто почав на землях сучасної України виплавляти з болотної руди залізо, були кіммерійці (VII ст. до н.е.)[8]. У IV - III ст. до н.е. більша частина арсеналу зброї скіфських воїнів — мечі, кинджали, бойові сокири тощо було виготовлено з заліза. У III столітті до н.е. залізо витіснило бронзу в Галлії, у II столітті нової ери з'явилося у Німеччині, а в VI столітті нашої ери вже широко вживалося в Скандинавії. В Японії залізний вік настав лише в VIII столітті нашої ери.
Побачити залізо у рідкому стані металурги змогли лише в XIX столітті, однак, ще на початку I тисячоліття до нової ери — індійські майстри зуміли вирішити проблему отримання пружної сталі без розплавлення заліза. Таку сталь називали булатом, але через складність виготовлення і відсутність необхідних матеріалів у більшій частині світу ця сталь так і залишилася індійським секретом на тривалий час.
Технологічніший шлях одержання пружної сталі, при якому не потрібні ні особливо чиста руда, ні графіт, ні спеціальні печі, було винайдено в Китаї в II столітті нашої ери. Сталь перековували дуже багато разів, при кожному куванні складаючи пластину вдвічі, внаслідок чого виходив відмінний матеріал для зброї, що отримав назву дамаська сталь, з якого, зокрема, робилися японські катани.
З XVI століття в Європі набув поширення так званий переробний процес в металургії — технологія, при якій залізо ще при отриманні за рахунок високої температури плавлення і інтенсивного навуглецьовуванния перетворюється на чавун, а вже потім, рідкий чавун, звільняючись від зайвого вуглецю при відпалі в горнах, перероблявся на сталь.
3.5.4 Отримання заліза
У промисловості залізо отримують із залізної руди, в основному з гематиту (Fe2O3) і магнетиту (FeO · Fe2O3).
Існують різні способи отримання заліза з руд. Найбільш поширеним є доменний процес.
Перший етап виробництва — відновлення заліза вуглецем у доменній печі за температурі 2000 °C. У доменну піч вуглець (у вигляді коксу), залізна руда (у вигляді агломерату або окатишів) і флюс (наприклад, вапняк) подаються зверху, а знизу нагнітається гаряче повітря.
У печі вуглець у вигляді коксу окислюється до монооксиду вуглецю. Цей оксид утворюється під час горіння в умовах нестачі кисню:

У свою чергу, монооксид вуглецю відновлює залізо з руди. Щоб реакція йшла швидше, нагрітий чадний газ пропускають через оксид заліза(III):
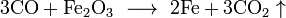
Флюс додається для позбавлення від небажаних домішок (в першу чергу від силікатів, наприклад кварцу) у видобутій руді. Типовий флюс містить вапняк (карбонат кальцію) і доломіт (карбонат магнію). Для усунення інших домішок використовують інші флюси.
Дія флюсу (у наведеному випадку — карбонат кальцію) полягає в тому, що під час нагрівання він розкладається до його оксиду:

Оксид кальцію з'єднується з діоксидом кремнію, утворюючи шлак — метасилікат кальцію:

Шлак, на відміну від діоксиду кремнію, плавиться в печі. Легший, ніж залізо, шлак плаває на поверхні — це властивість дозволяє відділяти шлак від металу. Шлаки потім можуть застосовуватися у будівництві та сільському господарстві. Розплав заліза, отриманий у доменній печі (чавун), містить досить багато вуглецю. Крім тих випадків, коли чавун використовується безпосередньо, він вимагає подальшої переробки.
Надлишки вуглецю та інші домішки (сірка, фосфор) видаляють з чавуну окисленням у мартенівських печах або в конвертерах. Електричні печі застосовуються для виплавки легованих сталей.
Крім доменного процесу, поширений процес прямого отримання заліза. У цьому випадку попередньо подрібнену руду змішують з особливою глиною, формуючи окатиші. Окатиші обпалюють, і обробляють в шахтній печі гарячими продуктами конверсії метану, які містять водень. Водень легко відновлює залізо:
 , при цьому не відбувається забруднення заліза такими домішками як сірка і фосфор, які є звичайними для кам'яного вугілля. Залізо утворюється в твердому вигляді, і надалі переплавляється в електричних печах.
, при цьому не відбувається забруднення заліза такими домішками як сірка і фосфор, які є звичайними для кам'яного вугілля. Залізо утворюється в твердому вигляді, і надалі переплавляється в електричних печах.
Хімічно чисте залізо добувають електролізом розчинів його солей.
3.5.5 Фізичні та хімічні властивості
Фізичні властивості
Залізо — блискучий сріблясто-білий важкий метал. Густина його 7,86 т/м3; температура плавлення 1538 °C, температура кипіння 2862 °C. Залізо досить пластичне. Воно легко кується, штампується, витягується в дріт і прокатується в тонкі листи, легко намагнічується і розмагнічується. Вище температури Кюрі (770 °C) втрачає феромагнітні властивості. До температури 912 °C існує в алотропній модифікації α-заліза з об'ємноцентрованою кубічною кристалічною ґраткою, за вищої температури — γ-заліза із гранецентрованою кубічною ґраткою, вище 1394 °C знову змінює тип ґратки на об'ємноцентровану кубічну (δ-залізо).
Хімічні властивості
Ферум належить до восьмої групи періодичної системи елементів Менделєєва. Його атоми на зовнішній електронній оболонці мають по два електрони, а на передостанній — 14 електронів. Атоми феруму можуть легко втрачати два електрони і перетворюватись у двовалентні катіони Fe2+. Вони можуть втрачати і три електрони (один з передостанньої оболонки) і перетворюватись у тривалентні катіони Fe3+. Таким чином, залізо утворює два ряди сполук. Сполуки тривалентного феруму стійкіші.
У сухому повітрі за звичайної температури залізо досить стійке, але у вологому швидко іржавіє, вкриваючись товстим шаром іржі. Іржа є сумішшю оксидів і гідроксидів феруму. Основну частину іржі складає сесквіоксид заліза Fe2O3 і тригідроксид заліза Fe(OH)3. Крім того, до її складу входить монооксид заліза FeO, дигідроксид заліза Fe(OH)2 та інші сполуки. Процес ржавіння заліза можна зобразити такими приблизними рівняннями:
2Fe + O2 + 2Н2О = 2Fe(OH)2
4Fe(OH)2 + O2 + 2Н2О = 4Fe(OH)3
Fe(OH)2 = FeO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Іржа досить крихка і пориста. Тому вона не може ізолювати метал від атмосфери, через що процес ржавіння відбувається безперервно. При високій температурі залізо легко сполучається з киснем,; утворюючи окалину Fe3O4 (FeO · Fe2O3). В атмосфері кисню розжарена залізна дротина горить яскравим полум'ям, утворюючи теж окалину Fe3O4. При нагріванні залізо може легко реагувати з хлором, сіркою та іншими неметалами:
2Fe + 3Cl2 = 2FeCl3
Fe + S = FeS
В електрохімічному ряді напруг залізо стоїть лівіше від водню, тому воно легко реагує з розведеними хлоридною і сульфатною кислотами:
Fe + 2HCl = FeCl2 + Н2 ↑
Fe + H2SO4 = FeSO4 + H2 ↑
З розведеною нітратною кислотою залізо теж легко реагує:
Fe + HNO3 + 3HNO3 = Fe (NO3)3 + 2H2O + NO ↑
Але з концентрованою нітратною і концентрованою сульфатною кислотами без нагрівання залізо не реагує. Воно стає «пасивним», вкриваючись тонкою оксидною плівкою, яка не розчиняється в кислотах і ізолює метал від дії кислоти. Завдяки цьому концентровану нітратну і концентровану сульфатну кислоту можна зберігати і транспортувати в залізній тарі.
Залізо може відновлювати менш активні метали з розчинів їхніх солей, наприклад: Fe + CuSO4=FeSO4 + Cu
3.5.6 Застосування
Чисте залізо має досить обмежене застосування. Його використовують при виготовленні сердечників електромагнітів та якорів електромашин, як каталізатор хімічних процесів, для виготовлення анодних пластин залізо-нікелевих акумуляторів. Карбонільне залізо використовують для нанесення найтонших плівок і шарів на магнітофонні стрічки та диски носіїв постійної пам'яті, як антианемічний засіб та ін. Залізний порошок використовують при зварюванні, а також для цементації міді.
Залізовуглецеві сплави чавун і сталь — основний конструкційний матеріал, що застосовується у всіх галузях промисловості. Виробництво заліза та його сплавів складає більше 90% виробництва всіх металів і утворює окрему галузь промисловості — чорну металургію.
Сталі містять до 2,14% карбону, чавун — понад 2,14%.
Чавуни
Розрізняють сірий чавун (містить 2-3,5% C, а також, Si і Mn) — він не дуже твердий, добре відливається у форми, крихкий і при ударі легко розколюється. Графіт у ньому має пластинчасту форму. Сірий чавун йде на виливок машинних станин, махових коліс, каналізаційних труб, плит і т.п. Чавуни з кулястим графітом порівняно з іншими чавунами мають вищу пластичність, ударну в’язкість й одночасно міцність (за що їх називають високоміцними), що насамперед зумовлено кулястою формою графіту, яка забезпечується сфероїдизуванням. Чавун, в якому майже весь вуглець міститься у вигляді цементиту (Fe3C), твердіший (450...550 НВ), має назву білий чавун (містить 2-3,5% C, Si> 1%, Mn-1-1,5%). Білий чавун використовується для подальшої переробки: при виплавці сталі та отримання шляхом графітизувального відпалу ковкого чавуну.
Сталі
Сталь, на відміну від чавуну, легко піддається куванню та вальцюванню. При швидкому охолодженні (гартуванні) вона виходить дуже твердою, при повільному охолодженні м'якою. М'яку сталь легко обробляти. З неї роблять гайки, болти, дріт, покрівельні матеріали, деталі машин. З твердої і теплостійкої сталі інструментальна сталь виготовляють інструменти для обробки матеріалів. Велике значення мають в сучасній техніці леговані сталі. Вони містять так звані легуючі елементи, до яких відносяться хром, нікель, молібден, ванадій, вольфрам, марганець,мідь, кремній та ін. Легуючі елементи додаються для надання сталям певних властивостей. сульфат заліза (залізний купорос) у суміші з мідним купоросом використовується для боротьби із шкідливими грибками в садівництві та будівництві.
Знаходять широке застосування і багато сполук заліза. Так, сульфат заліза (III) використовують при водопідготовці, оксиди та ціанід заліза служать пігментами при виготовленні барвників, семиводний
Біологічна роль
Ферум життєво важливий хімічний елемент для всіх організмів. В клітинах ферум зазвичай зберігається в центрі метал-протеїнів, оскільки вільний ферум неспецифічно зв'язується із численними хімічними речовинами клітини і може каталізувати утворення токсичних вільних радикалів. Нестача феруму в організмі може призводити до анемії.
У тваринах, рослинах та грибах ферум часто входить до складу гемномго комплексу. Гем — важлива складова частина цитохромних білків, які грають роль посередиників у окисно-відновлювальних реакціях, та білків, які переносять оксиген — гемоглобіну, міоглобіну й леггемоглобіну. Неорганічний ферум також може впливати на окисно-відновлювальні реакції у залізо-сіркових кластерах багатьох ензимів, як, наприклад, нітрогенази.
До негемних протеїнів належать ензими монооксигенази метану, які окиснюють метан до метанолу, рибонуклеотид редуктаза, яка відновлює рибозу до деоксирибози, гемеритріни, які відповідають за транспортування й фіксацію оксигену у морських хребетних та пурпурова кислотна фосфатаза, що каталізує гідроліз ефірів фосфору.
У ссавців розподіл феруму в організмі жорстко регулюється, оскільки ферум потенціально токсичний. Розподіл феруму регулюється ще й тому, що його потребують чимало бактерій, тож обмеження доступу бактерій до цього елементу допомагає запобігти інфекції або обмежити її. Вочевидь це причина відносно малої кількості феруму в молоці ссавців. Основу системи регулювання вмісту феруму складає білок трансферин, який зв'язує залізо й транспортує його до кров'яних клітин.
Контрольні запитання:
1.Якою є будова атома заліза?
2. Якою є поширеність заліза в природі?
3. Як одержують залізо з його руд? Вкажіть види залізних руд.
4. Опишіть фізичні властивості заліза.
5. Хімічні властивості заліза.
СРС
Тема 3.6 Охорона навколишнього середовища під час виробництва і використання металів.
План:
3.6.1Сучасні масштаби впливу людини на природу
3.6.2 Сучасна екологічна ситуація
3.6.1Сучасні масштаби впливу людини на природу
Взаємовідносини суспільства і природи полягають у тому, що фактори економічного зростання — трудові ресурси, засоби виробництва і природні ресурси — у комплексі використовуються суспільством для розвитку виробництва. Питання взаємовідносин суспільства і природи та використання природних ресурсів стають дедалі актуальнішими. І це зрозуміло, бо з розвитком виробництва вилучаються все нові багатства природи, зростає вартість сировини, збільшується кількість відходів, що викидаються у навколишнє середовище. Однак, і це очевидно, було б неправильно вирішувати проблеми збереження ресурсів і середовища шляхом припинення росту або навіть скорочення обсягів виробництва. Такі припущення суперечать закономірностям розвитку людського суспільства і практично нездійсненні.
Взаємодія людини з природою у процесі виробництва та споживання для забезпечення існування людства загалом є об'єктивним явищем
Отже, постають дві взаємопов'язані проблеми: перша — вплив обмеженості природних ресурсів на їх використання і розвиток суспільного виробництва, зростаюче забруднення середовища; друга — необхідність розробки комплексу заходів щодо ліквідації цієї небезпеки для подальшого розвитку суспільства.
Природокористування має загальний характер, оскільки будь-який вид діяльності людей викликає зміни природного середовища. Ускладнення взаємозв'язків у природних, виробничих і соціальних системах, зростання пріоритету природогосподарських зв'язків викликають необхідність їх регулювання. Природне середовище — невід'ємна умова життя людини і суспільного виробництва, оскільки воно є необхідним середовищем існування людини і джерелом потрібних йому ресурсів.
Природа в широкому розумінні — це весь світ у 'багатогранності його форм, тобто в цьому плані людина є частиною природи, у вужчому розумінні — сукупність натуральних умов існування людського суспільства. Під впливом людини відбуваються величезні зміни природного середовища, з чим пов'язана необхідність його охорони. В XX ст. людина проклала нові шляхи переміщення енергії і речовини в географічній оболонці, подекуди значною мірою порушивши екологічну рівновагу.
Величезні масштаби змін, що їх вносить сучасна людина в природні умови на Землі, передбачив ще на початку сторіччя видатний учений В.І. Вернадський. Справді, в природі денудація (руйнування) гранітних скель відбувається зі швидкістю 1 м за 6 тис. років, а людина з допомогою спрямованих вибухів і сучасної Техніки змінює рельєф, миттєво. Тільки за один рік людина при оранці полів, будівельних і гірничих роботах переміщує понад 4 тис. км3 грунту, видобуває з надр Землі близько 100 млрд т руди, забирає на господарсько-побутові потреби 13% річного стоку, спалює 8,5 млрд т умовного палива, виплавляє 800 мли т різних металів, виробляє близько 60 мли т невідомих) у природі синтетичних матеріалів, розкидає на полях понад 500 млн т добрив і 3 млн т різних пестицидів, з яких 1/3 змивається дощами в водойми і затримується в атмосфері.
Щорічно з надр Землі добувається більше елементів, ніж включається в біологічний кругообіг: кадмію — в 160 разів, ртуті — 110, свинцю — 35, миш'яку, фтору — 15, урану — 6, олова — 5, міді — 4, молібдену — в З рази.
За 10 тис. років до неоліту, коли почали розвиватись екстенсивне тваринництво і підсічно-вогнева система землеробства, людство скоротило площу лісів удвічі, причому особливо бурхливо цей процес відбувався в останні 200 років. Освоєні людиною землі (промислові, сільськогосподарські, лісозаготівельні, транспортні підприємства, гірничі розробки тощо) становлять 60% поверхні суші. Дефіцит земельних угідь і скорочення площі лісів призвели до того, що запаси фітомаси за історичний період (особливо за останні століття) знизились більш ніж на одну чверть.
Глибокі зміни природного середовища під впливом господарської діяльності порушують рівновагу, що склалася за тривалий період його природного розвитку. В багатьох регіонах земної кулі подібні зміни призвели до забруднення середовища, зникнення багатьох видів рослин і тварин, виникнення антропогенних «бедлендів» тощо.
Людство протягом усієї своєї історії неодноразово вступало в протиборство з силами природи, що спричиняло кризові ситуації. Найтиповішими в минулому були продовольчі кризи.
Перші обмеження в ресурсах виникли з настанням льодовикового періоду і похолодання. Погіршення умов життя на півночі і в горах викликало міграцію людей в південніші -райони і передгір'я. В цих найсприятливіших для людини районах щільність населення зросла настільки, що за існуючого тоді рівня розвитку продуктивних сил це призвело, до відносного перенаселення. Зникнення великих стадних тварин — основного об'єкта мисливства, викликало нестачу продуктів харчування і стимулювало вдосконалення способів мисливства, що ще більше прискорило виснаження тваринних ресурсів. Виникла так звана криза мисливського господарства, вихід з 'якої було знайдено в переході від привласнювальної форми господарювання до виробничих форм (від мисливства і збиральства до скотарства і землеробства).
Протягом тривалої і складної історії розвитку людського суспільства в різних районах земної кулі кризові ситуації виникали ще неї раз, але люди знаходили з них вихід, розробляючи нові способи виробництва, нові методи використання енергії, освоюючи нові види природних ресурсів.
3.6.2 Сучасна екологічна ситуація
Сучасна екологічна ситуація є досить унікальна, оскільки значно зросла інтенсивність і) змінилась сама суть впливу людини на природне середовище. З 1950 p. населення планети подвоїлось. Років через сорок воно зможе подвоїтись ще раз і досягне 9—10. млрд. Це потягне за собою низку проблем, уникнути яких неможливо. Вже сьогодні зростання виробництва продуктів харчування на Землі зупинилося. За тридцять років (з 50-х років) «зелена революція» в два з половиною рази збільшила виробництво зерна. Але подальшого (з 1984 p.) приросту нема. Добрива і селекція себе вичерпали. В США зменшуються і збори кукурудзи та інших зернових. Припинився ріст урожаїв у Японії та в Китаї. Країни — колишні республіки СРСР продовжують безпрецедентні закупки зерна. Кардинально нових технологій для збільшення виробництва зернових культур наука не бачить.
Головний фундамент життя — грунти — всюди на Землі деградують, зменшуються за площею. Не менш драматична ситуація з водою. В засушливих зонах води не вистачає так само, як і хліба. Швидкими темпами винищуються ліси. Наприклад, тропічні ліси зменшуються щосекунди на площу футбольного майданчика. За таких темпів у Південній Америці та Африці цих лісів не залишиться вже через 40—50 років. Знищення лісів призводить до ерозії грунтів, планетарних змін клімату, патологічних змін в рослинному і тваринному світі. Якщо на початку століття зникав один вид тварин за рік, то зараз один вид тварин зникає. щоденно. І цей процес прискорюється. В Європі під загрозою зникнення перебувають дві третини птахів, третина метеликів, більше половини рептилій та земноводних. Залишитися на Землі лише з воронами, горобцями і тарганами — перспектива далеко не радісна. Втративши сусідство з розмаїттям форм життя, людина багато чого втратить у собі самій, настане неминуча дегуманізація.
Контрольні запитання:
1.Вплив обмеженості природних ресурсів на їх використання і розвиток суспільного виробництва
2.Необхідність розробки комплексу заходів щодо ліквідації цієї небезпеки для подальшого розвитку суспільства.
Лекція 11 (заняття 17)
Тема 4.1 Органічні речовини в живій природі. Теорія хімічної будови органічних сполук О.М. Бутлерова. Явище ізомерії.
План:
4.1.1 Органічні речовини в живій природі.
4.1.2 Спільні і відмінні ознаки неорганічних і органічних сполук
4.1.3 Теорія хімічної будови органічних сполук О.М. Бутлерова
4.1.4 Явище ізомерії.
4.1.1 Органічні речовини в живій природі
Органічні речовини (рос. вещества органические, англ. organic matter; нім. organische Stoffe m pl) – речовини, що виникли прямо або непрямо з живої речовини або продуктів їх життєдіяльності; присутні в атмосфері, поверхневих і підземних водах, осадах, ґрунтах і гірських породах. Складаються із органічних сполук.
Органічні речовини в корисних копалинах
Природні органічні речовини знаходяться в твердому (вугілля, сланці, тверді бітуми), рідкому (нафта, рідкі бітуми) і газоподібному (пароподібному) стані (газ і газоконденсат). Концентрація розсіяної органічної речовини в гірських породах звичайно не перевищує 1-5 мас. %, концентрованої органічної речовини в каустобіолітах – у вугіллі 50-99 мас.%, вуглистих і горючих сланцях 20-50 мас.%; нафті й газоконденсатних скупченнях 5-8 мас.% (відносно маси породи-колектора). У гірських породах вміст органічної речовини складає (субкларки): в глинистих 0,9%, алевритистих 0,45%, карбонатних і піщаних породах 0,2%; в атмосфері і гідросфері до 0,1%. органічної речовини.
Сполуки, що утворені Карбоном, називаються органічними сполуками. Нині відомо понад 10 млн органічних сполук. Неорганічних речовин відомо лише близько 200 тис.
Атоми Карбону здатні сполучатися між собою, утворюючи молекули різноманітної форми: лінійні, розгалужені, короткі, довгі, ланцюги, кільця.
 | |||||
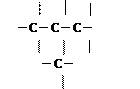 | |||||
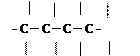 | |||||
1) 2) 3) 4)
|
В органічних сполуках крім Карбону містяться атоми Нітрогену, Оксигену, Гідрогену, галогенів, Сульфуру, Фосфору та ін.
4.1.2 Спільні і відмінні ознаки неорганічних і органічних сполук
| Неорганічні речовини - Валентність більшості елементів у неорганічних сполуках^ змінна (Сульфур, Фосфор, Нітроген мають різну валентність). - У неорганічних сполуках найрізноманітніші види хімічних зв'язків - іонний, ковалентний, металічний, водневий. - Неорганічні речовини в основному тугоплавкі, стійкі до нагрівання. - Використовуються в основному водні розчини (при хімічних реакціях). - Реагуючи, утворюють осад, гази, змінюють забарвлення. | Органічні сполуки - Якісний склац обмежений, кількісний значно багатший. - Елементи органічних сполук виявляють значно менше валентних станів. Карбон, Гідроген, Оксиген мають сталі валентності. - Переважно утворюють ковалентні зв'язки, іноді іонні. - Кристалічні ґратки молекулярні. Легкоплавкі, часто мають запах. - Згоряють з утворенням води і вуглекислого газу. - Здебільшого не розчиняються у воді. - Реагують між собою повільно. |
Спільні ознаки
Утворення і реакції органічних речовин відбуваються за тими самими законами, що й неорганічних речовин. Серед органічних сполук є розчинні у воді, електроліти (солі органічних кислот), є термостійкі. Органічні та неорганічні речовини об'єднує і те, що вони можуть взаємно перетворюватися.

 Органічні речовини
Органічні речовини
| |||
| |||
4.1.3 Теорія хімічної будови органічних сполук О.М. Бутлерова
На прикладі ізомерії виявляється взаємозв’язок між будовою та властивостями органічних сполук. Цей взаємозв’язок пояснює теорія хімічної будови органічних речовин, автором якої є російській вчений О.М. Бутлеров.
О.М. Бутлеров сформулював основні ідеї теорії будови органічних речовин у вигляді таких положень:
1. Атоми в молекулі розміщуються не безладно, а в певному порядку згідно з їхньою валентністю. Кожна речовина має властиву лише їй послідовність сполучення атомів в молекулі, тобто хімічну будову, що відображається структурною формулою.
СН4 С3Н8 С4Н10
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 663; Нарушение авторских прав?; Мы поможем в написании вашей работы!