
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Просторова будова молекул органічних сполук
|
|
|
|
Утворення зв'язків у сполуках Карбону. Збудження атома Карбону. Електронна конфігурація основного стану атома Карбону 1s22s22px2pу:, в якому тільки два неспарені електрони (на 2рх- і 2 р у-орбіталях) можуть брати участь в утворенні зв'язків з іншими атомами. Однак такий висновок суперечить експериментальним даним, згідно з якими в переважній більшості сполук Карбон є чотиривалентним, наприклад метан СН4.
Це можливо під час розпаровування електронної пари 2s2 і переходу одного з цих електронів на вакантну 2рz-орбіталь. Унаслідок цього атом Карбону переходить у стан із підвищеною енергією, збуджений стан 1s22s12p1x 2p1y2p1z. У цьому разі він має чотири неспарені електрони замість
двох і здатний утворити зв'язки вже не з двома, а з чотирма іншими атомами або групами. Енергія, яка виділяється під час утворення двох додаткових зв'язків, значно перевищує енергію (406 кДж∙моль-1), що необхідна для розпаровування двох 2s2-електронів і переходу 2s → 2р.
ПРОСТІ ЗВ'ЯЗКИ
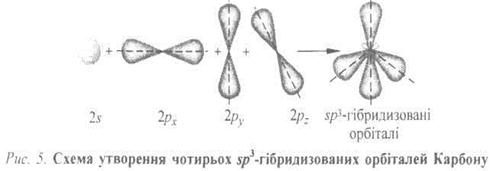
sp3-Гібридизація. У збудженому стані атом Карбону має чотири неспарені електрони 2s]2p1х 2p1y2p1z, однак у разі сполучення з чотирма іншими атомами не використовуються одна 2s-орбіталь і три 2р-орбіталі, оскільки це зумовило б утворення трьох взаємноперпендикулярних зв'язків (за рахунок трьох 2р-орбіталей) і одного зв'язку, відмінного від них, який не має напрямленості (за рахунок сферично симетричної 2s -орбіталі). Насправді, чотири С—Н зв'язки, наприклад у метані, рівноцінні й розміщені симетрично (тетраедрично) під кутом 109°28' один відносно одного. Це пояснюється тим, що одна 2s- і три 2р-орбіталі об'єднуються так, щоб утворити чотири нові (ідентичні) орбіталі, спроможні дати міцніші зв'язки (рис. 1).
Розглянемо результати математичних розрахунків різних комбінацій s- і р-орбіталей.
1. «Краща» гібридизована орбіталь має сильніше виражену напрямле-ність, ніж s- або р-орбіталь (чим більше атомна орбіталь сконцентрована унапрямку зв'язку, тим більший ступінь перекривання і тим міцніший зв'язок, який вона може утворити). Така гібридизована орбіталь має форму витягнутої вісімки.
2. Чотири «кращі» орбіталі точно еквівалентні одна одній.
3. Ці орбіталі напрямлені до вершин тетраедра — такого розміщення, коли орбіталі максимально віддалені одна від одної (заборона Паулі). Кут між двома орбіталями тетраедричний і дорівнює 109°28' (див. рис 2)
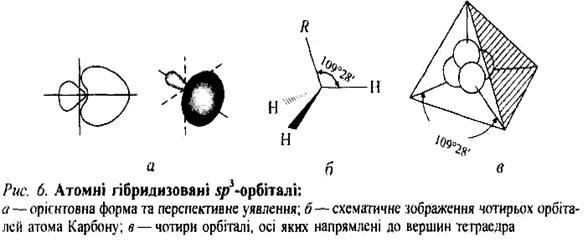
Такі нові орбіталі називаються sр3-гібридизованими атомними орбіталями, оскільки вони виникають унаслідок комбінації однієї s- і трьох р -орбіталей, а процес їх утворення називається гібридизацією.
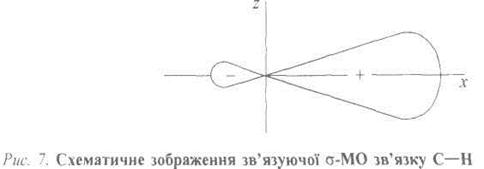
Утворення молекулярних орбіталей (МО). Структура молекули метану зумовлена перекриванням чотирьох sр3-AO атома Карбону з ls-AO чотирьох атомів Гідрогену. Утворюються чотири зв'язуючі σ-МО (рис. 3), які заповнені вісьмома електронами, і чотири вакантні антизв'язуючі σ*-МО.
Для максимального перекривання чотири гідрогенові ядра повинні перебувати на осях sр3-AO, тобто у вершинах тетраедра (рис. 4). Експеримен-
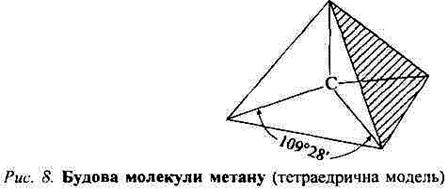
тальні дані підтверджують обчислення: метан має тетраедричну будову, довжина всіх зв'язків С—Н однакова — 0,109 нм, кут між двома будь-якими зв'язками дорівнює 109°28'. Для розривання одного із зв'язків метану потрібно затратити 417,05 кДж∙моль-1 енергії. Саме на цьому грунтувалася
теоретична основа тетраедричної моделі атома Карбону, запропонована Я. Вант-Гоффом і Ж. Ле Белем на основі експериментальних даних.
Отже, ковалентні зв'язки характеризуються не тільки довжиною зв'язку та енергією, а й кутом між зв'язками.
ПОДВІЙНІ КАРБОН-КАРБОНОВІ ЗВ'ЯЗКИ
Ненасичені сполуки можуть містити один або кілька подвійних зв'язків, у цьому разі їх відносне розміщення має принципове значення. Якщо між подвійними зв'язками міститься хоч один sр3-гібридизований атом Карбону, то такі системи називаються ізольованими подвійними зв'язками, якщо два атоми Карбону, від кожного з яких виходять подвійні зв'язки, сполучені простим δ-зв'язком, то кажуть про кон'юговані подвійні зв'язки або кон'юговану систему. Якщо два подвійні зв'язки виходять від одного атома Карбону, то такі зв'язки називаються кумульованими подвійними зв'язками:

Ізольовані подвійні зв'язки. Розглянемо ізольований подвійний зв'язок на прикладі молекули етену (етилену) СН2 = СН2. Як і для молекули метану, побудову молекулярних орбіталей МО (орбіталі зв'язку) можна розбити на три стадії: збудження атома Карбону; sр2 - гібридизація двох атомів Карбону; утворення молекулярних орбіталей.

|
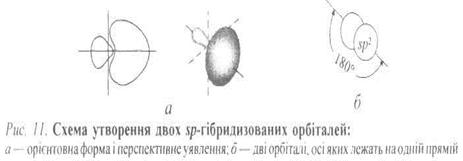
s p2--Гібридизація двох атомів Карбону. Коли Карбон сполучається з трьома іншими атомами, він не використовує для зв'язку свої три р-орбіталі. Міцніші σ-зв'язки можуть дати три sр2-гібридизовані орбіталі, які утворюються внаслідок комбінації однієї 2s - і двох 2р-орбіталей. Ці sр2-гі-бридизовані орбіталі мають більшу просторову напрямленість, ніж будь-які 2s - або 2р-орбіталі й унаслідок сильнішого перекривання такі гібридизовані орбіталі утворюють міцніші зв'язки. Вони еквівалентні одна одній, sр2-Гібридизовані орбіталі розміщені в площині перебування ядра атома Карбону і напрямлені до кутів правильного трикутника; кут між кожною парою sр2 -орбіталей становить 120° (рис. 5). У разі такого тригонального розміщення гібридизовані орбіталі максимально віддалені одна від одної.
Утворення молекулярних орбіталей. Під час утворення молекули етену (етилену) дві sр2 -орбіталі кожного атома Карбону перекриваються з 1s-орбі-талями двох атомів Гідрогену, утворюючи міцні σ-зв'язки С—Н, тоді як треті sр2-орбіталі кожного атома Карбону перекриваються одна з одною з утворенням міцного σ-зв'язку С—С. Виникають п'ять зв'язуючих σ-МО і п'ять антизв'язуючих σ*-МО.
Скелет σ-зв'язків розміщується в одній площині, кожен атом Карбону перебуває в центрі трикутника, в кутах якого розміщені два атоми Гідрогену та другий атом Карбону. Кожен кут між зв'язками дорівнює 120°.
У кожного атома Карбону залишається одна негібридизована 2рz;-орбі-таль, перпендикулярна до площини розміщення атомів Карбону і Гідрогену. Коли ці дві орбіталі стають паралельними одна одній, вони перекриваються своїми боками (бічне перекривання), причому максимум перекривання спостерігається поза лінією, яка сполучає атомні ядра. Це π-перекривання, що дає також зв'язуючу π-МО та антизв'язуючу π*-МО (рис. 6).
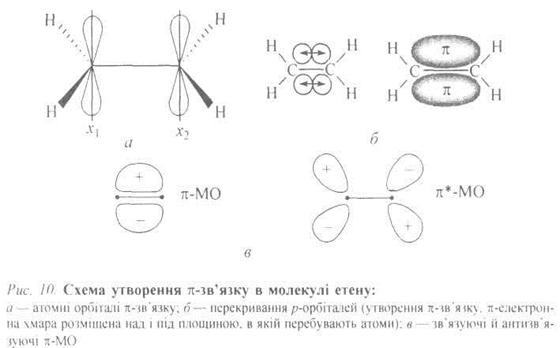
У зв'язуючій π-МО наявна вузлова площина, яка збігається з площиною скелета σ-зв'язків. Така орбіталь розміщується над і під площиною молекули, в якій перебувають два атоми Карбону і чотири атоми Гідрогену. Порівняно з σ-МО, в якій немає такої вузлової площини, енергія π-МО вища, ніж енергія σ-МО (енергія МО зростає зі збільшенням вузлових площин).
Антизв'язуюча π*-МО має, крім того, ще одну додаткову вузлову площину, перпендикулярну до осі х, що зумовлює збільшення енергії π*-МО. Енергетичні рівні основного стану етену (етилену) можна подати так:
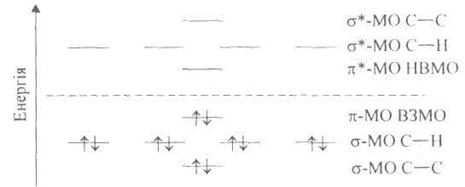
Зв'язуюча π-MO є вищою зайнятою МО (ВЗМО), а протилежна їй анти-зв'язуюча π*-МО — нижчою вільною MO (HBMO).
Бічне перекривання атомних орбіталей, що зумовлює утворення π-зв'язку, менш ефективне, ніж перекривання вздовж головної осі, яке зумовлює утворення σ-зв'язків, ось чому π-зв'язки менш стійкі, ніж σ-зв'язки. Це виявляється в тому, що енергія подвійного карбон-карбонового зв'язку перевищує енергію простого зв'язку менше ніж у два рази. Так, енергія зв'язку С—С в етані дорівнює 347 кДж∙моль-1, а енергія зв'язку С = С в етені (етилені) становить тільки 598 кДж∙моль-1.
π-Зв'язок зближує атоми Карбону: довжина зв'язку С = С в етені (етилені) 0,133 нм, зв'язку С—С в етані — 0,154 нм.
Ступінь бічного перекривання двох атомних 2р-орбіталей, а отже, й міцність π-зв'язку максимальна, коли два атоми Карбону і чотири атоми Гідрогену розміщені точно в одній площині, тобто якшо вони компланарні, оскільки тільки в цьому випадку атомні 2р-орбіталі паралельні одна одній і тому здатні до максимального перекривання. Будь-яке відхилення від ком-планарного стану внаслідок обертання навколо σ-зв'язку, що сполучає два атоми Карбону, призведе до зменшення ступеня перекривання і відповідно до зниження стійкості π-зв'язку. Отже, π-зв'язок сприяє збереженню площинності молекули. У цьому полягає теоретичне пояснення такого явища, як обмежене обертання навколо подвійного зв'язку.
Розподіл π-електронів над і під площиною молекули, тобто за межами осі карбон-карбонового зв'язку, означає існування області негативного заряду, яка здатна до взаємодії з електронодефіцитними реагентами.
|
Потрійний карбон-карбоновий зв'язок. У разі сполучення атома Карбону з двома іншими атомами він утворює міцні σ-зв'язки за рахунок двох sp-гібридизованих орбіталей, що виникають унаслідок гібридизації 2s-opбiталі та тільки однієї з трьох атомних 2р-орбіталей Карбону (рис. 7).
Такі sp-гібридизовані орбіталі розміщені на одній прямій, кут між двома орбіталями становить 180°. У разі такого лінійного розміщення гібридизовані орбіталі максимально віддалені одна від одної. Так, під час утворення молекули етину (ацетилену) sp-гібридизовані орбіталі використовуються для утворення міцних σ-зв'язків кожного атома Карбону з одним атомом Гідрогену і між атомами Карбону, внаслідок чого утворюється лінійна молекула, в якій кожний із двох атомів Карбону має по дві негібридизовані атомні 2р-орбіталі, розміщені під прямим кутом одна відносно одної. Атомні орбіталі одного атома Карбону паралельні відповідним орбіталям другого атома Карбону, отже, можуть попарно перекриватися, що зумовлює утворення двох π-зв'язків, розміщених у взаємно перпендикулярних площинах (рис. 8). Дві хмари π-зв'язків зливаються, утворюючи єдину циліндричну π-електронну хмару навколо лінії, що сполучає ядра (рис. 8, б).
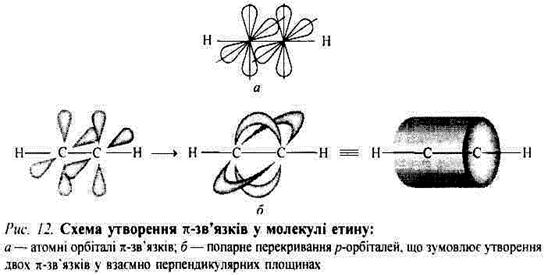
Отже, молекула етину (ацетилену) наче міститься всередині циліндра з негативного заряду. Енергія зв'язку С = С становить 812 кДж∙моль-1, тобто внесок третього зв'язку ще менший, ніж внесок другого під час переходу від простого зв'язку до подвійного. Довжина зв'язку С = С дорівнює 0,121 нм; відстань між атомами Карбону в молекулі етину (ацетилену) ще менша, ніж у молекулі етену (етилену).
Спектральні дослідження показали, що відстань С—Н у молекулі етану дорівнює 0,1102 нм, С—Н етену — 0,1086, С—Н етину — 0,106 нм.
Зв'язки Карбон—Гідроген в етані, етені, етині є простими зв'язками, але в етані вони утворюються внаслідок перекривання sp3-AO, в етені —, sр 2-AO, в етині — sp-AO. Порівняно з sp3-AO sp2 -орбіталі властиві менший р- і більший s-характер. р-Орбіталь знаходиться на певній відстані від ядра, s-орбіталь розміщена ближче до ядра. У разі збільшення s-характеру гібридизованої орбіталі її ефективний розмір зменшується й одночасно зменшується довжина зв'язку С—Н під час переходів
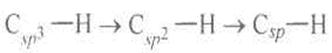
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 3588; Нарушение авторских прав?; Мы поможем в написании вашей работы!