
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приєднання галогенів
|
|
|
|
Хімічні властивості
Фізичні властивості
Способи добування.
1. З нафти.
2. 
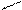 Дією цинку на дигалогенпохідні: СН2
Дією цинку на дигалогенпохідні: СН2
 Вr – СН2 – СН2 ─ СН2 – Вr + Zn → ZnВr2 + СН2 СН2
Вr – СН2 – СН2 ─ СН2 – Вr + Zn → ZnВr2 + СН2 СН2
1,3-дибромпропан циклопропан
Перші два представники – циклопропан і циклобутан – гази, наступні три – рідини, вищі – тверді речовини. Так само, як і алкани, циклопарафіни не
розчиняються у воді, горять, виділяючи значну кількість теплоти,
тому їх використовують як горючі матеріали.
Із будови циклопарафінів видно, що атоми Карбону повністю
використали свою валентність. Тому за хімічними властивостями вони
близькі до сполук ряду метану, тобто є хімічно малоактивними
речовинами. З галогенами насичені циклічні вуглеводні вступають у
реакцію заміщення, яка характерна для стійкіших п'яти- і
шестичленних циклів:
Н2С – СН2 + Вr2 → Н2С – СН2 + НВr
׀ ׀ ׀ ׀
Н2С – СН2 Н2С – СН – Вr
Ця реакція може проходити і з розривом циклу:
Н2С – СН2 + Вr2 → Вr ─ СН2 – СН2 – СН2 – СН2 ─ Вr
׀ ׀
Н2С – СН2
2. Приєднання водню, як правило, відбувається при високих температурах і в присутності каталізатору:
Н2С – СН2 + Н2 → СН3 – СН2 – СН2 – СН3
׀ ׀
Н2С – СН2
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 639; Нарушение авторских прав?; Мы поможем в написании вашей работы!