
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поняття про належну лабораторну практику
|
|
|
|
Штат.
§ завідувач складом (провізор);
§ завідувачі відділами (провізори або фармацевти);
§ заступники завідуючих відділами;
§ провізори;
§ фармацевти;
§ фасувальники;
§ санітарки-мийниці;
§ експедитори;
§ робітники;
§ пакувальники.
3.7.Організаційна структура аптечного складу. Відділи складу.
В залежності від обсягів роботи та груп лікарських засобів організаційна структура складів може бути різною. На схемі 1 поданий приклад організаційної структури суб’єкта господарювання, який займається оптовою реалізацією ліків.
Відділ маркетингу - це функціональний підрозділ суб’єкта господарювання, який займається дослідженням фармацевтичного ринку в регіонах обслуговування фірми, розробкою і плануванням товарного асортименту, рекламою і стимулюванням збуту. Він вирішує задачі, що закупити, скільки закупити і чим зацікавити можливого покупця.
Відділ постачання здійснює пошук та аналіз комерційних пропозицій можливих постачальників, укладання угод, контроль їх виконання, організацію доставки закуплених лікарських засобів і виробів медичного призначення, оцінку результатів співпраці з постачальниками. Іншими словами, ним вирішуються задачі, в кого, на яких умовах і коли закупити.
Відділ збуту (торговий відділ) проводить пошук і забезпечення можливих покупців комерційними пропозиціями, укладання угод, документальне оформлення і поставку товару покупцеві, контроль за виконанням ним договірних зобов’язань, оцінку результатів співпраці з постачальниками. Отже, зазначеним функціональним підрозділом реалізуються задачі, кому, скільки і на яких умовах реалізувати товар.
Транспортний відділ здійснює доставку товару від постачальників і відправку його покупцям.
Фінансовий відділ займається управлінням і раціоналізацією фінансових потоків фармацевтичного підприємства на всіх етапах руху грошових засобів.
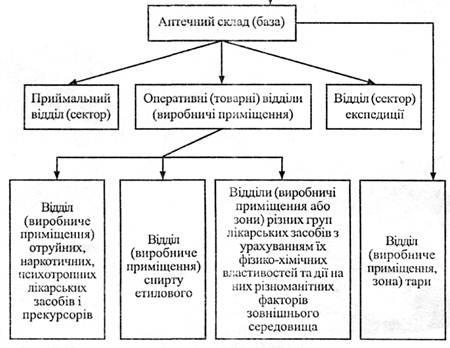
|
Схема 1. Приклад організаційної структури суб’єкта господарювання, який здійснює оптову реалізацію ліків.
3.8. Приймальний відділ його завдання та функції.
Приймальний відділ - структурний підрозділ аптечного складу, який здійснює приймання товару від постачальників, оперативний контроль за його надходженням, розшук своєчасно не отриманих вантажів, документальне оформлення і передачу прийнятого товару в оперативні (товарні) відділи складу.
У відповідності з особливими умовами поставки медичної продукції, якщо інше не зазначено в угоді, лікарські засоби аптечному складу (базі) повинні відпускатися з залишковим терміном придатності не менше 80 %, а бактерійні препарати - не менше 60 %.
3.9. Приймання товару за кількістю, якістю і вартістю.
Здійснює приймальна комісія, головою комісії якої призначається завідувач приймального відділу або його заступник (він же - уповноважена особа з вхідного контролю якості ліків), а членами комісії - завідуючі відповідними оперативними відділами. У кожному аптечному складі (базі) повинна бути призначена Уповноважена особа, яка повинна особисто виконувати свої обов’язки, мати вищу фармацевтичну освіту та стаж роботи за спеціальністю не менше двох років.
Її прізвище, контактний телефон та форму зв’язку (телефон, факс, електронна пошта) слід повідомляти територіальній державній службі з лікарських засобів.
Обов’язки уповноваженої особи аптечного складу (бази) з вхідного контролю якості лікарських засобів
§ перевірка лікарських засобів, які надходять на аптечний склад (базу), і супровідних документів – накладних (з обов’язковим зазначенням назви, дозування, лікарської форми, номера серії, кількості, найменування виробника), висновків якості виробників, відомостей про державну реєстрацію лікарського засобу;
§ оформлення висновку вхідного контролю якості лікарських засобів;
§ ведення реєстру лікарських засобів, які надійшли до суб'єкта господарської діяльності, щоб мати змогу відстежити джерело одержання кожної неякісної або фальсифікованої партії лікарських засобів;
§ ведення реєстру лікарських засобів, які реалізуються аптечним
складом (базою), щоб мати змогу відкликати партії неякісних або фальсифікованих лікарських засобів;
§ перевірка наявності на складі неякісних та фальсифікованих серій лікарських засобів згідно з інформацією територіальної державної служби з лікарських засобів;
§ надання територіальній державній службі з лікарських засобів відомостей про виявлені неякісні та фальсифіковані лікарські засоби або про які є підозра щодо їх якості; призупинення відпуску та поміщення в карантин таких лікарських засобів.
Методика вхідного контролю на аптечному складі (базі)
Вхідний контроль якості лікарських засобів полягає в тому, що:
1.Закуповувати і одержувати лікарські засоби слід тільки у суб’єктів, які мають чинні ліцензії на право оптової торгівлі або виробництва лікарських засобів. Копії таких ліцензій повинні зберігатися в уповноваженої особи.
2.Одержані лікарські засоби повинні пройти візуальний контроль уповноваженою особою, позитивний письмовий висновок якої є дозволом для
реалізації цих лікарських засобів.
3.Уповноважена особа перевіряє відповідність одержаних лікарських засобів супровідним документам щодо кількості, дозування, номерів серій, термінів придатності, реєстраційного статусу, назви лікарської форми, виробника. Кожна серія лікарських засобів повинна супроводжуватися сертифікатомякості, що видається виробником. Лікарські засоби, що підлягають обов'язковій лабораторній перевірці повинні додатково супроводжуватися сертифікатом аналізу, що виданні лабораторією, яка підпорядкована або уповноважена територіальною державною службою з лікарських засобів.
4.Групова тара, зовнішня (вторинна) та внутрішня (первинна) упаковки, маркіровка, листок-вкладка, зовнішній вигляд без розкриття упаковки перевіряються на цілісність, однорідність, наявність пошкоджень,
якість пакувальних матеріалів. При потребі, якщо виникла підозра щодо
якості, лікарські засоби перевіряються з розкриттям упаковок стосовно
розмірів, форми, кольору, однорідності, кількості одиниць в упаковці, наявності забруднень.
5.При позитивному результаті вхідного контролю уповноважена особа передає партії лікарських засобів на реалізацію.
6.При негативному результаті уповноважена особа складає акт про
виявлені дефекти, який є підставою для повернення серії постачальнику.
Копія акта подається у територіальну державну службу з лікарських засобів, яка після проведення додаткової перевірки та вибіркового аналізу вживає заходів щодо інформування інших суб’єктів про виявлені неякісні або фальсифіковані лікарські засоби та контролює дії постачальника щодо їх знищення, утилізації або повернення (у разі неякісних серій) виробнику.
7.У випадку виникнення сумніву щодо якості лікарських засобів уповноважена особа відбирає зразки сумнівних лікарських засобів та направ-
ляє їх у територіальну державну службу з лікарських засобів для проходження лабораторних досліджень. На час проведення таких досліджень, до остаточного вирішення питання про їх якість, партія сумнівних лікарських засобів перебуває у карантині, ізольовано від інших лікарських засобів, з позначенням «Торгівля заборонена до окремого розпорядження».
Перелік ліків, які підлягають обов’язковій лабораторній перевірці:
§ субстанції, що використовуються в аптеках для виготовлення парентеральних лікарських форм і ліків, що застосовуються в очній практиці (за всіма параметрами аналітико-нормативної документації- АНД);
§ наркотичні засоби, психотропні речовини і прекурсори, які підлягають спеціальному контролю згідно з чинним законодавством;
§ лікарські засоби, що використовуються для наркозу, зокрема, інгаляційного (за винятком кисню і закису азоту);
§ рентгенконтрастні засоби, у т. ч. барію сульфат;
§ протитуберкульозні препарати (зокрема, комбіновані), що містять рифампіцин, ізоніазид, етамбутол, піразинамід.
3.10. Особливі випадки приймання товару.
Регламентує наказ МОЗ України від 21.01.2010 р. № 11 «Порядок обігу наркотичних засобів, психотропних речовин та прекурсорів у закладах охорони здоров’я України».
Діяльність, пов’язана з обігом наркотичних засобів, психотропних речовин та прекурсорів, здійснюється аптечними складами (базами) на підставі ліцензії.
На аптечних складах(базах) наказом керівника даного закладу має бути створена комісія не менше 3 -х осіб (з можливістю дублювання її членів) для приймання, обліку та знищення наркотичних засобів, психотропних речовин та прекурсорів. Голова комісії керівник аптечного складу(бази) або його заступник. Комісія аптечного складу(бази) повинна здійснювати суцільні перевірки всіх наркотичних засобів, психотропних речовин та прекурсорів, що надійшли від постачальників, на відповідність їхніх найменувань, якості, кількості, ваги, зазначених у супровідних документах постачальників.
Результати цих перевірок оформляються у момент приймання наркотичних засобів, психотропних речовин та прекурсорів на аптечному складі(базі) Актом про приймання наркотичних засобів, психотропних речовин та прекурсорів.
3.11.Організація праці оперативних відділів складу.
Оперативні відділи призначені для зберігання різних груп товарів. На
аптечному складі (базі), як правило, виділяються такі оперативні відділи: наркотичних, психотропних ЛЗ та прекурсорів; готових лікарських засобів; ін'єкційних препаратів; бактерійних препаратів і кровозамінників; сипучих ЛЗ; галенових препаратів; антибіотиків та вітамінів; відділ зберігання вогне- та вибухонебезпечних ЛЗ; перев'язувальних засобів; предметів догляду за хворими та ін.
ЛЗ та ВМП зберігаються в оперативних відділах у відповідності з їх фізико-хімічними властивостями і діючими правилами (наказ МОЗ України
від 16.03.1993 р. № 44). Приміщення відділів повинні відповідати обсягам
роботи і всім вимогам, що забезпечують збереження відповідних груп товарно-матеріальних цінностей: наявність вентиляції, охоронно-пожежної сигналізації, дотримання необхідного температурного режиму, освітлення тощо.
Для контролю за температурою та вологістю в складських приміщеннях повинні бути встановлені термометри та гігрометри.
Товари у відділах розміщуються на стелажах за найменуваннями, серіями та термінами придатності.
3.12.Порядок зберігання товару на складі, контроль за термінами зберігання медичних товарів.
Для систематичного контролю за строками зберігання медичних товарів у відділах зберігання на кожну партію медичних товарів ведеться стелажна картка (Ф АП-73) в якій вказується: найменування товару, одиниця вимірювання, кількість, серія, номер аналізу, строк придатності.
2. Поводження із зіпсованими фармацевтичними товарами.
Ліцензіат повинен мати план термінових дій для зупинення торгівлі неякісними та фальсифікованими лікарськими засобами, вилучення у разі потреби лікарських засобів з продажу та вжиття відповідних заходів щодо повернення зазначених лікарських засобів постачальнику (виробнику) або їх знищення (утилізації).
Ліцензіат зобов’язаний вилучити з реалізації, відповідно ідентифікувати та розмістити в чітко визначених та промаркованих місцях (карантинних зонах) такі лікарські засоби: неякісні лікарські засоби, лікарські засоби, термін придатності яких минув, заборонені до реалізації в установленому законодавством порядку, лікарські засоби з ушкодженими закупорювальними елементами або пакуваннями, лікарські засоби, щодо яких існують припущення, що вони є неякісні, повернені лікарські засоби, підроблені (фальсифіковані) лікарські засоби, незареєстровані лікарські засоби, які підлягають реєстрації.
Лікарські засоби, термін придатності яких скінчився, не можна ні продавати, ні постачати; їх необхідно зберігати окремо від придатного до реалізації запасу до утилізації або знищення.
3.13.Запобіжні заходи з охорони праці під час зберігання і роботи з вибуховими, вибухонебезпечними, легкозаймистими та горючими товарно-матеріальними цінностями.
В медичній практиці широко використовуються лікарські засоби та медичні вироби, які належать до горючих речовин. Горючі речовини умовно поділяють на вогненебезпечні та вибухонебезпечні.
Вогненебезпечні речовини поділяються на:
1. Легкозаймисті:
§ спирт та спиртові розчини;
§ спиртові та ефірні настоянки;
§ спиртові та ефірні екстракти;
§ ефір;
§ скипидар;
§ молочна кислота;
§ хлоретил;
§ колодій;
§ креол;
§ рідина Новікова;
§ органічні масла;
§ рентгенівські плівки.
2. Легкогорючі:
§ перев’язувальні засоби (вата, марля тощо);
§ сірка;
§ гліцерин;
§ олії;
§ лікарська рослинна сировина.
До вибухонебезпечних речовин належать:
Вибухові:
§ нітрогліцерин.
Вибухонебезпечні:
§ перманганат калію;
§ нітрат срібла;
Приміщення аптечних складів (баз) для збереження вогненебезпечних та вибухонебезпечних речовин повинні повністю відповідати будівельним і протипожежним нормам. Вони повинні бути ізольовані, сухі, захищені від попадання прямих сонячних променів. Самі приміщення і коридори, прилеглі до них, повинні бути обладнані припливно-витяжною механічною вентиляцією та системою автоматичного пожежогасіння.
Вогненебезпечні та вибухонебезпечні лікарські засоби слід зберігати за принципом подібності, згідно з їх фізико-хімічними та пожежонебезпечними властивостями, характером упаковки. З цією метою склади розбиваються на окремі приміщення (відсіки), ізольовані одне від одного глухими вогнетривкими перегородками. Підлога складів повинна мати тверде, рівне покриття.
Приміщення для зберігання вогненебезпечних і вибухонебезпечних лікарських засобів повинні бути обладнані вогнетривкими стелажами та піддонами.
На дверях кожного приміщення, де зберігають або працюють з вогненебезпечними та вибухонебезпечними речовинами, повинні бути розташовані незмивні чіткі написи: «Вогненебезпечно» «Вибухонебезпечно», «Паління заборонено», «У випадку пожежі дзвонити 101».
Приміщення повинні оглядатися щоденно з метою проведення профілактичних заходів наприкінці робочого дня.
Особливого поводження вимагають рідкі вогненебезпечні речовини, основною небезпечною властивістю яких є легке випаровування та займання від будь-якого зовнішнього джерела: відкритого вогню, іскри, електричного розряду тощо. Пари більшості легкозаймистих рідин (етилового спирту, колодію скипидару, ефіру та ін.) шкідливо впливають на організм людини і їх тривале вдихання може призвести до непритомності. Тому ємкості з цими речовинами повинні бути щільно закупорені, щоб запобігти випаровуванню, категорично забороняється їх зберігання у відкритій тарі.
Розчин нітрогліцерину — вибухова речовина, яку слід зберігати в аптеках або аптечних складах в невеликих добре закупорених склянках або металевому посуді в прохолодному темному місці. Совати посуд з нітрогліцерином та відважувати препарат слід особливо обережно, бо випаровування речовини загрожує вибухом. Потрапляння навіть незначних кількостей нітрогліцерину на шкіру викликає сильний головний біль.
Перманганат калію вибухонебезпечний при взаємодії з пилом, сіркою, ефірами, спиртом, гліцерином, органічними кислотами та іншими органічними речовинами. Його слід зберігати на складах в спеціальному відсіку в бляшаних барабанах окремо від інших лікарських засобів. Нітрат срібла на аптечних складах в кількості до 5 кг зберігається ізольовано, згідно з правилами зберігання отруйних речовин.
3.14.Особливості зберігання наркотичних, психотропних лікарських засобів та прекурсорів.
Регламентує наказ МОЗ України від 21.01.2010 р. № 11 «Порядок обігу наркотичних засобів, психотропних речовин та прекурсорів у закладах охорони здоров’я України».
На аптечних складах (базах) наркотичні засоби, психотропні речовини та прекурсори повинні зберігатися в окремих приміщеннях. Приміщення, сейфи та металеві шафи, де зберігаються наркотичні засоби, психотропні речовини та прекурсори, після операцій з ними повинні замикатися, а після закінчення робочого дня - опечатуватися чи опломбовуватися і здаватися під охорону.
Ключі від сейфів, металевих шаф і приміщень, де зберігаються наркотичні засоби, психотропні речовини та прекурсори, та пломбіратори повинні зберігатися у осіб, уповноважених наказом керівника аптечного складу (бази). Перелік зазначених осіб, порядок передачі ключів і пломбіраторів від сейфів, металевих шаф і приміщень, де зберігаються згадані вище засоби і речовини, визначаються і затверджуються наказом керівника аптечного складу (бази).
Право доступу в кімнати аптечного складу (бази), де зберігаються наркотичні засоби, психотропні речовини та прекурсори, мають особи, які за наказом керівника аптечного складу (бази) допущені до роботи, пов’язаної з обігом зазначених засобів і речовин. З цим наказом вказані особи повинні бути ознайомлені під особистий підпис.
3.15. Охорона праці при роботі з наркотичними, психотропними, отруйними та сильнодійними засобами.
Аптечний склад (база) повинен отримати ліцензію на придбання, транспортування, зберігання, реалізацію та знешкодження наркотичних засобів, психотропних речовин і прекурсорів.
Згідно з діючим законодавством, для отримання ліцензії на даний вид діяльності заявник зобов’язаний представити висновок територіального наркологічного закладу про відсутність наркологічних захворювань у співробітників установи. Для отримання такого висновку співробітники повинні пройти наркологічний огляд.
Якщо при обстеженні не виявлено наркологічних проблем, оформлюється сертифікат «Про проходження профілактичного наркологічного огляду», який є формою медичного висновку. В подальшому співробітники повинні проходити наркологічне обстеження щорічно в обов’язковому порядку.
Зберігання наркотичних, психотропних, отруйних тасильнодійних лікарських засобів допускається лише в спеціальних матеріальних кімнатах, в сейфах або металевих шафах які прикріплені до підлоги.
На вікнах матеріальних кімнат повинні бути решітки. Матеріальні кімнати і сейфи, в яких зберігаються наркотичні, психотропні лікарські засоби та прекурсори списку №1, повинні бути обладнані світловою та звуковою сигналізацією, яка включається на ніч.
Облік руху товарів у відділах складу.
Облік руху товарів в відділах ведеться на спеціальних карточках складського обліку. Ці карточки зберігаються в картотеці. Щоденно на карточці виводиться залишок даного товару.
3.16. Комплектація замовлень. Експедиційний відділ, його завдання. Оформлення супровідних документів. Відпуск товарів зі складу.
Процес постачання аптек лiкарськими засобами включає наступнi елементи:
§ складання замовлення аптекою;
§ подання замовлення на аптечний склад (базу);
§ коректировка замовлення;
§ комплектацiя товару та доставка в аптеку.
Основою для комплектації товару постачальником аптеці є замовлення на отримання товару. Воно може бути подане різними шляхами: усно безпосередньо у постачальника, телефонограмою, факсом, електронною поштою, письмово на паперовому носії. Корегування замовлених лiкарських засобiв може бути здiйснено тiльки з вiдома замовника.
Після корегування замовлень друкуються товарно-транспортні накладні в 3 - 4 екземплярах. Накладнi передаються в оперативнi вiддiли (вiддiли зберiгання) для комплектацiї. Виконанi замовлення i товарно – транспортні накладні в 2-х екземплярах передаються в вiддiл експедицiї.
Відділ експедиції. Постачання аптечної мережі, ЛПЗ, інших підприємств, організацій, установ здійснюється за їх вимогами через відділ експедиції. В функції відділу експедиції входить комплектування замовлень і оформлення відповідної документації (товарно-транспортних накладних, податкових накладних тощо). Аптечний склад (база) обладнується сучасними засобами
механізації, інноваційними конвеєрними лініями. Комплектування замовлень
здійснюється роботами під управлінням операторів.
Пакування товарів на складі здійснюється у ящики, мішки, контейнери
тощо у відділі експедиції або безпосередньо у відділі зберігання (в даному
випадку експедиція приймає товар за кількістю місць, що вказані у накладній).
Медикаменти зі складу відпускають із залишковим строком придатності не менше 60%, а бактерійні препарати – не менше 40%.
Супровідні документи:
§ товарно-транспортна накладна;
§ податкова накладна;
§ рахунок-фактура;
§ сертифікат якості.
3.17. Організація доставки товарно-матеріальних цінностей до аптеки.
Доставка грузів здійснюється:
1. Централізовано – тобто вивезення вантажів з території аптечного складу (бази) здійснює транспортнийвідділ при наявності товарно-транспортних накладних і спеціальної перепустки, в якій зазначено маршрут, одержувач товару, номер транспортного засобу і дата.
При централізованій системі доставки фармацевтичних товарів транспортом складу найбільш зручною є контейнерна форма, при якій замовлений
товар для кожної аптеки збирають у її власний контейнер, який опечатують і
доставляють до місця призначення.
2. Деценталізовано – тобто перевозки здійснюються транспортом покупця.
3.18. Особливості відпуску наркотичних, отруйних, психотропних лікарських засобів, прекурсорів
Регламентує наказ МОЗ України від 21.01.2010р. № 11 «Порядок обігу наркотичних засобів, психотропних речовин та прекурсорів у закладах охорони здоров’я України».
З аптечної складу (бази) наркотичні засоби, психотропні речовини та прекурсори можуть відпускатися виключно суб’єктам господарювання, які мають відповідну ліцензію, видану на обіг наркотичних засобів, психотропних речовин та прекурсорів.
Відпуск наркотичних засобів, психотропних речовин та прекурсорів повинен здійснюватися з аптечного складу (бази) за окремими дорученнями із зазначенням у них найменувань і кількостей словами всіх отриманих засобів і речовин.
Порошкові та в таблетках чи драже (ангро) наркотичні засоби, психотропні речовини та прекурсори, які розфасовуються на аптечному складі (базі), повинні відпускатися з аптечного складу (бази) лише в опечатаному вигляді, при цьому на кожній упаковці має бути етикетка із зазначенням назви аптечного складу (бази), назва згаданих вище засобів і речовин, номера і дати аналізу, номера і дати фасування та підпису особи, яка розфасувала даний лікарський засіб.
Відпуск наркотичних засобів, психотропних речовин та прекурсорів з аптечного складу (бази) у таблетках чи драже (ангро) і в порошках, упакованих безпосередньо в папір чи целофан, категорично забороняється.
При отриманні з аптечного складу (бази) наркотичних засобів, психотропних речовин та прекурсорів матеріально відповідальна особа закладу охорони здоров’я, яка їх отримує, зобов’язана перевірити найменування і кількість згаданих вище засобів, що відпускаються, на відповідність найменуванням і кількостям, проставленим у товарно-транспортних накладних. Перевірити цілісність упаковки, відсутність браку (неповна наповнюваність ампул, нечітке маркування), строк придатності тощо.
Відпуск наркотичних засобів, психотропних речовин та прекурсорів оформлюється товарно-транспортною накладною в 3-х екземплярах.
Контрольні питання.
1. Які основні напрями розвитку системи постачання аптек в умовах сучасного фармацевтичного ринку України?
2. Які умови здійснення оптової реалізації лікарських засобів?
3. Належна практика дистрибуції (GDP).
4. Які джерела надходження товарно-матеріальних цінностей до аптеки?
5. Аптечний склад, його основні завдання та функції.
6. Які вимоги до розміщення та складу приміщень аптечного складу?
7. Штат.
8. Організаційна структура аптечного складу, обладнання приміщень.
Відділи складу
9. Приймальний відділ, його завдання та функції. Приймання товару за кількістю, якістю та вартістю.
10. Порядок здійснення вхідного контролю якості лікарських засобів, що надходять на склад.
11. Особливі випадки приймання товару.
12. Організація праці оперативних відділів аптечного складу.
13. Який порядок зберігання товару на складі, контроль за термінами зберігання медичних товарів?
14.Поводження із зіпсованими фармацевтичними товарами.15. Які запобіжні заходи з охорони праці під час зберігання і роботи з вибуховими, вибухонебезпечними, легкозаймистими та горючими товарно-матеріальними цінностями?
16. Які особливості зберігання наркотичних, отруйних речовин, психотропних лікарських засобів та прекурсорів?
17. Охорона праці при роботі з наркотичними, психотропними, отруйними та сильнодіючими засобами.
18.Облік руху товарів у відділах складу.
19.Експедиційний відділ, його завдання. Комплектація замовлень. Оформлення супровідних документів.Відпуск товару зі складу.
20. Які особливості відпуску наркотичних, отруйних та психотропних лікарських засобів?
21.Організація доставки товарно-матеріальних цінностей.
ЛІТЕРАТУРА
1. Громовик Б.П. Організація роботи аптек. — Вінниця: Нова книга, 2005. — 272 с.
2. Немченко А.С., Котвіцька А.А., Панфілова Г.Л. та ін. Організація фармацевтичного забезпечення населення: навч. посіб. — Х.: Авіста — ВЛТ, 2007. — 488 с.
3. Наказ МОЗ України від 31.10.2011 р. № 723 «Про затвердження Ліцензійних умов провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами»
4. Закон України від 4 квітня 1996 року «Про лікарські засоби».
5. Наказ МОЗ України від 21.01.2010 р. № 11 «Порядок обігу наркотичних засобів, психотропних речовин та прекурсорів у закладах охорони здоров’я України».
Тема4: Державна система забезпечення якості лікарських засобів і виробів медичного призначення.
Актуальність теми Рівень лікарського забезпечення багато в чому залежить від організації Державної системи контролю якості ліків. Результатом належної постановки цього контролю є попередження захворювань, інвалідності і смертельних випадків унаслідок запобігання надходження недоброякісних лікарських засобів до хворого, скорочення тривалості лікування за рахунок збереження і гарантування закладених при розробці препарату параметрів його ефективності і безпечності, запобігання втрат, пов’язаних з незадовільним виготовленням лікарських засобів в аптеці (втрата сировини, енергетичних ресурсів і праці фахівців) та неправильною організацією зберігання ліків (втрати від списання).
4.1.Структура Державної системи контролю якості лікарських засобів.
Вітчизняна система контролю якості лікарських засобів має три рівні (рис. 1):
§ національний;
§ регіональний;
§ мікроекономічний.
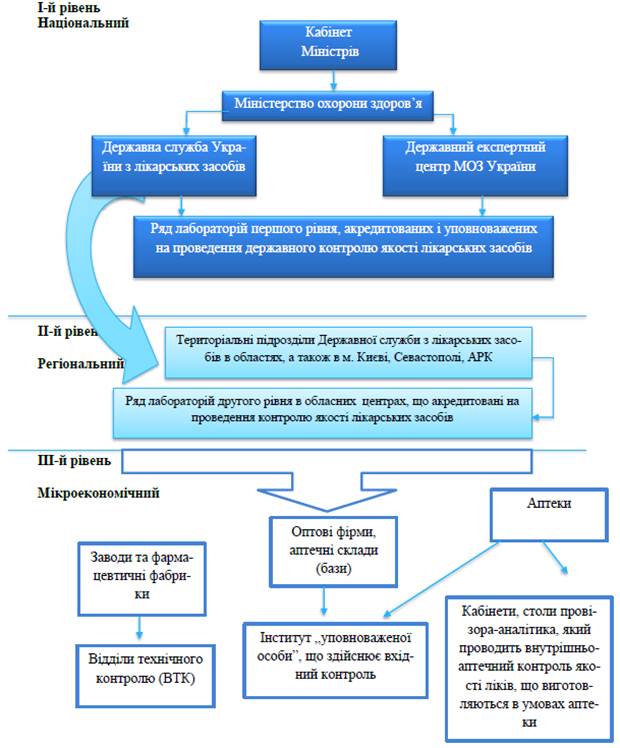
Рис.1.
Державна служба України з лікарських засобів є центральним органом виконавчої влади, діяльність якого спрямовується і координується Кабінетом Міністрів України через Міністра охорони здоров’я України.
4.2.Основні завдання Державної служби з контролю якості лікарських засобів (далі - Держлікслужба України), Державного фармакологічного центру МОЗ України,
Основними завданнями Держлікслужби України є:
1. Внесення пропозицій щодо формування державної політики у
сферах контролю якості та безпеки лікарських засобів, медичних
виробів, а також ліцензування господарської діяльності з виробництва лікарських засобів, оптової та роздрібної торгівлі лікарськими засобами.
2. Реалізація державної політики у сфері державного контролю якості та безпеки лікарських засобів і медичних виробів.
3. Ліцензування господарської діяльності з виробництва лікарських засобів, оптової та роздрібної торгівлі лікарськими засобами.
Держлікслужба України відповідно до покладених на неї завдань:
1. Здійснює державний контроль за дотриманням вимог законодавства щодо:
§ забезпечення якості та безпеки лікарських засобів і медичних виробів під час їх виробництва, зберігання, транспортування, реалізації, утилізації та знищення, в тому числі правил здійснення належних практик (виробничої, дистриб’юторської, зберігання, аптечної);
§ виконання ліцензійних умов провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі такими засобами незалежно від форми власності та відомчого підпорядкування.
2. Здійснює державний контроль ввозу на митну територію України лікарських засобів.
3. Здійснює державний контроль та нагляд за дотриманням вимог стандартів і технічних умов при транспортуванні, зберіганні та використанні лікарських засобів, у тому числі імунобіологічних препаратів та медичних виробів.
4. Відбирає в установленому порядку зразки лікарських засобів і медичних виробів для перевірки їх якості.
5. Надає обов’язкові для виконання приписи про усунення порушень під час виробництва, зберігання, транспортування та реалізації лікарських засобів.
6. Приймає рішення про вилучення з обігу та заборону виробництва, реалізації та застосування лікарських засобів і медичних виробів, що не відповідають вимогам, визначеним нормативно-правовими актами та нормативними документами. 7. Складає протоколи про адміністративні правопорушення та розглядає справи про адміністративні правопорушення.
9. Погоджує …………. аптечних закладів (структурних підрозділів) в установленому законодавством порядку.
10. Здійснює в установленому порядку атестацію лабораторій з контролю якості лікарських засобів.
11. Проводить у встановленому законодавством порядку атестацію провізорів і фармацевтів.
12. Здійснює державну реєстрацію медичних виробів.
13. Надає одноразовий дозвіл на ввезення на митну територію України незареєстрованих медичних виробів.
14. Видає висновок про якість завезеного лікарського засобу.
15. Розробляє ліцензійні умови та видає суб’єктам господарювання ліцензії на виробництво лікарських засобів, оптову та роздрібну торгівлю лікарськими засобами.
16. Здійснює інші повноваження, визначені законами України та
покладені на неї Президентом України. Державний фармакологічний центр - уповноважений Міністерством охорони здоров’я України орган адміністративно-господарського управління та контролю у сфері реєстрації лікарських засобів.
Основні завдання: 1. Здійснює експертизи матеріалів доклінічного вивчення лікарських засобів, клінічних випробувань з метою надання рекомендацій про можливість державної реєстрації лікарських засобів.
2. Здійснює інспектування клінічних баз під час проведення там клінічних випробувань.
3. Здійснює нагляд за побічними діями зареєстрованих в Україні лікарських засобів та надає пропозиції органу державної реєстрації лікарських засобів про повну або тимчасову заборону їх застосування, або корегування інструкцій по застосуванню ліків.
4. Аналізує стан застосування ліків в Україні, надає рекомендації щодо раціонального використання лікарських засобів.
5. Здійснює інформаційне забезпечення системи охорони здоров’я щодо раціонального застосування лікарських засобів.
«Належна лабораторна практика»(Good Laboratory Practice – GLP) -це комплекс стандартизованих, організаційних процесів і умов, в яких плануються, проводяться і обробляються лабораторні дослідження доклінічних випробувань хімічних речовин для людини, тварин і довкілля, а також дослідження якості готової продукції, субстанцій і сировини. Доклінічне дослідження - експеримент або ряд експериментів, у яких зразок лікарського засобу вивчається в лабораторних умовах або в довкіллі для отримання даних щодо його властивостей та безпечності, з метою їх подання до Державного фармакологічного центру МОЗ України.
4.4. Нормативні документи, які регламентують вимоги до якості лікарських засобів.
Нормативно – технічні документи (НТД), що визначають вимоги до якості лікарських засобів, підрозділяються на наступні категорії: Державна фармакопея (ДФ), фармакопейна стаття (ФС), тимчасова фармакопейна стаття (ТФС).
Фармакопея - це збірник обов’язкових медико-фармацевтичних загальнодержавних стандартів і положень, що нормують якість лікарських засобів. Фармакопея має законодавчий характер, обов’язковий для всіх медичних, у тому числі і ветеринарних установ і підприємств країни, які виготовляють, зберігають, контролюють і застосовують лікарські засоби.
Спочатку на кожен новий лікарський засіб затверджується тимчасова фармакопейна стаття (ТФС) на певний строк (найчастіше на 3 роки). Якщо після закінчення цього часу лікарський засіб, нормований даною ТФС, виправдав себе у медичній практиці і його виробництво стає стабільним, то на нього розробляється постійно діюча ФС.
Фармакопейна стаття (ФС) - нормативно-технічний документ, який встановлює вимоги до лікарського засобу, його упаковки, умов і терміну зберігання і методів контролю якості лікарського засобу.
Закон України від 4.04.96р № 124/96 «Про лікарські засоби» |п регулює правові відносини, пов’язані із створенням|створінням|, реєстрацією, виробництвом, контролем якості і реалізацією лікарських засобів, визначає права і обов’язки підприємств, установ, організацій і громадян, а також повноваження в цій сфері органів державної влади і посадових осіб.
Наказ МОЗ України від 31.10.2011 р. № 723 «Про затвердження Ліцензійних умов провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами» Наказ|наказ-інструкція| МОЗ України від 30.10.2001р. № 436 «Про| затвердженні інструкції про порядок|лад| контролю якості ЛЗ в процесі оптової і роздрібної реалізації».
4.5. Організація роботи лабораторій з контролю якості лікарських засобів, завдання.
Лабораторний аналіз якості лікарських засобів здійснюється підпорядкованою лабораторією з контролю якості лікарських засобів, або акредитованою лабораторією на підставі направлень Державної служби з якості ліків або територіальної Державної служби з якості ліків.
Перевірка якості ліків і внутрішньоаптечних заготівель може здійснюватися првізором-аналітиком лабораторії безпосередньо при відвідуванні госпрозрахункових чи лікарняних аптек, а також шляхом доставки вилучених для аналізу ліків у лабораторію з контролю якості лікарських засобів.
Завдання лабораторій:
§ перевірка якості ліків, виготовлених госпрозрахунковими аптеками і аптеками при лікувальних установах, а також контроль якості продукції фармацевтичних фабрик і медикаментів, що надходять на аптечні склади;
§ за завданням Державної служби з якості лікарських засобів лабораторії з контролю якості лікарських засобів можуть вилучати на аналіз продукцію підприємств медичної промисловості, розташованих в одній місцевості з лабораторією;
§ надання послуг по приготуванню та забезпеченню аптечних та інших установ титрованими розчинами, індикаторами, реактивами тощо;
§ впровадження нових технологій проведення аналізу якості лікарських засобів.
4.6.Організаційна структура, оснащення.
Склад приміщень лабораторій з контролю якості лікарських засобів:
§ аналітичний зал - основне виробниче приміщення, призначене для проведення різних хімічних аналізів. Оснащується лабораторними столами, витяжними шафами, вертушками для титрованих розчинів, шафами для збереження посуду і реактивів, штативами, мірним посудом і т.д.;
§ вагова кімната - окреме приміщення, де підтримується постійна температура та вологість. Крім того, тут на ваги не повинні впливати прилади, які працюють у лабораторії. Оснащується спеціальними ваговими столами, різного класу вагами для аналітичних досліджень;
§ оптична кімната - кімната для роботи з фізико-хімічними приладами. Оснащується рефрактометрами, фотоколориметрами, потенціометрами й іншими приладами;
§ кімната хроматографічного контролю - оснащується високоефективними рідинними хроматографами, якими можна здійснити весь спектр контролю домішок, кількісного та якісного складу діючих речовин препарату.
§ кабінет завідувача лабораторією - у якому знахордиться картотека анотацій лікарських засобів, шафи з довідковою літературою;
§ кімната для персоналу лабораторії;
§ приміщення для збереження вогненебезпечних речовин і запасів кислот.
§ мийна - приміщення для миття посуду, бюреток, піпеток і т.д.
Лабораторії з контролю якості лікарських засобів забезпечуються необхідними приладами, апаратами, хімічним посудом, реактивами, допоміжними матеріалами і т.п. Обладнання розміщується у відповідних приміщеннях із дотриманням усіх умов «Належної Лабораторної Практики» (Good Laboratory Practice – GLP).
4.7. Штат лабораторії з контролю якості лікарських засобів.
Штат лабораторії з контролю якості лікарських засобів складається з провізорського, середнього фармацевтичного та допоміжного персоналу.
До провізорського персоналу належать провізори – аналітики, які контролюють якість лікарських засобів виготовлених в аптеках, фармацевтичних фабриках, лікарських засобів, які надходять на аптечні склади (бази) від промислових підприємств, а також приймають участь у перевірках аптек, аптечних складів (баз), фармацевтичних фабрик з питань контролю лікарських засобів.
Середній фармацевтичний персонал – це лаборанти, які готують титровані розчини, індикатори, реактиви для контрольно – аналітичної лабораторії, контрольно – аналітичних столів в аптеках, реєструють лікарські засоби, що надходять на аналіз в лабораторію.
Допоміжний персонал – це санітарки – мийниці.
Контрольні питання
1. Яка структура Державної системи контролю якості лікарських засобів?
2. Які основні завдання Державного фармакологічного центру МОЗ України та Державної служби з контролю якості лікарських засобів?
3. Поняття про належну лабораторну практику.
4. Які нормативні документи регламентують вимоги до якості лікарських засобів?
5. Організація роботи лабораторій з контролю якості лікарських засобів. Які основні завдання лабораторії?
6. Яка організаційна структура лабораторій з контролю якості лікарських засобів та її оснащення?
7. Який штат лабораторій з контролю якості лікарських засобів?
ЛІТЕРАТУРА
1. Громовик Б.П. Організація роботи аптек. — Вінниця: Нова книга, 2005. — 272 с.
2.Немченко А.С., Котвіцька А.А., Панфілова Г.Л. та ін. Організація фармацевтичного забезпечення населення: навч. посіб. — Х.: Авіста — ВЛТ, 2007. — 488 с.
3. Наказ МОЗ України від 31.10.2011 р. № 723 «Про затвердження Ліцензійних умов провадження господарської діяльності з виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами»
4. Закон України від 4 квітня 1996 року «Про лікарські засоби».
Розділ 2. Організація роботи аптеки з товарними запасами.
Тема 5. Організація роботи відділу запасів.
Актуальність теми Своєчасне та якісне лікарське забезпечення населення i лікувально-профілактичних закладів залежить від наявностi в аптецi необхiдних лiкарських засобiв i виробiв медичного призначення необхiдної якостi в необхiднiй кiлькостi в необхiдний час за доступними цiнами. Тому фармацевтичний фахiвець повинен володiти знаннями про закономiрностi розвитку системи постачання аптек товарами, вмiти визначити поточну потребу в них, здiйснювати пошук постачальникiв, обгрунтовано оформляти замовлення, правильно приймати та зберiгати товар в аптецi, визначати відпускну вартiсть для прийнятих лiкарських засобiв і виробiв медичного призначення, проводити їх вiдпуск.
5.1.Вiддiл запасів та його функції.
Самостiйний вiддiл запасiв органiзовується тiльки в аптеках першої групи, а в усiх iнших поєднується з рецептурно- виробничим вiддiлом.
Функцii вiддiлу запасiв.
1. Визначення поточної потреби в лiкарських засобах i виробах медичного призначення.
2. Своєчасне подання замовлень на лiкарськi засоби i вироби медичного призначення.
3. Вхідний контроль лікарських засобів.
4. Забезпечення правильного зберігання товарів.
5. Оганiзацiя предметно-кiлькiсного обліку.
6. Проведення лабораторно-фасувальних робiт.
7. Вiдпуск товарiв iншим вiддiлам, вiдокремленим структурним пiдроздiлам, лiкувально-профiлактичним закладам.
5.2.Примiщення та обладнання вiддiлу.
До вiддiлу запасiв вiдносяться слiдуючi примiщення:
§ розпаковочна;
§ матерiальнi кiмнати (для зберiгання препаратiв, готових лiкарських засобiв, термолабiльних, мiнеральних вод, тари, посуду, допомiжних матерiалiв, лiкарської рослинної сировини, перев’зувальних матерiалiв);
§ приміщення для обслуговування лiкувально- профiлактичних закладiв (для приймання i оформлення замовлень, експедицiйна);
§ примiщення для проведення лабораторних i фасувальних робіт (заготовча).
5.3. Складання заявок-замовлень та виписування товару з аптечного складу та від інших постачальників.
Важливим роздiлом роботи вiддiлу запасiв є визначення потреби в лiкарських засобах i виробах медичного призначення, складання i своєчасне подання вимог-замовлень до постачальника.
Замовлення на отримання товару може бути надане рiзними шляхами: усно, телефонограмою, факсом, електронною поштою, письмово на паперовому носiї.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 9888; Нарушение авторских прав?; Мы поможем в написании вашей работы!