
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Структура и свойства наноразмерных металлических модификаторов функциональных материалов
|
|
|
|
Структура и свойства наноразмерных частиц, применяемых в функциональном материаловедении
В настоящее время не вызывающим сомнение является предположение, что материаловедение и технология XXI века будут основаны на объектах наноразмерного характера. Наноразмерные объекты занимают определенное место в живых системах [63]. Наблюдается отчетливая связь между размерными соотношениями материалов, применяемых в деятельности человека, и присутствующих в живых объектах (рис. 1.52).
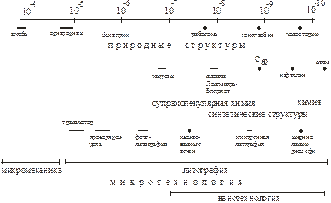
Рисунок 1.52 – Размерные соотношения объектов в природе и материаловедении [4]
Развитие нанотехнологий и наноматериалов стимулирует поиск принципиально новых технических решений в электронике, приборостроении, вычислительной технике и других областях промышленности, определяющих современный уровень цивилизации. Одновременно развивается исследовательское оборудование для анализа физико-химических процессов, протекающих на принципиально новом уровне.
Технологические аспекты получения наноразмерных частиц (НРЧ) существенным образом зависят от их состава и структуры. При одном и том же химическом составе НРЧ в зависимости от применяемой технологии можно получить различные по структуре и активности частицы. Широкое применение в качестве компонентов нанокомпозиционных материалов получили НРЧ металлов, синтез которых производят по различным технологиям. Физико-химические аспекты различных технологий образования наноразмерных металлических частиц в различных матрицах достаточно хорошо описаны [4, 9]. Поэтому в настоящем разделе рассмотрим наиболее характерные особенности процессов получения металлических НРЧ в газовой и конденсированной фазах.
Диапазон методов получения металлических наноразмерных частиц чрезвычайно широк и сформирован на двух принципиальных подходах: конденсационном и диспергирующем. Первый подход состоит в формировании НРЧ из отдельных атомов в ходе фазового превращения – термолиза, испарения, конденсации и т.д. При втором подходе грубодисперсные частицы полуфабриката измельчают с помощью различного технологического оборудования до размеров НРЧ. Наиболее распространенные методы получения металлических НРЧ приведены на рис. 1.53.
Приведенные на рис. 1.53 методы позволяют получать НРЧ металлов с различным уровнем дисперсности и физико-химическими свойствами. Выбор конкретной технологии получения определяется совокупностью энергетических, экологических, физико-химических и экономических и др. аспектов, вытекающих из целей и задач применения материалов на их основе. Различные технологии получения металлических НРЧ подробно рассмотрены в ряде монографий [4, 9, 10, 64, 65 и др.]. Поэтому основное внимание будет уделено методам получения металлических и металлсодержащих частиц, применяемых для получения полимерных нанокомпозиционных материалов. По кинетическим особенностям образования НРЧ методы подразделяют на физические и химические.

Рисунок 1.53 – Технологические методы получения металлических низкоразмерных частиц [4]
Основу физических методов составляют фазовые превращения первого рода (конденсация, кристаллизация, разложение) без протекания химических реакций. Образование НРЧ происходит в результате конденсации капель жидкости с последующим затвердеванием, конденсации паров с образованием кристаллических и аморфных твердых тел, кристаллизации твердой фазы из расплава или раствора и распада твердой фазы.
Методом молекулярных пучков малой интенсивности получают эпитаксиальные пленки и нанокристаллы. Сущность метода состоит в конденсировании частиц (атомов, молекул, кластеров), образующихся в результате нагрева в вакууме источника, на подложке. Молекулярные пучки могут кристаллизоваться на локальных участках подложки с помощью «маски» [66].
Кластерные пучки с большой интенсивностью получают с помощью метода сверхзвукового истечения газа из сопла [67]. Усовершенствованный метод газодинамического генерирования кластеров позволяет получать частицы металлов (Cu, Bi, In, Pb, Ag и др.) с размерами от 2,5 до 9,5 нм и узким распределением по размерам.
При ионной бомбардировке металлической мишени потоками ионов инертных газов (Ar+, Ne+, Kr+) или некоторых металлов (Hg+, Ag+) получают кластеры меди, ванадия, титана, золота и других металлов с различным содержанием атомов [4].
Методом ударных волн получают кластеры железа, свинца, висмута и других металлов из соединений типа Fe(CO)5, Pb(CH3)4, Bi(CH3)3. Рабочий газ с высоким давлением, попадая через диафрагму в камеру низкого давления с парами металлсодержащих соединений, создает ударную волну, вызывающую их разложение.
При аэрозольном методе получения высокодисперсных металлсодержащих частиц используют процесс испарения металлов в разряженной атмосфере инертных газов при повышенных температурах с последующей конденсацией паров. Метод позволяет получать НРЧ Fe, Co, Ni, Cu, Ag, Au, Al и др. металлсодержащих соединений с размерами от нескольких нанометров до десятков нанометров [68].
Методом вакуумного испарения с последующей конденсацией паров в вакууме на твердой или жидкой поверхности получают частицы с размерами 4,0-20 нм. Применение в модифицированном способе в качестве жидких сред высокотемпературных масел, жидкого азота позволило расширить номенклатуру получаемых НРЧ [4].
При катодном распылении, основанном на разрушении отрицательного электрода (катода) в газовом разряде под действием положительных ионов, получают широкую номенклатуру металлических НРЧ, в т. ч. тугоплавких – V, W, Ta, Mo и др. Широко применяют магнетронный режим катодного распыления, основанный на применении скрещенных магнитных и электрических полей.
Технология низкотемпературной плазмы позволяет получать высокодисперсные порошки Fe, Al, Ti, Cu, Ni, In с формой, близкой к сферической, и размерами d=3¸80 нм [69]. Применением плазменной технологии в методе плазменно-активированного химического газового осаждения (PECVD- метод) получают пленки наноразмерной толщины.
Методы получения НРЧ путем диспергирования крупных частиц позволяют получать продукты в виде порошков, эмульсий, суспензий, аэрозолей. При этом применяют механическое или акустическое (ультразвуковое) диспергирование. При подведении к частице энергии происходит разупорядочение структуры вещества, изменяется ее подвижность и структурная релаксация, связанная со стремлением системы вернуться в равновесное состояние. Для диспергирования используют большое число аппаратов различных конструкций [70]. Тонкие и сверхтонкие порошки получают на мельницах с различным уровнем энергозаряженности:
- с низкой скоростью нагружения, разрушающих материал за счет сжатия (шаровые, стержневые, центробежные и др.);
- со средней скоростью нагружения, диспергирующих материал стесненным ударом (вибрационные, центрально-планетарные, магнитно-вихревые и т. п.);
- с высокой скоростью нагружения, измельчающих материал свободным ударом (ударные, молотковые, струйные, дезинтеграторные и др.).
Разновидностью механического диспергирования является получение порошков с применением ударной волны [4]. При использовании для диспергирования металлов ультразвуковых волн получают однородные суспензии металлов и сплавов со средним размером частиц не более 1 000 нм. Для интенсифицирования процесса применяют специальные дисперсионные среды, ПАВ и определенные частоты УЗ-излучения. Ультразвуковое диспергирование (сонохимический синтез) позволяет получать чистые эмульсии с узким распределением частиц по размеру и размерам от 1-2 до 10-50 нм.
Химические методы получения НРЧ металлов основаны на процессах восстановления соединений металлов в присутствии различных стабилизаторов. В качестве восстановителей используют гидриды легких металлов, алюмогидриды, формальдегид, соли щавелевой и винной кислот, гидрохинон, водород и некоторые водородсодержащие соединения (аммиак, гидразин, сероводород, H2O2 и др.). К числу распространенных методов получения НРЧ относят пиролиз термически малоустойчивых металлсодержащих соединений: гидридов, карбонилов, азидов, формиатов, оксалатов, различные варианты криохимического синтеза и плазмохимические методы, метод синтеза гигантских кластеров [4, 11].
Восстановление до металлов может осуществляться как в газовой, так и в конденсированной средах. В настоящее время наибольшее распространение вследствие технологичности и доступности получили методы восстановления металлсодержащих соединений в водных и неводных средах. Если восстановление в этих средах технологически не осуществимо, то используют методы гетерогенного восстановления в системах «газ-твердое тело». Так при восстановлении водородом или водородсодержащими соединениями получают порошки металлов с размерами от 2-5 до 30-80 нм. При этом возможен процесс «гидридного диспергирования», при котором происходит самоизмельчение частиц металла при взаимодействии с водородом.
Образование НРЧ при химических реакциях в водных или неводных средах основано на протекании окислительно-восстановительных процессов [10]. Для получения высокодисперсных частиц в жидких средах вводят стабилизаторы, препятствующие коагуляции образовавшихся частиц. К числу наиболее распространенных стабилизаторов относят:
- природные и синтетические полимеры (желатин, агар-агар, крахмал, поливиниловый спирт и т. п.);
- высокомолекулярные органические кислоты и ПАВ;
- лиганды акцепторного типа: пиридин, фенатролин, фосфины и др.
К числу наиболее распространенных восстановителей относят тетрагидробораты щелочных металлов МВН4, боразотоводородные соединения (диалкиламинобораны, гидразинборан и др.), гипофосфит, азотоводородные соединения (гидразин, его производные и гидроксиламид), органические соединения типа формальдегида, цитрата натрия, гидрохинона, ментола и др.
Широко применяют методы получения НРЧ в реакциях, стимулированных высокоэнергетическим излучением, в качестве которого используют потоки быстрых электронов, лазерное излучение, свет с определенной длиной волны, g-излучение и т. п. По типу воздействия на химическую систему подводимой энергии различают фотохимические (фотолиз, <60 эВ), радиолитические (радиолиз, 60-104 эВ) методы, облучение потоком быстрых электронов (>104 эВ) и плазмохимический метод. При фотохимическом методе получают частицы металлов (Ag, Au, Pt, Po, Cu), близкие к сферической форме, с размерами от единиц до десятков нанометров. Восстановление может происходить как в жидкой, так и в твердой фазе в слое толщиной до нескольких микрометров. Так фотолиз оксалата, сульфата и роданида серебра приводит к образованию частиц с размерами 40-50 нм, а галогенидов серебра – с размерами 100-300 нм.
Воздействием g-излучения на жидкие и твердые вещества изменяют выход НРЧ. Получены НРЧ меди, серебра, палладия и др. металлов с узким размерным диапазоном и размерами частиц от 2-4 нм до 30-40 нм.
Перспективным методом получения НРЧ является облучение растворов солей потоком быстрых электронов. Однако метод в настоящее время мало доступен из-за сложности источников излучения.
Электрохимические методы получения НРЧ основаны на образовании на катоде в результате электрокристаллизации осадка вследствие окислительно-восстановительных процессов, протекающих под действием постоянного тока. Таким способом получают частицы сферической или цепочной формы с размерами 10-20 нм и 80-120 нм соответственно [9, 17].
Широко распространенным методом получения НРЧ металлов и оксидов является термолиз прекурсоров – солей неорганических и органических кислот, простых и комплексных катионов металлов и металлорганических соединений [9, 64, 65].Термолиз веществ можно проводить в газовом, жидком и твердом состоянии. Термолиз в газовой фазе производят при различных режимах химического газофазного осаждения (CVD-синтез) или в условиях низкотемпературной плазмы.
Состав образующейся частицы, ее геометрическая форма и размеры зависят от состава прекурсора, температурно-временных условий распада, среды и ряда других технологических факторов. Для технологии CVD-синтеза применяют галогениды, карбонилы, b-дикетоны, гидриды, алкины, алкены, арены, металлоцены и др. соединения. Наиболее важным значением при получении порошков является температурный интервал (350¸1300К). Так при изменении температуры от 673 до 1173К средний диаметр частиц вольфрама изменяется от 1200 до 30 нм. Важное влияние оказывает состав исходного прекурсора и наличие химически активных добавок, вводимых в газ-носитель.
Термолизом карбонилов металлов общей формулы Mn(CO)m получают частицы Cu, Ag, Au, Ti, V, Ta, Cr, Mn, Re, Ru, Os, Ir, In. При разложении металлсодержащих прекурсоров в органических растворах получают частицы с размером 6,0-11,0 нм [71].
Твердофазный термолиз металлорганических прекурсоров более эффективен по сравнению с газофазным, т. к. позволяет получить более концентрированные продукты. При прямом разложении большинства прекурсоров получают, главным образом, оксиды металлов. Высокодисперсные частицы металлов можно получить при углеродвосстановительном термолизе. Таким образом получают частицы Fe, Co, Ni с размерами 10-150 нм. Низкоразмерные частицы получают термическим распадом в твердой фазе азидов, перхлоратов Ag, Pb, Cd и др. металлов. Формирование НРЧ наблюдается и при гетерофазных превращениях соединений. Порошки Gr и Ni с диаметром 6-8 нм получают термическим воcстановлением оксидов парами Mg, Li, Na [68].
Широко применяют для получения высокодисперсных частиц карбоксилаты переходных металлов предельных и непредельных кислот. Общая формула соединений металлов с апротонированными карбоксилатными группами Ме(RCOO-)n, где n =1 – монокарбоксилаты (формиаты, ацетаты, пропионаты, бензоаты, акрилаты), n> 1 – поликарбоксилаты (малонаты, цитраты, малеинаты, фумараты, фталаты, адипинаты, итаконаты, в т.ч. оксалаты). Процессы термолиза карбоксилатов подробно изложены в [4]. Получаемые частицы имеют форму, близкую к сферической, и размеры от 20-75 нм (для Ni, Cu) до 200-3000 нм (для Pb, Cu) зависимости от состава прекурсора. Изменяя режимы термолиза удается варьировать размер частиц в пределах 10¸100 нм, а используя специальные приемы обработки – и менее 10 нм.
Рассмотренные методы получения низкоразмерных частиц металлов и их соединений не отражают всего многообразия технологий, разработанных в промышленном, опытно-промышленном и опытном масштабах. Непрерывное совершенствование технологических приемов, основанных на использовании высокоэнергетических установок, а также специальных соединений – прекурсоров и сред, способствует быстрому расширению спектра технологически значимых методов, нашедших применение в практике.
В зависимости от технологии получения НРЧ металлов форма, размеры и свойства наночастиц различны. Как ранее отмечалось, при электрохимическом методе синтеза из растворов солей образуются частицы двух основных морфологических видов: сфероподобные со средним диаметром от 3-10 нм и агрегированные в виде линейных цепочек, дендридов [4, 9,10]. Методом ионной имплантации ионов металлов типа Ag+ и Fe+ в полимерных средах получают изолированные сфероподобные частицы с размером 10-30 нм или агломераты, состоящие из большого числа единичных частиц. Образование агломератов является результатом процессов диффузии и коогуляции единичных частиц [12, 13]. Методом распыления металлических проволок электроимпульсами большой мощности в атмосфере инертного газа получают порошки ультрадисперсных металлов с удельной поверхностью 10-100 м2/г и избытком свободной энергии до сотен Дж/г. Порошки Ag, Pt, Cu, Zn, Ta, Sn, полученные методом электровзрыва, имеют вид металлических глобул с размерами от 200 до 2000 Ǻ. Моночастицы характеризуются большим количеством дефектов типа полисинтетических двойников по плоскости (111) и содержат на поверхности соединения с окружающим газом [73]. Ионно-лучевым синтезом получают частицы переходных металлов из однозарядных соответствующих ионов, имплантированных в полимерные матрицы различного строения. Форма частиц металлов зависит от типа полимерной матрицы и вида имплантированного иона [74]. Термолизом металлсодержащих мономеров типа акрилатов Ni и Fe получают высокодисперсные частицы с размерами 6-13 нм [75]. Методом испарения в вакууме получают порошки алюминия с размерами от 10 до 45 нм [76].
Известен планарный метод синтеза металлических частиц путем разложения нерастворимых металлорганических соединений – прекурсоров на поверхности жидкой фазы под действием ультрафиолетового излучения или химического восстановления. Получаемые частицы имеют плоскую форму с толщиной несколько нанометров и диаметром от нескольких до сотен нанометров [75, 76].
Разработан новый метод синтеза нанокластеров серебра с размерами 1,75-2,2 нм с применением микроэмульсий. Микроэмульсии получают восстановлением AgNO3 гипофосфатами в водных обратных мицеллах в присутствии ПАВ. Полученные наночастицы обладают значительным антимикробным действием [77].
Технологиями вакуумного напыления пленок металлов (Ag, Au, Ni и др.) толщиной 10-40 нм и последующим отжигом при 1073 К получают наночастицы с горизонтальными размерами 40-400 нм и высотой 40-250 нм с особыми магнитными ориентационными характеристиками [78, 79]. Высокодисперсные частицы металлов и интерметаллических соединений получают гидридным диспергированием металлов и сплавов путем многократного проведения циклов «сорбция-десорбция Н2», размолом порошков после гидридного диспергирования, взаимодействием металлических порошков с аммиаком в присутствии промотора NH4Cl, восстановлением гидридом кальция основных карбонатов металлов, механохимическим синтезом смесей металлов или гидридов, проведением цикла «гидрирование – диспропорционирование–дегидрирование–рекомбинация». Дисперсность таких порошков составляет от 200 нм до 10 мкм, что позволяет применять их в системах хранения, очистки и разделения водорода [80].
Методом двумерного синтеза в ленгмюровском слое на границе раздела фаз «воздух-вода» при наложении внешних магнитных и электрических полей получают анизотропные наночастицы вытянутой формы или изотропные плоские частицы [81, 82].
Разработана технология синтеза наночастиц переходных металлов и сплавов в оксидных матрицах. В качестве соединений – прекурсоров использованы производные слоистого двойного гидроксида алюминия и лития, содержащие в межслойном пространстве комплексы Co, Ni, Cu с органическим лигандом – этилендиаминотетрауксусной кислотой (ЭДТА). При термолизе в инертной атмосфере в аморфной матрице образуются наночастицы металла с размерами около 5 нм с узким разбросом по размеру, обладающие высокими значениями удельной намагниченности [83-85].
Для получения нанокомпозиционных эпитаксальных пленок типа «металл-оксид металла» на основе Nb, No, W разработана технология локального окисления с помощью проводящего зонда атомно-силового микроскопа (АСМ). Латеральные размеры оксидных областей, получаемых при разности потенциалов между пленкой и зондом микроскопа более 4в, зависят от влажности среды, величины потенциала, природы металла и составляют 15-20 нм [86].
Гранулированные аморфные нанокластеры сплавов на основе железа, кобальта, циркония, ниобия, танталла получают методом ионно-лучевого напыления с последующей термообработкой. Образуются кластеры, разделенные изолирующей аморфной матрицей SiO2 с размерами 2-10 нм [87].
Очевидно, что рассмотренные выше методы получения НРЧ металлов не ограничивают поле технологий, которые находятся в стадии прогрессивного развития. Естественно, что, как отмечалось ранее, технологии вносят определяющий вклад в параметры структуры и свойств образующихся наночастиц, изменяя их активность в процессах взаимодействия с окружающей средой, матрицей и между собой.
Вместе с тем, существуют некоторые общие закономерности формирования металлических НРЧ, которые определяют их характерные отличия от других типов наноразмерных модификаторов. Эти характерные отличия достаточно подробно рассмотрены в фундаментальной монографии А.Д. Помогайло и сотр. [4]. Поэтому нам представляется возможным лишь кратко остановиться на наиболее важных особенностях структуры и свойств НРЧ, которые широко применяют при получении функциональных нанокомпозитов, например, на полимерных и олигомерных матрицах [9, 38-40].
Установлено, что образующиеся в результате различных технологий синтеза металлические НРЧ, обладают высокой реакционной способностью, которая обусловливает их самоорганизацию, которая проявляется в агрегации. Образующиеся агрегаты в большинстве случаев имеют фрактальную структуру и их называют «фрактальными кластерами» (ФК) или «фрактальными агрегатами» [4]. Анализу особенностей структуры и характеристик фрактальных металлических агрегатов посвящено значительное количество публикаций [4, 88-95].
Установленным экспериментальным фактом является изменение адсорбционных, электрических, теплофизических, магнитных, оптических и иных характеристик металлических кластеров, полученных по различным технологиям. Отметим, что практически все нанокластеры обладают высокой адсорбционной способностью, что, например, проявляется в быстром окислении их на воздухе [90, 91]. Наноразмерные частицы металлов обладают выраженными лиофобными характеристиками [30], что оказывает существенное влияние на механизмы и кинетику их взаимодействия с растворами и расплавами различных матричных веществ.
Необходимо отметить, что в большинстве исследований металлических НРЧ рассматриваются как относительно стабильные объекты, которые не изменяют (или незначительно изменяют) свой состав, структуру, агрегатное состояние в процессе длительной экспозиции в средах различной природы. Между тем, из общих физико-химических представлений известно, что металлические НРЧ, вступая во взаимодействие с компонентами окружающей среды, могут изменять не только состав поверхностных слоев, но и реализовать фазовый переход «металл-металлсодержащее соединение», который приводит к принципиальным изменениям в структуре системы «металлическая НРЧ-матрица» [40, 96, 97].
Нам представляется, что в металлополимерных системах этот аспект играет определяющую роль не только при выборе технологии формирования композита, но и при оценке ресурса изделий из него в различных эксплуатационных условиях. Некоторые характерные особенности металлополимерных систем будут рассмотрены ниже.
Низкоразмерные металлические частицы, как и другие НРЧ, обладают повышенной поверхностной энергией, что обусловлено различными факторами (см. 1.1.2). Особое энергетическое состояние поверхностного слоя наночастиц предполагает повышение их адсорбционных характеристик.
Молекулы в поверхностном слое расположены по иному, по сравнению с молекулами в объеме, так как результирующая сила, действующая на молекулы, расположенные на поверхности, не равна нулю, тогда как в объеме, при условии обработки фазы, эта сила равна нулю. Строго говоря, вследствие флуктуации положение соседних, по отношению к любой молекуле, выбранной в качестве объекта анализа меняется, то мгновенное значение результирующей силы будет – отличаться от нуля, но, во-первых, эта сила будет достаточно быстро менять свою величину и направление, во-вторых, эти изменения носят случайный характер, а в-третьих, именно этим объясняется процесс диффузии – направленное движение молекул при котором подключаются статистические закономерности.
Появление сил поверхностного напряжения характерно для поверхностей раздела любых контактирующих фаз (рис. 1.53). Силы поверхностного натяжения, направлены по касательной к поверхности и их действие, в соответствии с принципом Ле-Шателье, стягивают поверхность, уменьшая ее площадь. Именно поэтому жидкость при действии на нее других сил, принимает форму сферы, что много раз демонстрировали космонавты при показе водяных шаров, «плавающих» по кабине корабля, так как сила тяжести отсутствует.

Рисунок 1.53 – Причина появления поверхностного натяжения. 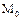 ,
, 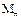 - молекулы жидкости в объеме и на поверхности
- молекулы жидкости в объеме и на поверхности
Наличием силы поверхностного натяжения объясняется, например, то, что водяные паучки могут свободно бегать по поверхности воды. Поверхностное натяжение имеет размерность силы на единицу длины, то есть  Часто вместо термина поверхностная сила говорят о поверхностной энергии
Часто вместо термина поверхностная сила говорят о поверхностной энергии 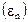 , которая определяется величиной поверхностной энергии на единице площади поверхности и
, которая определяется величиной поверхностной энергии на единице площади поверхности и 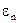 равна работе внешних сил, необходимой для образования единичной поверхности на границе двух фаз. Размерность
равна работе внешних сил, необходимой для образования единичной поверхности на границе двух фаз. Размерность 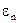 равна
равна 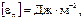 так как
так как 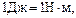 то
то  то есть размерности
то есть размерности 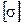 и
и 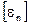 одинаковые.
одинаковые.
На рис. 1.54, в отличие от рис. 1.53, показаны слабые силы, действующие на поверхностную молекулу в жидкости в направлении во внешнюю среду, это объясняется тем, что взаимодействие между молекулами жидкости и газа существует, хотя оно намного меньше взаимодействий молекул друг с другом в жидкости.
Наличие нескомпенсированных связей поверхности молекул вызывает появление поверхностного натяжения не только в жидкостях, но и в твердых телах, а также вызывает такое специфическое поверхностное явление, как адгезия (от лат. adhesion, прилипание).

Рисунок 1.54 – Натяжение сил поверхностного натяжения s на границе фаз жидкость – газ (ЖГ), жидкость – твердое тело (ЖТ)
Адгезией называется такая связь между различными телами (твердое–твердое, твердое–жидкое, жидкое–жидкое), для разрыва которой требуется приложение внешних сил.
На границе «твердое тело–жидкость» примыкание молекул жидкости к твердой поверхности формирует, так называемую, адгезию жидкости. Если при адгезии сочетающиеся поверхности влияют друг на друга, то в адгезионных слоях наблюдается структурированность. Адгезия может наблюдаться при контакте больших поверхностей с микро- и наночастицами, а также с пленками, адгезионные свойства могут проявляться без каких-то внешних усилий. Это одно из важных требований к клеям различных типов.
Необходимое условие адгезии иллюстрирует рис. 1.55 из которого следует условие примыкания элементов 1 и 2.

Рисунок 1.55 – Поверхностные энергии в контактах двух сред: а) до и б) после контакта. 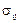 - поверхностная энергия на границе фаз i и j
- поверхностная энергия на границе фаз i и j 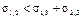
При контакте твердого тела с газовой или жидкостной фазами, в которых есть частицы (например, пыль в воздухе или взвеси в жидкости), а также при контакте жидкости с газовой средой, возможно концентрирование, то есть сгущение, в приповерхностном слое частиц из газа или жидкости, а также молекул газа или молекул растворенного вещества в жидкости. Это явление называется адсорбцией. Примыкающие к поверхности вещества (частицы, молекулы, радикалы, атомы) называются адсорбатом, а вещество, на поверхности которого располагается адсорбат – адсорбентом.
Если поглощение вещества из раствора или газовой смеси твердым телом или жидкостью идет во всем объеме поглощения, то такой процесс называется абсорбцией. Поглощающий компонент называют абсорбентом, поглощенное вещество – абсорбатом.
Совершенно очевидно, что при адсорбации характеристика свойств поверхности адсорбента будут меняться. Этот эффект достаточно хорошо известен хотя бы по уменьшению силы трения при нанесении на поверхность смазки. Адсорбцию широко исследуют в различных технологиях, например, в процессах обогащения полезных ископаемых флотацией. В этом случае диспергированный образец природного материала (руды) обрабатывается таким реагентом, который адсорбируясь на частицах полезного компонента, изменяет смачиваемость этих частиц. Все это находится в водной суспензии (пульпе), через которую пропускают воздух в виде пузырьков (в пульпе имеется вспениватель). Пузырьки прилипают только к тем частицам, которые надо выделить из смеси. Пузырьки вместе с этими частицами поднимаются в верхний пенистый слой и отделяется вместе с пеной от рабочей пульпы.
Вещества, существенно меняющие свойства поверхности на границе двух фаз (обычно твердое – жидкое, твердое – газообразное), называют поверхностно-активными веществами (ПАВ). Среди наиболее известных ПАВ следует назвать соли жирных кислот (мыла), которые было изобретено более 6000 лет тому назад.
Процесс адсорбации зависит от большого числа характеристик поверхности особенно от ее пористости. Среди пористых адсорбентов наиболее известными являются угольные частицы, прошедшие высокотемпературную обработку без доступа кислорода (активированный уголь). Широко используется как адсорбент различные глинистые минералы (бентониты), слоистые силикаты (галлуазит, тальк, слюды, монтмориллонит, и др), а также цеолиты, кристаллическая структура которых пронизана нанопорами. Поэтому цеолиты называют молекулярными ситами. Молекулы ПАВ обычно имеют «хвостовую» форму, когда к более тяжелому атому (А) присоединена цепочка из более легких атомов. Очень часто эта цепочка представляет собой углеводородное звено (рис. 1.56).

Рисунок 1.56 – Типичная молекула ПАВ
В этих молекулах центры положительных и отрицательных зарядов могут не совпадать, то есть такие молекулы являются электрическим диполем. Заметим, что молекула воды (рис. 1.57) обладает достаточно большим (по атомным масштабам) дипольным моментом, равным 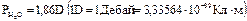 . Расположение молекул адсорбата на плоской поверхности и на сферических частицах приведено на рис. 1.58. В большинстве случаев полярная или поляризованная молекула адсорбата взаимодействует с заряженными цчастками поверхности адсорбанта, если он имеет достаточно большие размеры (рис. 1.58 – а, б).
. Расположение молекул адсорбата на плоской поверхности и на сферических частицах приведено на рис. 1.58. В большинстве случаев полярная или поляризованная молекула адсорбата взаимодействует с заряженными цчастками поверхности адсорбанта, если он имеет достаточно большие размеры (рис. 1.58 – а, б).
Рисунок 1.57 – Структура молекулы воды

а б в г
Рисунок 1.58 – Положение молекулярных диполей адсорбата на адсорбенте с различным зарядом плоской поверхности (а, б) и на сферической частице адсорбата (в, г)
Если адсорбат представлен частицами класса  , то эти частицы могут нести электрический заряд, и тогда молекулярный диполь будет расположен на поверхности так, как показано на рис. 1.58 (в), (г). Молекулы адсорбата могут вступать в химическую связь с поверхностными молекулами адсорбента, в этом случае говорят о хемосорбции. Следует отметить, что для плоской заряженной поверхности вещества, характерно то, что верхняя поверхность первого молекулярного соя (рис. 24 – а, в) также становится заряженной с сохранением знака. Эти же распределения можно привести и для второго молекулярного слоя и так далее.
, то эти частицы могут нести электрический заряд, и тогда молекулярный диполь будет расположен на поверхности так, как показано на рис. 1.58 (в), (г). Молекулы адсорбата могут вступать в химическую связь с поверхностными молекулами адсорбента, в этом случае говорят о хемосорбции. Следует отметить, что для плоской заряженной поверхности вещества, характерно то, что верхняя поверхность первого молекулярного соя (рис. 24 – а, в) также становится заряженной с сохранением знака. Эти же распределения можно привести и для второго молекулярного слоя и так далее.
Может показаться, что такие рассуждения можно продолжать сколь угодно долго. В этом случае поверхность будет оказывать упреждающее воздействие на большой объем применительно к ней вещества. Однако, на положение молекул адсорбата, кроме упорядочивающего воздействия поверхности, действует фактор разупорядочения вследствие теплового движения молекул. Если дискреция угла между осями молекул первого слоя и нормалью к поверхности равна d, то для n-го слоя она равна 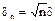 . Для сферических частиц (рис. 1.58 – в, г) с ростом радиуса системы «частица + упорядоченные молекулярные слои адсорбата» уменьшается поверхностная плотность электрического заряда, что наряду с тепловым разупорядочением ограничивает влияние частицы наполнителя на модификацию структуры (и свойств) матрицы основного вещества.
. Для сферических частиц (рис. 1.58 – в, г) с ростом радиуса системы «частица + упорядоченные молекулярные слои адсорбата» уменьшается поверхностная плотность электрического заряда, что наряду с тепловым разупорядочением ограничивает влияние частицы наполнителя на модификацию структуры (и свойств) матрицы основного вещества.
Образовавшиеся на поверхности сферической частицы, как и в случае плоской поверхности, молекулярные слои характеризуются ростом значения угла j (рис. 1.59). Эта зависимость 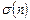 , где n – номер молекулярного адсорбированного поверхностью молекулярного слоя, схематично изображена на рис. 1.60. Когда
, где n – номер молекулярного адсорбированного поверхностью молекулярного слоя, схематично изображена на рис. 1.60. Когда  , то действие поверхности на молекулы вещества отсутствует.
, то действие поверхности на молекулы вещества отсутствует.

Рисунок 1.59 – Результат действия двух факторов: упорядочения (электронное поле), разупорядочение (тепловое движение)
Из сказанного следует, что нет резкой границы между упорядоченной (модифицированной) частью вещества и его основным (немодифицированным) состоянием. То есть модифицированная область вещества вместе с частицей вызвавшей упорядочение молекул, не является второй фазой по отношению к веществу, в котором находится частица, так как важнейшей характеристикой фазы является наличие границы раздела.
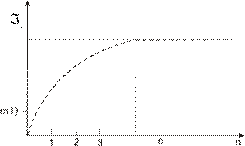
Рисунок 1.60 – Зависимость дисперсии распределения углов s (см. рис. 1.59) от номера адсорбированного поверхностью молекулярного поля
Таким образом, активная НРЧ может стать центром образования кластерной структуры.
При формировании композитов на основе полимеров с ультрадисперсными наполнителями на стадиях их создания производится размягчение (плавление) полимеров. Для описания процессов образования кластеров будем учитывать два положения:
1.Ультрадисперсные наполнители либо несут на себе электрический заряд, либо на их поверхности (при электронейтральности частицы) имеется электрическая мозаика.
2.Размягченный (расплавленный) полимер рассматривается как вязкая, слабопроводящая электрический ток жидкость.
Как известно [98] электрическая конвекция слабопроводящих жидкостей возникает при действии сил на объемный заряд жидкости. При ионной природе проводимости это означает, что образовавшиеся заряды (ионы или электроны) увлекают за собой в движение большое количество нейтральных молекул жидкости, поскольку относительная концентрация зарядов в жидкости мала (10-6¸10-12) [99-100]. Механизм такого переноса не совсем ясен, однако можно предложить модель его реализации, когда даже малая величина относительной концентрации зарядов позволяет объяснить движение большого количества нейтральных молекул жидкости (10-6¸10-12 молекул на один заряд).
Молекулы, находясь в электрическом поле, могут поляризоваться и вступать во взаимодействие с зарядом, образуя структуру «заряд-слой диполей». Внешняя оболочка этой структуры создает вокруг себя новый слой диполей и так далее до образования некоторого равновесного формирования, которое можно назвать «зарядовым кластером».
Число молекул, входящих в зарядовый кластер, можно оценить из следующих приближений:
1. Взаимодействие поляризованных дипольных молекул жидкости вокруг центрального ядра описывается сферической симметрией.
2. Распределение углов Р(а) между радиусом-вектором, исходящим из заряда, и дипольным моментом молекулы подчиняется закону Гаусса с дисперсией s.
3. Распределение углов между диполями n -го и п +1-го слоев аналогичны распределению углов для 1-го слоя.
Определим распределение углов между диполями n -го слоя и радиальным направлением. Пусть ank – угол между диполями n -го и k -гo сферических слоев. Для первого слоя распределение имеет вид
 . (1.27)
. (1.27)
Для второго слоя:
 . (1.28)
. (1.28)
Так как a21 = a2-а1, s << p,  ,
,
то выражение (1.28) можно записать:

 (1.29)
(1.29)
Таким образом, распределение углов диполей второго слоя относительно радиального направления определяется выражением:
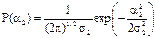 , (1.30)
, (1.30)
где 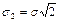 .
.
Покажем, что если для (n-1) – го слоя справедливо условие:
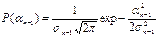 ,
,
где 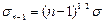 , то для n -го слоя справедливо условие:
, то для n -го слоя справедливо условие:
 .
.
где  .
.
Действительно, учитывая, что  = an-an-1 ,и:
= an-an-1 ,и:
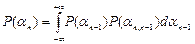 ,
,
получим:
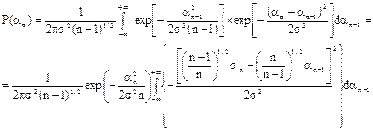 .
.
Интеграл равен:
 ,
,
Поэтому
 ,
,
где
 .
.
Если принять, что последний слой кластера характеризуется дисперсией угла 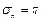 , то число молекулярных слоев в зарядовом кластере определяется выражением:
, то число молекулярных слоев в зарядовом кластере определяется выражением:
 . (1.31)
. (1.31)
В приближении сферической формы это позволяет оценить и число молекул в кластере (N):
 , (1.32)
, (1.32)
где r – плотность вещества, m – масса одной молекулы, r – ее эффективный радиус (в рассматриваемом случае – размер диполя).
Величина дисперсии s определяется двумя противоположно действующими факторами: фактором упорядочения, стабилизирующим поляризованную молекулу у электрического заряда – энергией связи молекул двух соседних слоев (u), и фактором разупорядочения – энергией теплового движения (ЕТ). Среднеквадратическое отклонение угла a1 от нуля (s) определяется отношением:
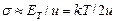 . (1.33)
. (1.33)
При расчете энергии связи (u) можно считать, что существенным является лишь осевое взаимодействие соседних молекул, поскольку это уменьшает u,увеличивает s и ограничивает сверху число молекул в кластере.
Таким образом,
 , (1.34)
, (1.34)
где mi – дипольный момент i -го диполя, r – линейный размер молекулы вещества в приповерхностном слое, e – относительная диэлектрическая проницаемость среды; e0 =8,85·10-12 (Кл·м2)/Н.
Дипольный момент поляризованной молекулы неполярного диэлектрика определяется известными соотношениями:
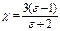 ,
,  , (1.35)
, (1.35)
где c – поляризуемость единицы объема, n0 – число молекул в единице объема, Е – напряженность электрического поля, созданного зарядом.
Для молекул кластера получим:
 , (1.36)
, (1.36)
где q – величина центрального заряда кластера, R – расстояние от центрального заряда до молекулы.
Среднее значение энергии связи 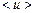 в (29, 30) определяется средним значением дипольного момента
в (29, 30) определяется средним значением дипольного момента  в (30) при R=r/2.
в (30) при R=r/2.
 , (1.37)
, (1.37)
Следовательно, 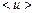 определяется (см. 1.34):
определяется (см. 1.34):
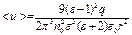 . (1.38)
. (1.38)
Таким образом, для s (см. 1.33) получим:
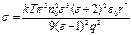 . (1.39)
. (1.39)
Для слабопроводящих жидкостей (гомологических углеводородных рядов типа СnНn, СnН2n, СnН2n+2, где n =6¸16), постоянные, входящие в условия (1.39), имеют значения [101]: e =(2-3), r @10 Å, Т @300 К, n0 @5·1026 (С8Н16).
Следовательно:
 ,
,
т. е. с точностью до порядка получим s @0,15, или n @400. Следовательно, в рамках рассматриваемой модели толщина модифицированного слоя составляет величину порядка 400 нм. В этом случае до полного модифицирования полимера для условий (1.36) и (1.37) радиус частицы-модификатора в сферическом приближении должен равняться r»25¸30 нм. Такие размеры частиц могут быть получены различными, вполне технологичными, способами диспергирования. При уменьшении радиуса частиц в S раз концентрация модификатора может быть также уменьшена в S раз. Таким образом, рассматриваемая модель объясняет действие на полимерную матрицу допинговых наномодификаторов, в т. ч. силикатсодержащих.
Зарядовые кластеры, возникшие в плазме, в газе, в жидкости, в полимере или в другой среде, могут разрушаться как за счет внешнего воздействия, так и под влиянием внутренних электрических полей. Если кластер моделировать каплей, то можно использовать приближение Релея [103-104], согласно которому устойчивость заряженной капли определяется конфигурационным действием поверхностных (Fn) и кулоновских (Fk) сил:
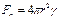 ,
,  , (1.40)
, (1.40)
где r – радиус кластера, Z – число нескомпенсированных электронов, g – коэффициент поверхностного натяжения.
При малых деформациях капельного кластера для описания его устойчивости справедливо соотношение:
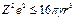 . (1.41)
. (1.41)
Если частицы вещества, в том числе и атомы, имеют сферическую форму, то для описания структуры кластера можно применить теорию шаровых упаковок с короткодействующей силой взаимодействия между частицами. Внутренний атом в такой структуре (частица) окружены 12-ю соседями, образующими первую координационную сферу. Если заполнено k координационных сфер, а радиус первой координационной сферы принять за единицу, то радиус k -той координационной сферы (rk) равен:
 .
.
Более строго радиус кластера, включающего N – атомов (при условии заполнения координационных сфер, в том числе и внешней), можно определить из условия:
 . (1.42)
. (1.42)
В выражении (1.42) параметр rw – радиус Вигнера-Зейтца, который для плотно упакованного из сферических частиц кластера, равен [105]:

 , (1.43)
, (1.43)
где m – масса атома, r – плотность вещества кластера.
Значения координационных числе (К) для различных координационных сфер (N – номер координационной сферы) приведены в табл. 1.12 [106].
Таблица 1.12
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1351; Нарушение авторских прав?; Мы поможем в написании вашей работы!