
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы термодинамики и вероятность
|
|
|
|
Процессы, изучаемые термодинамикой, рассматриваются также статистической физикой. Это рассмотрение приводит к расширению представлений о закономерностях природных процессов. Например, установлено, что процессы, невозможные по второму закону термодинамики, как то, уменьшение энтропии замкнутой системы вследствие перехода теплоты от холодного тела к нагретому, в статистической физике не являются принципиально невозможными, а только очень мало вероятными.
В теории вероятности используется понятие математической вероятности события:
 , (1.16)
, (1.16)
под которой понимается предел отношения числа «n» появлений ожидаемого события к числу опытов «N» при неограниченном возрастании этого числа.
Связь второго закона термодинамики с вероятностью установлена Л.Больцманом, постулировавшим, что энтропия пропорциональна логарифму вероятности состояния [5]:
 , (1.17)
, (1.17)
где 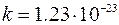 Дж/град – постоянная Больцмана,
Дж/град – постоянная Больцмана, 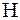 - термодинами-ческая вероятность.
- термодинами-ческая вероятность.
Термодинамическая вероятность, или вероятность состояния, - это специальный термин, обозначающий число микросостояний, то есть число распределений молекул по энергиям и по пространству, которыми может осуществляться данное макросостояние системы. Число распределений N частиц по m состояниям, то есть термодинамическая вероятность, определяется по соотношению:
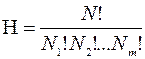 , (1.18)
, (1.18)
где  - число частиц в одном состоянии (например, условно в первой группе),
- число частиц в одном состоянии (например, условно в первой группе),  - число частиц в другом состоянии и т. д. Оговорка «условно» имеет тот смысл, что под первой (или второй) группой может подразумеваться любое из состояний. Например, три частицы имеющие номера 1,2,3 могут быть распределены по двум группам следующим образом: а) 1 и 2,3; 2 и 1,3; 3 и 1,2, б)2,3 и 1; 1,3 и 2; 1,2 и 3. Считается, что распределения а) и б) одинаковые, то есть три частицы могут быть распределены по двум группам не шестью, а тремя способами.
- число частиц в другом состоянии и т. д. Оговорка «условно» имеет тот смысл, что под первой (или второй) группой может подразумеваться любое из состояний. Например, три частицы имеющие номера 1,2,3 могут быть распределены по двум группам следующим образом: а) 1 и 2,3; 2 и 1,3; 3 и 1,2, б)2,3 и 1; 1,3 и 2; 1,2 и 3. Считается, что распределения а) и б) одинаковые, то есть три частицы могут быть распределены по двум группам не шестью, а тремя способами.
Пусть общее число частиц шесть, каждая из которых имеет свой номер (от 1 до 6) и пусть число состояний три. Вычислим значение величины 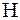 , когда, например:
, когда, например:
а)  ,
, 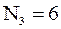 ;б)
;б) 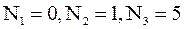 ;в)
;в) 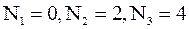
г)  ; д)
; д) 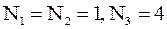 ; е)
; е)  ,
,
ж) 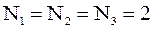
Согласно соотношению (1.18) получаем:
а) 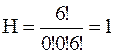 б)
б)  в)
в) 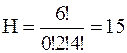 г)
г) 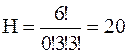 д)
д)  е)
е)  ж)
ж) 
Видно, что наибольшее значение 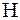 соответствует равномерному распределению частиц. Следовательно, наибольшее значение энтропии, рассматриваемое по соотношению (1.17), отвечает состоянию равновесия изолированной системы. На основании этого энтропию рассматривают ещё и как меру близости изолированной системы к состоянию равновесия.
соответствует равномерному распределению частиц. Следовательно, наибольшее значение энтропии, рассматриваемое по соотношению (1.17), отвечает состоянию равновесия изолированной системы. На основании этого энтропию рассматривают ещё и как меру близости изолированной системы к состоянию равновесия.
Философские аспекты данного положения здесь не рассматриваются, так как они выходят за рамки настоящей работы.
В предыдущем параграфе отмечалось, что второй закон термодинамики определяет направление течения и характер процессов, происходящих в природе. В статистической физике установлено, что отношение математических вероятностей двух состояний системы равно отношению их термодинамических вероятностей.
Следуя рекомендациям [5], рассмотрим следующий пример. Пользуясь соотношением (1.17), оценим по изменению энтропии двух тел, находящихся при температурах 301К и 300К, возможность перехода теплоты, то есть тепловой энергии, 1Дж от более нагретого тела к менее нагретому, а затем возможность перехода такого же количества теплоты от менее нагретого тела к более нагретому. Обозначим термодинамическую вероятность пребывания тела при Т=301К через 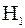 , при Т=300К через
, при Т=300К через  . Тогда в первом случае
. Тогда в первом случае
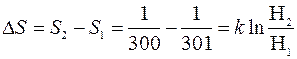
Откуда
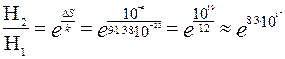
Во втором случае

Откуда
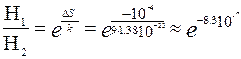
Видно, что на  случаев перехода 1Дж теплоты от тела с температурой 301К к телу с температурой 300К может произойти один случай перехода такого же количества теплоты от тела с температурой 300К к телу с температурой 301К. Число
случаев перехода 1Дж теплоты от тела с температурой 301К к телу с температурой 300К может произойти один случай перехода такого же количества теплоты от тела с температурой 300К к телу с температурой 301К. Число  очень большое. Это означает, что в обычных условиях имеет место передача тепла от горячего тела к холодному; переход тепла от холодного тела к горячему, хотя в отдельных случаях и возможен, но чрезвычайно маловероятен.
очень большое. Это означает, что в обычных условиях имеет место передача тепла от горячего тела к холодному; переход тепла от холодного тела к горячему, хотя в отдельных случаях и возможен, но чрезвычайно маловероятен.
Остановимся на возможности уменьшения энтропии замкнутой системы. Рассмотрим пример передачи очень малого количества теплоты, например,  Дж при тех же температурах тел
Дж при тех же температурах тел 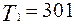 К и
К и 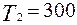 К. Расчеты показывают, что в этом случае отношение термодинамических вероятностей
К. Расчеты показывают, что в этом случае отношение термодинамических вероятностей  и
и 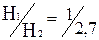 . Результат неожиданный: примерно в одной трети возможных случаев передачи такого количества теплоты оно будет происходить в направлении запрещенном вторым законом термодинамики. Можно дать следующее объяснение этому результату.
. Результат неожиданный: примерно в одной трети возможных случаев передачи такого количества теплоты оно будет происходить в направлении запрещенном вторым законом термодинамики. Можно дать следующее объяснение этому результату.
Количество теплоты  Дж – это энергия, которой могут обладать отдельные молекулы при температуре ~1000К, а к отдельным молекулам и к небольшим группам молекул ни статистические, ни термодинамические методы неприменимы.
Дж – это энергия, которой могут обладать отдельные молекулы при температуре ~1000К, а к отдельным молекулам и к небольшим группам молекул ни статистические, ни термодинамические методы неприменимы.
Следовательно, в изолированной системе, в отдельных случаях, возможны процессы, приводящие не к увеличению, а к уменьшению энтропии. Однако вероятность таких процессов в обычных земных условиях чрезвычайно мала. Вместе с тем, в других, пока недостаточно изученных условиях, которые могут иметь место во Вселенной, вероятность таких событий может быть выше. Своеобразным подтверждением этому является возникновение горячих звёзд в холодных туманностях.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 778; Нарушение авторских прав?; Мы поможем в написании вашей работы!