
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Идеальный и реальные газы. Основные газовые законы
|
|
|
|
Как отмечалось, идеальным называется газ, силы взаимодействия между частицами которого пренебрежимо малы. Уравнение состояния такого газа – уравнение Менделеева – Клапейрона (1.4).
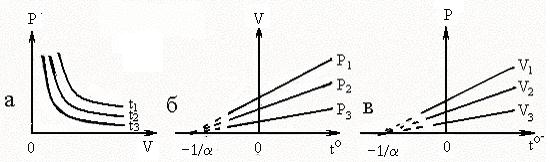
Рис.1. Изменение параметров состояния газа при изотермическом,
изобарном, изохорном процессах
Широко известные газовые законы Бойля – Мариотта и Гей – Люссака – частные случаи уравнения состояния, когда один из параметров состояния остаётся постоянным.
Например, закон Бойля – Мариотта гласит, что для данной массы газа при постоянной температуре (изотермический процесс) давление газа изменяется обратно пропорционально его объёму
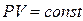 (при t°=const) (1.19)
(при t°=const) (1.19)
Совокупность состояний, отвечающих одной и той же температуре, изобразится на диаграмме (P, V) гиперболой, определяемой уравнением (1.19), рис.1а.
Закон Гей – Люссака гласит, что при неизменном давлении объём данной массы газа меняется линейно с температурой (аналогично меняется давление при неизменном объёме).
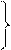
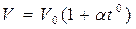 при P = const
при P = const
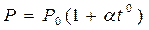 при V = const (1.20)
при V = const (1.20)
Здесь t0 – температура по шкале Цельсия, 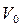 – объём при 0° С,
– объём при 0° С, 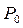 – давление при 0° С, коэффициент
– давление при 0° С, коэффициент 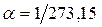 ,
, 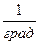 . Изобары и изохоры, отвечающие (1.20), показаны на рис. 1б и 1в.
. Изобары и изохоры, отвечающие (1.20), показаны на рис. 1б и 1в.
Из уравнения (1.20) следует, что изобары и изохоры пересекают ось t° в одной и той же точке, определяемой условием:
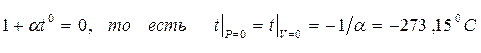
Сместив начало отсчёта температур в эту точку, можно перейти к другой температурной шкале, которую называют абсолютной (или шкалой Кельвина). Между абсолютной температурой, которую принято обозначать Т, и температурой по Цельсию t0, имеет место соотношение
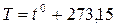 (1.21)
(1.21)
С точностью до 0,05% в практических расчётах за абсолютный ноль часто принимают температуру -273° С.
Следует пометить, что выше соотношения (1.19) и (1.20) рассматриваются как частные случаи уравнения состояния (1.4). В действительности, уравнение (1.4) получено как обобщение уравнений (1.19) и (1.20).
Перейдём к количественному определению газовой постоянной R, называемой универсальной газовой постоянной, в уравнении Менделеева – Клапейрона (1.6). Предварительно необходимо дать определение понятий килограмм – молекула и грамм – молекула.
Такое количество данного вещества, масса которого, выраженная в килограммах, численно равна его молекулярному весу, называется килограмм – молекулой или просто киломоль (обозначается кмоль).
Ранее в CGS – системе вместо килограмм – молекулы пользовались грамм – молекулой (или кратко молем), при этом грамм – молекула – такое количество вещества, масса которого, выраженная в граммах, численно равна его молекулярному весу.
В соответствии с законом, установленным Авогадро, киломоли любых газов занимают при одинаковых условиях, то есть при одинаковых температуре и давлении, одинаковый объём. Так при температуре 0° С и давлении 1 атм., называемых нормальными условиями, объём киломоля любого газа равен 22,4 м3/кмоль (аналогично объём моля любого газа равен 22,4 л/моль).
Киломоли и моли всех веществ содержат следующее число молекул: 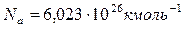 ,
, 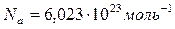 , где
, где 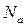 – число Авогадро.
– число Авогадро.
Величину универсальной газовой постоянной вычисляют примени-тельно к киломолю вещества, подставляя в соотношение (1.4) давление 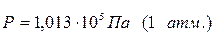 , объём V =22,4 м3, температуру Т =273,15 К.
, объём V =22,4 м3, температуру Т =273,15 К.
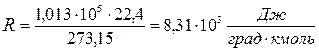
Переходя от киломоля газа к молю и от джоулей к калориям, получают
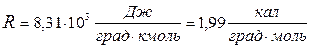
Иногда величину R выражают в литро-атмосферах на град. моль,
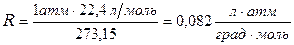
От уравнения состояния для одного киломоля нетрудно перейти к уравнению для любой массы газа m.
Уравнение (1.4) можно записать в виде
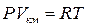 , (1.22)
, (1.22)
где 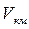 – объём одного киломоля.
– объём одного киломоля.
Объём массы газа m составит 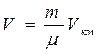 , где m – масса киломоля.
, где m – масса киломоля.
Подставляя данное соотношение в (1.20), получаем
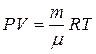 (1.23)
(1.23)
Уравнение (1.23) – уравнение состояния для любой массы газа m.
Как отмечалось, идеальный газ представляет собой определённую абстракцию, играющую важную роль при изучении термодинамических процессов. Воздух при обычных, так называемой «комнатной» температуре и атмосферном давлении, близок к идеальному газу. Близки к идеальному газу азот и кислород. Особенно близки по свойствам к идеальному газу гелий и водород. Более того, всякий реальный газ по мере убывания его плотности приближается по своим свойствам к идеальному.
Можно сказать, что поведение реальных газов описывается уравнением (1.23) при не слишком высоких давлениях и обычной температуре. Поясним сказанное на следующем примере. В приближённых расчётах допускается принимать, что радиус молекулы ~ 10-8 см [3]. При этом объём одной молекулы составит 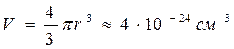 .
.
Найдём количество молекул в 1 см3 газа
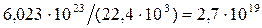
Объём молекул, содержащийся в 1см3газа, составляет
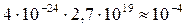 см3,
см3,
то есть сравнительно небольшую часть объёма 1 см3.
Если газ следовал бы уравнению (1.19), то при повышении давления, например, до 1000 атм. его плотность увеличилась бы в 1000 раз. Объём молекул в 1 см3 составил бы 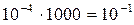 см3. Следовательно, на долю молекул приходилось бы 1/10 занимаемого газом объёма, что, несомненно, отразится на характере их движения. При таких условиях обратная пропорциональность объёма давлению должна нарушаться.
см3. Следовательно, на долю молекул приходилось бы 1/10 занимаемого газом объёма, что, несомненно, отразится на характере их движения. При таких условиях обратная пропорциональность объёма давлению должна нарушаться.
Поведение реальных газов описывается уравнением Ван – дер – Ваальса. Оно получено путём введения поправок в уравнение 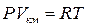 и имеет следующий вид
и имеет следующий вид
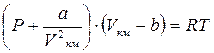 , (1.24)
, (1.24)
где a, b – константы Ван – дер – Ваальса, имеющие для различных газов свои собственные значения. При необходимости эти константы могут быть определены, например, согласно рекомендациям [3].
В качестве примера в табл. 1 проведено сопоставление значений PV и 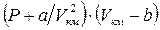 для массы азота, занимающей при нормальных условиях (Р0 = 1 атм., t =0 °C) объём, равный 22,4 литра.
для массы азота, занимающей при нормальных условиях (Р0 = 1 атм., t =0 °C) объём, равный 22,4 литра.
Таблица 1
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1323; Нарушение авторских прав?; Мы поможем в написании вашей работы!