
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закономерности растворения
|
|
|
|
560.
558.
555.
554.
553.
552.
551.
550.
549.
548.
547.
546.
545.
544.
543.
542.
541.
537.
536.
535.
533.
532.
| Дано: m(раствора)=5 кг. W%(FeSO4)= 40% | FeSO4*7H2O = FeSO4(раствор). 5 кг раствора с массовой долей FeSO4 равной 1% содержится соли: m(FeSO4) = 5000*1%/100% = 50 грамм. n(FeSO4) = m/M = 50/152 = 0.33 моль = n(FeSO4*7H2O) m(FeSO4*7H2O) = n*M = 0.33*278 = 91.74 грамм. |
| Дано: V(раствора)=1 л W%(HCl)= 30% ρ = 1.15 г.мл | Найдем массу раствора: m = V*ρ = 1000*1.15 = 1150 г. В растворе должно содержаться: m(HCl) = 1150*30%/100% = 345 грамм, m(H2O) = 1150 - 345 = 805 грамм. |
534. Способы выражения концентрации растворов: массовая, мольная и объемная доли, молярная концентрация, молярная концентрация эквивалентов, титр, моляльность. Молярная концентрация растворенного вещества - количество моль растворенного вещества, содержащееся в 1 литре раствора. Молярная концентрация эквивалента растворенного вещества - количество моль эквивалентов растворенного вещества, содержащееся в 1 литре раствора. Например, концентрация соли 1 моль/л или 1 моль-экв/л означает, что в 1 литре раствора содержится 1 моль или 1 моль эквивалентов соли.
| Дано: V(H2SO4)=500 мл. m(H2SO4) = 196 г. | n(H2SO4) = m/M = 196/98 = 2 моль nэ(H2SO4) = m/Mэ = 196/49 = 4 моль См(H2SO4) = n/V = 2/0.5 = 4 моль/л, Сн(H2SO4) = nэ/V = 4/0.5 = 8 моль-экв/л, |
| Дано: См(Al2(SO4)3)=0.1 моль/л V(раствора) = 2 литра |  m(Al2(SO4)3) = См*V*М = 0.1*2*342 = 68.4 г.
Э(Al2(SO4)3) = 6, следовательно, Сэ = 6*См = 0.6 моль-экв/л
m(Al2(SO4)3) = См*V*М = 0.1*2*342 = 68.4 г.
Э(Al2(SO4)3) = 6, следовательно, Сэ = 6*См = 0.6 моль-экв/л
|
| Дано: См(NH3) = 18 моль/л V(раствора) = 1 литр |  n(NH3) = См*V = 18*1 = 18 моль.
V(NH3) = n*Vм = 36*22.4 = 806.4 литра.
n(NH3) = См*V = 18*1 = 18 моль.
V(NH3) = n*Vм = 36*22.4 = 806.4 литра.
|
| Дано: а) Сэ(Na2CO3) = 0.25 н V(раствора) = 0.5 литра б) m(CuSO4) = 8 г. Cэ = 0.1 н |  а) nэ(Na2CO3) = Сэ*V = 0.25*0.5 = 0.125 моль-экв. Мэ(Na2CO3) = 53 г/моль-экв. m(Na2CO3) = nэ*Мэ = 0.125*53 = 6.625 г.
б) V = m/(Mэ*Cэ) = 8/(80*0.1) = 1 литр.
а) nэ(Na2CO3) = Сэ*V = 0.25*0.5 = 0.125 моль-экв. Мэ(Na2CO3) = 53 г/моль-экв. m(Na2CO3) = nэ*Мэ = 0.125*53 = 6.625 г.
б) V = m/(Mэ*Cэ) = 8/(80*0.1) = 1 литр.
|
538. Моляльность - количество моль растворенного вещества, приходящееся на 1 кг. растворителя.
| Дано: m(глицерина) = 460 г. V(воды) = 5 л. | n(глицерина) = m/M = 460/92 = 5 моль. Моляльность Сm(глицерина) = n/m(H2O) = 5 моль/5 кг = 1 моль/кг |
539. Способы выражения концентрации растворов: массовая, мольная и объемная доли, молярная концентрация, молярная концентрация эквивалентов, титр, моляльность. Титр - количество грамм растворенного вещества в 1 миллилитре раствора.
| Дано: а) См(HCl) = 0.1 м б) Сэ(H2SO4) = 0.1 н в) w%(HNO3) = 31.5% p = 1.19 г/мл. | а) Возьмем 1 литр раствора. n(HCl) = 0.1 моль. m(HCl) = n*M = 0.1*36.5 = 3.65 г. Т(HCl) = m/V = 3.65/1000 = 0.00365 г/мл. б) Возьмем 1 литр раствора. Поскольку эквивалент серной кислоты равен 2, то См(H2SO4) = 1/2Сэ(H2SO4) = 0.05 моль/л. n(H2SO4) = 0.05*1 = 0.05 моль. m(H2SO4) = n*M = 0.05*98 = 4.9 г. Т(H2SO4) = m/V = 4.9/1000 = 0.0049 г/мл в) Возьмем 1 литр раствора. Масса раствора равна V*p = 1000*1.19 = 1190 г. m(HNO3) = 1190*31.5%/100% = 374.85 г. Т(HNO3) = 374.85/1000 = 0.375 г/мл. |
| Дано: См(HNO3) = 4.65 м p = 1.15 г/мл. | Возьмем 1 литр раствора. m(раствора) = 1000*1.15 = 1150 г. m(HNO3) = См*М(HNO3)*V = 4.65*63*1 = 292.95 г. w%(HNO3) = 292.95*100%/1150 = 25.5% |
| Дано: W%(KOH) = 26 % p = 1.24 г/мл. | Возьмем 1 литр раствора. m(раствора) = 1000*1.24 = 1240 г.
m(KOH) = 1240*26%/100% = 322.4 г.
m(H2O) = 1240 - 322.4 = 917.6 г.
 = 322.4/(56*1) = 5.75 моль/л
Моляльность Cm = n(КОH)/m(H2O) = 5.75/0.9176 = 6.27 моль/кг.
Титр Т(КОН) = См*М/1000 = 5.75*56/1000 = 0.322 г/мл = 322.4/(56*1) = 5.75 моль/л
Моляльность Cm = n(КОH)/m(H2O) = 5.75/0.9176 = 6.27 моль/кг.
Титр Т(КОН) = См*М/1000 = 5.75*56/1000 = 0.322 г/мл
|
| Дано: w%(HNO3) = 36 % p = 1.22 г/мл. | а) Возьмем 1 литр раствора. m(раствора) = 1000*1.22 = 1220 г.
m(HNO3) = 1220*36%/100% = 439.2 г.
m(H2O) = 1220-439.2 = 780.8 г.
б)  = 439.2/(63*1) = 7 моль/л
в) Т.к. Э(HNO3) = 1, то Сэ = См = 7 моль-экв/л.
г) Моляльность Cm = n(HNO3)/m(H2O) = 7/0.7808 = 8.9 моль/кг.
д) Т = Сэ*Мэ/1000 = 7*63/1000 = 0.441 г/мл
е) n(H2O) = m/M = 780.8/18 = 43.4 моль.
Мольная доля N = = 439.2/(63*1) = 7 моль/л
в) Т.к. Э(HNO3) = 1, то Сэ = См = 7 моль-экв/л.
г) Моляльность Cm = n(HNO3)/m(H2O) = 7/0.7808 = 8.9 моль/кг.
д) Т = Сэ*Мэ/1000 = 7*63/1000 = 0.441 г/мл
е) n(H2O) = m/M = 780.8/18 = 43.4 моль.
Мольная доля N =  = 7/(7+43.4) = 0.14 = 7/(7+43.4) = 0.14
|
| Дано: w%(H2SO4) = 11.6 % p = 1.08 г/мл. Мэ(H2SO4) = 49 г-экв/моль | Возьмем 1 литр раствора.
m(раствора) = 1000*1.08 = 1080 г.
m(H2SO4) = 1220*11.6%/100% = 141.52 г.
 = 141.52/(49*1) = 2.9 моль-экв/л = 141.52/(49*1) = 2.9 моль-экв/л
|
| Дано: w%(NaOH) = 10 % m(раствора) = 1 кг. m(H2O) = 200 г. | m(NaOH) = m(раствора)*w%(NaOH)/100% = 1000*10/100 = 100г. В растворе было 1000-100 = 900 грамм воды, а осталось 900-200 = 700 г. m(раствора) = 700+100 = 800 грамм. w%(NaOH) = 100*100%/800 = 12.5% |
| Дано: w%(соли) = 20 % m(раствора) = 400 г. m(вещества) = 50 г. | m(соли) = m(раствора)*w%(соли)/100% =400*20/100 = 80 г. В растворе было 400-80 = 320 грамм воды. Осталось соли 80-50 = 30 г. m(раствора) = 320+30 = 350 гр. w%(NaOH) = 30*100%/350 = 8.57% |
| Дано: w%1(соли) = 30 % V(H2O) = 300 мл. w%2(соли) = 10 % | Пусть масса соли, которую необходимо добавить к воде равна х. Найдем массу воды, приходящуюся на х грамм соли:  , откуда m’(H2O) = 2.33х. Подставим х в конечную формулу для 10%-ного раствора: , откуда m’(H2O) = 2.33х. Подставим х в конечную формулу для 10%-ного раствора: 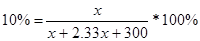 => х=45 г. => х=45 г.
|
| Дано: V1(NaCl) = 500 мл w%1(NaCl) = 20 % p1 = 1.152 г/мл w%2(соли) = 4.5 % p2 = 1.029 г/мл | А) Найдем массу сухой соли в исходном растворе: m1(раствора) = V1*p1 = 500*1.152 = 576 г. m(соли) = 576*20%/100% = 115.2 г. Б) Эта же масса соли содержится в конечном растворе: m2(раствора) = m(соли)*100%/ w%2(соли) = 115.2*100/4.5 = 2560 г. V2(раствора) = m/p = 2560/1.029 = 2488 мл. |
| Дано: w%1(КOH) = 20% w%2(КOH) = 50% m(р-ра2) = 1 кг. w%3(КOН) = 25% m(р-ра1) =? | Выразим массу чистого гидроксида калия, содержащегося в каждом из растворов: m1(КОН) = m(р-ра1)*w%1(КОН)/100% = 0.2*m(р-ра1) m2(КОН) = m(р-ра2)*w%2(КОН)/100% = 0.5 кг. m3(КОН) = m(р-ра3)*w%3(КОН)/100% = 0.25*m(р-ра3) По смыслу задачи: m1(КОН) + m2(КОН) = m3(КОН) m(р-ра1)*0.2 + 0.5 = m(р-ра3)*0.25 m(р-ра1) + 1кг = m(р-ра3) m(р-ра1)*0.2 + 0.5 = (m(р-ра1)+1)*0.25 m(р-ра1) = 5 кг. |
| Дано: w%1(Сa(NO3)2) = 10% w%2(Сa(NO3)2) = 2% m(р-ра1) = 300 г. m(р-ра2) = 500 г. w%общ(Сa(NO3)2) =? | Найдем массу чистого Сa(NO3)2, в каждом из растворов:
m1(Сa(NO3)2) = m(р-ра1)*w%1/100% = 300*10%/100% = 30 г.
m2(Сa(NO3)2) = m(р-ра2)*w%2/100% = 500*25/100% = 10 г.
w%общ(Сa(NO3)2) = 
|
| Дано: w%1(H2SO4) = 11.6% p1 = 1.08 г/мл См2 = 0.1 моль/л V2 = 250 мл. V1 =?, V(Н2О) =? | Найдем массу чистой серной кислоты, содержащейся в 0.1м растворе: m(H2SO4) = См*V*М = 0.1*0.25*98 = 2.45 г. Эта же масса кислоты содержится в 11.6%-ном растворе: m(раствора) = 2.45*100%/11.6% = 21.12 г. V(р-ра) = m/p = 21.12/1.08 = 20 мл V(Н2О) = 250-20 = 230 мл. |
| Дано: w%1(HCl) = 20% p1 = 1.10 г/мл Сн2(HCl) = 0.1 моль/л V2 = 1 л. V1 =?, V(Н2О) =? | Найдем массу чистой HCl, содержащейся в 0.1н растворе: m(HCl) = Сн*V*Мэ = 0.1*1*36.5 = 3.65 г. Эта же масса кислоты содержится в 20%-ном растворе: m(раствора) = 3.65*100%/20% = 18.25 г. V(р-ра) = m/p = 18.25/1.1 = 17 мл V(Н2О) = 1000-17 = 983 мл. |
| Дано: V(H2SO4) = 50 мл. Сн(H2SO4) =? н V(щелочи) = 25 мл. Сн(щелочи) = 0.4 н | Закон эквивалентов: Сн1*V1 = Сн2*V2
Cн(H2SO4) = 
|
| Дано: C(HCl) = 0.5н V(AgNO3) = 0.5л. Сн(AgNO3) = 0.2 н V(HCl) =? | Закон эквивалентов: Сн1*V1 = Сн2*V2
V(HCl) = 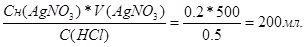
|
| Дано: V(щелочи) = 20 мл. Т(щелочи) = 0.012 г/мл V(кислоты) = 24 мл. Сн(кислоты) = 0.25 н М(щелочи) =? | Закон эквивалентов: Сн1*V1 = Сн2*V2
Cн(щелочи) = 
 , следовательно, Мэ(щелочи)=1000*0.012/0.3= 40 г/моль – это NaOH. , следовательно, Мэ(щелочи)=1000*0.012/0.3= 40 г/моль – это NaOH.
|
556.
| Дано: w%(H2SO4)=20% p = 1.10 г/мл m(Mg) = 24.3 г. V(H2SO4) =? | H2SO4 + Mg = MgSO4 + H2 n(Mg) = m/M = 24.3/24.3 = 1 моль. Согласно уравнению реакции, n(Mg) = n(H2SO4) = 1 моль. m(H2SO4) = n*M = 1*898 = 98 г. m(раствора H2SO4) = 98*100%/15% = 653.3 г. V(H2SO4) = m/p = 653.3/1.1 = 594 мл. |
557.
| Дано: w%(K2СO3)=20% V(K2СO3)=650 мл p = 1.189 г/мл С(H2SO4) =2М V(H2SO4) =? V(СO2) =? | H2SO4 + K2СO3= К2SO4 + СО2 + H2О
Найдем число моль K2СO3:
m(раствора) = V*r = 650*1/189 = 772.85 г.
m(K2СO3) = 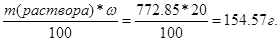 .
n(K2СO3) = m/M = 154.57/138 = 1.12 моль.
По уравнению рекции: n(K2СO3) = n(H2SO4) = n(СО2)
V(H2SO4) = n/Cm = 1.12/2 = 560 мл.
V(СО2) = n*Vm = 1.12*22.4 = 25 л. .
n(K2СO3) = m/M = 154.57/138 = 1.12 моль.
По уравнению рекции: n(K2СO3) = n(H2SO4) = n(СО2)
V(H2SO4) = n/Cm = 1.12/2 = 560 мл.
V(СО2) = n*Vm = 1.12*22.4 = 25 л.
|
| Дано: w%(NH3)=23% p =0.916 г/мл С(HСl)=6М V(HCl) = 750мл V(NH3) =? m(NH4Cl)=? | NH3 + HCl = NH4Cl –образуется хлорид аммония
n(HCl) = C*V = 6*0.75 = 4.5 моль. По уравнению реакции: n(HCl) = n(NH3) = n(NH4Cl).
m(NH4Cl) = n*M = 4.5*53.5 = 240.75 г.
m(NH3) = n*M = 4.5*17 = 76.5 г.
m(раствора NH3) =  V(NH3) = m(раствора)/ r = 332.6/0.916 = 363.1 мл.
V(NH3) = m(раствора)/ r = 332.6/0.916 = 363.1 мл.
|
559.
| Дано: V(BaCl2) = 100 мл w% = 15% V(H2SO4)= 14.4 мл Cм, Сн, Т =? | H2SO4 + BaCl2 = BaSO4 + 2HCl
Пусть плотность раствора BaCl2 = 1. Найдем n(BaCl2)
m(раствора BaCl2) = V*p = 100 г. m(BaCl2) = 100*15%/100% = 15 г.
n(BaCl2) = m/M = 15/208 = 0.0721 моль. = n(H2SO4)
Cм(H2SO4) = n/V = 0.0721/0.0144 = 5 моль/л
Сн(H2SO4) = 2См = 10 моль/л. Мэ(H2SO4) = 49 г/моль.
Т =  г/мл г/мл
|
| Дано: V(BaCl2) = 100 мл w% = 20% p =1.203 г/мл m (BaSO4)=? | 3BaCl2 + Cr2(SO4)3 = 3BaSO4 + 2CrCl3 Найдем число моль BaCl2: m(раствора BaCl2) = V*p = 100 * 1.203 = 120.3 г. m(BaCl2) = 120.3*20%/100% = 24.06 г. n(BaCl2) = m/M = 24.06 / 208 = 0.116 моль. n(BaSO4) = n(BaCl2) = 0.116 моль. m(BaSO4) = n*M = 0.116*233 = 26.9 г. |
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 803; Нарушение авторских прав?; Мы поможем в написании вашей работы!