
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химия воды
|
|
|
|
847.
800.
777.
767.
766.
764.
763.
762.
761.
760.
759.
Дано:
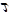 =300час =10,8*106сек.
I = 15 А. =300час =10,8*106сек.
I = 15 А.
| Последовательность выделения веществ на электродах: Катод: Cu2+ + 2e = Cu, Fe2+ + 2e = Fe, H2O + 2e = 2OH- + 1/2H2 Анод: 2Cl- - 2e = Cl2, H2O – 2e = 2H+ + 1/2O2 m = (Mэ/F)*Q, где Мэ – молярная масса эквивалента вещества, F=96500, Q – количество электричества. Мэ(Cu) = 64/2 = 32 г/моль, Мэ(Fe) = 56/2 = 28 г/моль. m(Cu) = n*M = 2*63.5 = 127 г. На восстановление меди затрачено Q = m*F/Mэ = 127*96500/32 = 3.83*105 Кл. m(Fe) = n*M = 1*56 = 56 г. На восстановление железа затрачено Q = m*F/Mэ = 56*96500/28 = 1.93*105 Кл. Всего было 10.8*106*15 = 1.62*108 Кл электричества. После восстановления железа и меди осталось 1.62*108 – 1.93*105 – 3.83*105 = 1.61*108 Кл. Оставшееся электричество пошло на восстановление водорода, окисление воды и побочные реакции. Поскольку количество воды не дано,то количество водорода учесть невозможно. |
Дано:
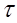 =1 час = 3600 сек.
I = 1 А.
В = 2. - валентность
m = 2.219 г. =1 час = 3600 сек.
I = 1 А.
В = 2. - валентность
m = 2.219 г.
| 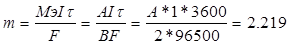 грамм.
А = 118.9 а.е.м. Это олово - Sn. грамм.
А = 118.9 а.е.м. Это олово - Sn.
|
Дано:
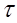 = 3 мин = 180 сек.
I = 10 А.
m = 0.554 г.
V(Cl2) = 209 мл. = 3 мин = 180 сек.
I = 10 А.
m = 0.554 г.
V(Cl2) = 209 мл.
| Найдем молярную массу металла:
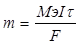 , следовательно, Мэ = , следовательно, Мэ = 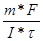 = (0.554*96487) / (10*180) = 29.7 г/моль, т.е. это олово: SnCl4 = (0.554*96487) / (10*180) = 29.7 г/моль, т.е. это олово: SnCl4
|
Дано:
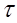 =30 мин=1800 сек.
I = 1,5 А.
m = 1.071 г.
В(Ме) = 3
Ме -? =30 мин=1800 сек.
I = 1,5 А.
m = 1.071 г.
В(Ме) = 3
Ме -?
| Найдем молярную массу металла:
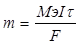 , следовательно, Мэ = , следовательно, Мэ = 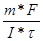 = (1.071*96487) / (1,5*1800) = 38.27 г/моль, А(Ме) = В*Мэ = 3*38.27 = 114.8 а.е.м., т.е. это индий. = (1.071*96487) / (1,5*1800) = 38.27 г/моль, А(Ме) = В*Мэ = 3*38.27 = 114.8 а.е.м., т.е. это индий.
|
Дано:
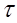 = 10 мин =600 сек.
I = 5 А.
m = 1.517 г.
Мэ(Pt)-? = 10 мин =600 сек.
I = 5 А.
m = 1.517 г.
Мэ(Pt)-?
| Найдем молярную массу металла:
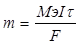 , следовательно, Мэ = , следовательно, Мэ = 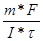 = (1.517*96487) / (5*600) = 48.8г/моль. = (1.517*96487) / (5*600) = 48.8г/моль.
|
| Дано: m(Ag) = 2.3 г. Q =?. | 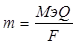 , следовательно, Q = , следовательно, Q = 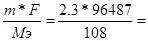 2055 Кл 2055 Кл
|
765.
Дано:
I = 3 А.
m = 1 моль.экв
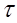 =?. =?.
| 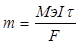 , следовательно, nэ= , следовательно, nэ= 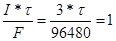
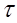 = 32160 секунд = 8.9 часов. = 32160 секунд = 8.9 часов.
|
Дано:
I = 1.5 А.
h = 0.05 мм
l = 100 м
d = 50 мм = 5 см
Вт = 90 %
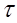 =?. =?.
| Найдем массу хромового покрытия (объем находим как разницу между объемами цилиндров): V(Сr) = V1 – V2 = l*S1 – l*S2 = l(3.14*R12 – 3.14*R22) = 10*3.14(2.5052 – 2.52) = 0.7*10-4 см3. Плотность хрома p = 7.19 г/мл, следовательно масса m(Cr) = V*p = 0.7*10-4*7.19 = 5.65*10-4 г.
Мэ(Cr) = М/Э = 52/3 = 17.33 г/моль.
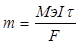 , следовательно, , следовательно, 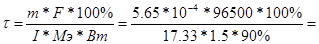 2.33 сек 2.33 сек
|
Дано:
I = 0.5 А.
h = 8 мкм
S = 2 см2
m = 1 моль.экв
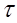 =?. =?.
| Найдем массу золотого покрытия: V(Au) = h*S = 8*10-4*2 = 1.6*10-3 см3.
m(Au) = V*p = 1.6*10-3*19.3 = 0.031 г. Мэ(Au) = М/Э = 197/3 = 65.67 г/моль.
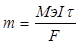 , следовательно, , следовательно, 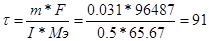 сек.
Для электролиза лучше взять растворимую комплексную соль золота K[AuCl4] сек.
Для электролиза лучше взять растворимую комплексную соль золота K[AuCl4]
|
768. Необходимо загрязненную медь растворить в азотной кислоте, а затем полученный раствор подвергнуть электролизу. При этом медь восстановится на катоде, цинк останется в растворе, а серебро останется на дне электролизера.
769. Для получения наиболее чистого нитрата калия из раствора данных солей необходимо провести электролиз. При этом на аноде восстанавливается медь: Cu2+ +2e- = Cu0. На катоде выделяется хлор: 2Cl- -2e- = Cl2. В растворе остается нитрат калия: K+ + NO3- = KNO3.
770. При обычных условиях гидролиз сульфата натрия будет протекать в электролизере:
катод: H2O + 2e = 2OH- + 1/2H2, Na+ + OH- = NaOH
анод: H2O – 2e = 2H+ + 1/2O2, SO42- + 2H+ = H2SO4
771. В зависимости от механизма, различают химическую и электрохимическую коррозии. Первая протекает, например, при взаимодействии металла с агрессивной газовой средой при высокой температуре. Вторая – при ржавлении железного гвоздя под воздействием воды и кислорода воздуха. По форме коррозионных разрушений выделяют равномерную, местную, межкристальную, растрескивающуюся и компонентно-избирательную. Любой вид коррозии ведет к разрушению металла, поэтому коррозия всегда имеет отрицательное значение.
772. Химическая коррозия – окисление металла при отсутствии электролита, не сопровождающееся возникновением электрического тока в системе. Электрохимическая коррозия – разрушение металла в среде электролита в результате взаимодействия электрохимического характера. Скорость коррозии определяется как масса разрушающегося металла в единицу времени.
773. Пассивность металла – склонность последнего к образованию на своей поверхности труднорастворимых пленок (например, оксидных, гидроксидных), препятствующих протеканию реакции. Так, при взаимодействии алюминия с кислородом воздуха, его поверхность покрывается оксидом, вследствие чего алюминий не взаимодействует с водой ни с горячей ни с холодной. Поверхность железа пассивируется концентрированной серной кислотой с образованием труднорастворимой соли, растворения железа в ней не наблюдается. Поэтому концентрированную серную кислоту хранят в железных бочках.
774. Бензин с примесью серы, сгорая, образует смесь СО2, H2O, SO2, SO3 и др. Выхлопная труба при контакте с оксидом серы подвергается химической коррозии: Fe + SO3 + H2O = FeSO4 + H2
775. Коррозия никеля в атмосфере СО является химической коррозией. Ni + 4CO = [Ni(CO)4]
776. Сильнее всего корродирует третья бочка с раствором соды поскольку наряду с электрохимической протекает еще и химическая коррозия: т.к. это раствор, то есть вода, в атмосфере присутствует кислород, а в стали есть примеси, то образуется гальвани-пара (-) Fe!H2O, O2! Cu (+). Т.к. в растворе присутствуют ионы соли, то протекает реакция – химическая коррозия: Fe + 2Na2CO3 + 3H2O + 0.5O2 = Fe(HCO3)2 + 4NaOH
В меньшей степени корродирует бочка с водой, Но т.к. вода – электролит, а в атмосфере есть кислород, то образуется аналогичная предыдущей гальвани-пара и бочка подвергается электрохимической коррозии. Наиболее сильно коррозия замедлена в случае бочки с керосином, поскольку керосин неэлектролит.
| 4Au + 6H2O + 3O2 = 4Au(OH)3 ∆Go = 4∆Go(Au(OH)3) - 6∆Go(H2O) = 4*(-477.8) + 6*241.8 = - 460.4 кДж/моль |
| 2Cu + 2H2O + O2 = 2Cu(OH)2 ∆Go = 2∆Go(Cu(OH)2) - 2∆Go(H2O) = 2*(-444.3) + 2*241.8 = - 405 кДж/моль |
| 2Mg + 2H2O + 3O2 = 2Mg(OH)2 ∆Go = 2∆Go(Mg(OH)2) - 2∆Go(H2O) = 2*(-924.7) + 2*241.8 = - 1365.8 кДж/моль |
Поскольку ∆Go всех трех реакций меньше 0, термодинамически все эти реакции возможны. Однако на практике не все термодинамические реакции осуществимы при н.у., т.к. кроме термодинамических условий существуют еще и кинетические.
778. 4OH- - 4e- = 2H2O + O2 E = 0.40В, 2Cl- - 2e- = Cl2 Е = 1.36В. Более сильным окислителем будет соляная кислота, так как ее потенциал наибольший. Fe + 2HCl = FeCl2 + H2. Если не учитывать влияние растворенного кислорода и воды, то медленнее всего коррозия железа будет протекать в растворе хлорида натрия.
779. Когда трамвай проезжает по рельсам, под ними протекает блуждающий ток. Этот ток вызывает коррозию находящихся вблизи металлических конструкций:
| (-)Fe(металлическая конструкция)|H2O, O2|Fe(рельс)(+) (-): Fe(металлическая конструкция) - 2e- = Fe2+ (+): 2H2O + O2 = 4OH- 2Fe + 2H2O + O2 = 2Fe(OH)2 |
780. Больше пострадала та часть гвоздя, которая находилась в дереве.
| (-)Fe(внутри дерева)|H2O, O2|Fe(снаружи дерева)(+) (-): Fe(внутри дерева) - 2e- = Fe2+ (+): 2H2O + O2 = 4OH- 2Fe + 2H2O + O2 = 2Fe(OH)2 |
781. Fe + 2HCl = FeCl2 + H2, сжатая пружина имеет большую внутреннюю энергию из-за деформации решетки. Ионам железа требуется меньше затрат энергии для выхода из решетки в раствор. Следовательно, сжатая пружина раствориться быстрее. При замене нити на медную проволоку образуется гальванический элемент и скорость растворения увеличивается:
(-)Fe|HCl|Cu(+), (-): Fe -2e- = Fe2+ , (+) 2H+ +2e- = H2
782. Как при контакте меди с оловом, так и при контакте железа с оловом, образуется гальванический элемент, в котором один из металлов становится анодом и начинает корродировать. Олово активнее меди, но менее активно, чем железо, поэтому в случае самовара корродирует олово, а в случае котелка – железо.
| (-)Fe(котелок)|H2O,O2|Sn(+) (-): Fe -2e- = Fe2+ (+): 2H2O + O2 = 4OH- 2Fe + 2H2O + O2 = 2Fe(OH)2 | (-)Sn|H2O,O2|Cu(самовар)(+) (-): Sn -2e- = Sn2+ (+): 2H2O + O2 = 4OH- 2Sn + 2H2O + O2 = 2Sn(OH)2 |
783. От коррозии лучше защищать будет то покрытие, которое при нарушении будет корродировать само, т.е. будет иметь меньший электродный потенциал, чем железо. Еo(Fe2+/Fe) = -0.44 В, Еo(Zn2+/Zn) = -0.76 В, Еo(Sn2+/Sn) = -0.14 В, Еo(Cr3+/Cr) = -0.74 В, Еo(Cd2+/Cd) = -0.40 В, Еo(Ni2+/Ni) = -0.25 В. Наиболее надежно будет защищать цинк, т.к. его потенциал наименьший. По убыванию степени защиты: Zn>Cr>Cd>Ni>Sn.
784. Алюминий более активен, поэтому он будет корродировать в кислотной среде. (-) Al | H+ | Cu (+). E = Eo(Cu2+/Cu) - Eo(Al3+/Al) = 0.34 + 1.66 = 2 В. ∆Go = -z*F*E = -6*96480*2 = -1157.8 кДж/моль
785. (-)Fe|Н2О, О2|C(+)
(–) Fe – 2e- = Fe2+;
(+) 2H2O + O2 = 4OH-
2Fe + 2H2O + O2 = 2Fe(OH)2
786. а) анод (-)Al|HCl|Fe (+) катод, Al –3e- =Al3+, 2H+ +2e- = H2, 2Al(OH)3 = 2AlCl3 + 3H2
б) анод (-)Al|KOH|Fe (+) катод, Al –3e- =Al3+, 2ОН- +4е- = 2Н2О + О2, Al + KOH + H2O = K3[Al(OH)6] + H2
787. При коррозии железа и алюминия образуются соответственно гидроксиды: Fe(OH)3, Al(OH)3, наличие которых на поверхности металла снижает скорость коррозии. При растворении гидроксидов скорость коррозии увеличивается. Гидроксид железа хорошо растворяется в кислотах, а гидроксид алюминия в щелочах, поэтому коррозия железа интенсивно протекает в кислой среде, а коррозия алюминия – в щелочной.
788. При помещении гвоздя в раствор серной кислоты начинает протекать реакция: Fe + H2SO4 = FeSO4 + H2. При добавлении к раствору сульфата меди, медь, реагируя с железом, выделяется на поверхности гвоздя (CuSO4 + Fe = Cu + FeSO4) и образуется гальванический элемент, в котором медь выступает в роли инертного катода: (-)Fe|FeSO4||CuSO4|Cu(+). В результате реакция железа с кислотой ускоряется – увеличивается интенсивность выделения водорода. При добавлении в раствор фосфорной кислоты катионы железа и меди связываются в нерастворимые фосфаты, которые оседают на поверхность гвоздя – реакция железа с кислотой прекращается.
789. При контакте меди с алюминием образуется гальванический элемент, в котором алюминий является анодом, а медь – катодом. Несмотря на то, что алюминий активнее меди и должен корродировать, этого не происходит, т.к. поверхность алюминия всегда покрыта прочной пленкой оксида, не позволяющей протекать коррозии. Поэтому в месте контакта корродирует медь.
790. Несмотря на то, что электродный потенциал алюминия меньше, чем цинка и алюминий должен легче коррозировать чем цинк, этого не происходит. На воздухе алюминий покрывается плотной пленкой оксида, которая предотвращает процесс коррозии. Поэтому цинк лучше защищает железо, чем алюминий. При нарушении покрытия образуются гальванические элементы:
| (-)Zn|H2O, O2|Fe (+) |
| (-)Fe|H2O, O2|Al (+) |
791. Цинковое покрытие не выдерживает высокого термического расширения, которое возникает при стрельбе из автомата. Воронение – нанесение на сталь оксидных пленок. Пленки образуются непосредственно на поверхности металла в результате высокотемпературного окисления или погружения стали в горячие концентрированные растворы щелочей, содержащих персульфаты, перхлораты, нитраты металлов.
792. Механизм действия значительного числа ингибиторов заключается в адсорбции ингибитора на корродирующей поверхности и последующем торможении катодных или анодных процессов К анодным замедлителям можно отнести нитрит натрия, дихромат натрия. К катодным замедлителям относятся органические вещества, содержащие азот, серу и кислород, например, уротропин, формальдегид, тиокрезол. Защита от коррозии с помощью пассиваторов заключается в равномерном нанесении пассиватора на поверхность металла, для отделения ее от агрессивной атмосферы. Примером такой защиты служит воронение, анодирование, покрытие лаками, красками, эмалями.
793. В кислой среде потенциал водорода уменьшается и становится меньше потенциала свинца, поэтому серную и соляную кислоты можно перекачивать по свинцовым трубопроводам. Азотная кислота окисляет свинец и ее нельзя перекачивать по свинцовым трубам.
795. Для протекторной защиты металл выбирается так, чтобы его стандартный электродный потенциал был меньше, чем потенциал металла, из которого состоит защищаемая конструкция. Электрический ток в катодной защите подают для того, чтобы защищаемая конструкция стала катодным участком в образующейся цепи.
796. Стальной протектор удается сделать анодом при пропускании через всю буровую установку постоянного электрического тока. В результате защищаемая конструкция становится катодом и не корродирует. Такая защита называется катодной.
797. Корпус корабля является одной цельной деталью, поэтому протектор защищает весь корпус. В противоположность корпусу корабля, корпус автомобиля состоит из множества деталей, находящихся в плохом контакте друг с другом. Для катодной защиты автомобиля потребовалось бы к каждому элементу корпуса прикрепить протектор, что не выгодно. Поэтому наиболее оптимальной защитой корпуса от коррозии являются покрытия: оцинковка, хромирование, эмали, лаки, мастики.
798. Уротропин является катодным замедлителем коррозии, который уменьшает скорость коррозии за счет снижения интенсивности катодного процесса или сокращения площади катодных участков. Взаимодействие ржавчины с соляной кислотой:Fe(OH)3 + 3HCl = FeCl3 + 3H2O.
799. Из-за высокой цены золота, купола церквей покрывают более дешевыми материалами, сходными по цвету с золотом (SnS2, TiN). Однако эти вещества не столь долговечны, как золото, поэтому покрытие приходится часто обновлять.
Дано:
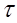 = 30 сек. I = 100А.
D = 9 мм.
S = 20 см2
р = 7.6 г/см3
100 трамваев/сутки = 30 сек. I = 100А.
D = 9 мм.
S = 20 см2
р = 7.6 г/см3
100 трамваев/сутки
| А) Найдем объем железа V = D*S = 0.9*20 = 18 см3
Б) Масса железа равна m = V*p = 18*7.6 = 136.8 грамм
Г) 1 трамвай разрушает 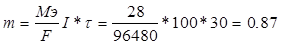 г. Fe
Д) Труба прослужит 136.8/(0.87*100) = 1.5 суток г. Fe
Д) Труба прослужит 136.8/(0.87*100) = 1.5 суток
|
831. чистое (ч), чистое для анализа (ч.д.а.), химически чистое (х.ч.), особо чистое (ос.ч.).
832. Увеличение степени чистоты вещества: техническое (т) – чистое (ч) – чистое для анализа (ч.д.а.) – химически чистое (х.ч.) – особо чистое (ос.ч.) – спектрально чистое.
833. Газообразные вещества очищают от примесей следующими способами:фильтрация (от твердых примесей), адсорбция (при пропускании через газа адсорбент, поглощающий определенные примеси) и др.
834. Для очистки водорода от данных примесей потребуется колонка заполненная порошком меди (очистка от кислорода), склянка со спиртом (поглощение H2S), колонка с ангидроном (осушение водорода).
835. От примесей воды углекислый газ можно очистить при помощи ангидрона, а взвесь MnO2 очистит газ от SO2.
836. Аммиак от примесей СО2 можно отчистить аскаритом, а от воды при помощи ангидроном.
837. Наиболее полная осушка воздуха достигается во второй колонке, поскольку в ней конденсированная вода не может проникать дальше по трубе (как в первой и третьей колонке) и пар распределен равномерно по объему трубы, а не в какой-то ее части (как в третьей колонке).
838. От взвешенных примесей воду очищают фильтрацией, а от растворимых примесей воду можно очистить дистилляцией, ионным обменом, электроосмосом и др.
839. Растворимые в воде вещества очищают от примесей перекристаллизацией: на первой стадии растворяют загрязненное вещество: нерастворимые примеси отфильтровывают. На второй стадии раствор можно пропустить через ионит для отделения растворимых примесей, после чего воду выпаривают, получая чистое вещество.
840. Металлы от примесей очищают следующими способами и методами: зонная плавка, разложение летучих соединений, выжигание горючих примесей, электролиз и др.
841. Очистка меди электролизом - достаточно дорогой процесс, ее используют, когда нужно получить особо чистый металл. Электролитом служит сульфат меди CuSO4. На аноде: Cu2+ +2e -= Cu0. На катоде: H2O - 2e- = 2H+ + 1/2O2. Содержавшиеся примеси - железо и цинк - остаются в растворе, а серебро и золото осаждаются на дно электролизера.
842. С помощью приведенной реакции возможно извлечь цирконий (и другие металлы) из руды, переведя его в газообразное соединение, которое, отделив от остальной смеси, можно разложить до чистого металла с очень высокой степенью чистоты. Данный метод очистки металлов называется «разложение летучих соединений».
843. Получаемое соединение называется тетракарбонил никеля(0). С помощью приведенной реакции возможно извлечь никель (и другие металлы) из руды, переведя его в газообразное соединение, которое, отделив от остальной смеси, можно разложить до чистого металла с очень высокой степенью чистоты. Данный метод очистки металлов называется «разложение летучих соединений».
844. Получение особо чистых веществ методом зонной плавки заключается в следующем: смесь веществ помещают в колонну, которую нагревают до плавления веществ. Плавясь, вещества разделяются на слои (зоны), причем существуют зоны с большим содержанием загрязнений, и зоны с чистым веществом, которое извлекают из колонны. Метод основан на зависимости взаимной растворимости веществ от температуры.
845. Адсорбционные и ионообменные методы очистки веществ основаны на явлении адсорбции – накоплении одной фазы на поверхности другой фазы. Эти методы используют, например, при очистке воды от ионов на катионитах и анионитах, очистке воздуха от газов активированным углем и т.п.
846. Для обнаружения элементов или ионов в качественном анализе используются качественные реакции на группы ионов и на отдельные ионы. Например на катионы третьей аналитической группы (Be2+, Al3+, Cr3+, Fe2+, Fe3+, Co2+, Zn2+, Ni2+ и др.) имеется групповой реактив NaOH. При действии этого группового реактива на данные ктаионы образуются окрашенные в различные цвета гидроксиды: белые Be(OH)2, Ti(OH)4, Zr(OH)4, Mn(OH)2, Al()OH)3, Zn(OH)2, зеленые Cr(OH)3, Fe(OH)2, Ni(OH)2, бурокрасный Fe(OH)3, розовый Co(OH)2, черные Mn(OH)4, Ni(OH)3, Co(OH)3, желтый UO2(OH)2. Селективные реакции для Fe3+:
а) 4Fe3+ + 3[Fe(CN)6]4+ = Fe4[Fe(CN)6]3 – темно-синий осадок
б) Fe3+ + 3SCN- = Fe(SCN)3 – кроваво-красный цвет
| № аналитич. группы | катионы | Групповой реагент |
| I (хлоридная) | Hg2+ , Ag+ , Pb2+ | HCl |
| II (сульфатная) | Ba2+, Ca2+, Sr2+ | H2SO4 |
| III(гидроксидная) | Fe2+, Fe3+, Mn2+, Co2+ | NaOH |
| IV (амфолитная) | Al3+, Zn2+, Cr3+, Sn2+ | NaOH (избыток) |
| V (аммиачная) | Cu2+, Ni2+ | NH4OH |
| VI | Na+, K+, NH4+ | Нет |
На катионы VI аналитической группы нет группового реагента, т.к. трудно подобрать такой реагент, который осаждал все эти катионы в виде осадков.
848. Анионы делятся на 3 аналитических группы: анионы первой аналитической группы (SO42-, CO32-, PO43-, SiO32-, SO32-, S2O32-), групповой реактив - BaCl2. Анионы второй аналитической группы (Cl-, Br-, I-, S2- и др.), групповой реактив - AgNO3 . Анионы третьей группы: NO3-, NO2- и др, группового реагента нет.
849. а) Катионы первой аналитической группы (Са2+, Sr2+, Ba2+, Ra2+). Групповой реактив - NaOH, H2SO4. При действии щелочи выпадают белые аморфные осадки гидроокисей. При действии серной кислоты образуются белые кристаллические осадки сульфатов. Катионы второй аналитической группы (Be2+, Al3+, Fe2+, Ni2+ и др.). Групповой реактив - NaOH. При действии щелочи выпадают окрашенные осадки гидроокисей.
Са2+ + 2ОН- = Са(ОН)2
Sr2+ + H2SO4 = SrSO4 + 2H+
Ni2+ + 2OH- = Ni(OH)2 и т.п.
850. Катионы третьей аналитической группы (Be2+, Al3+, Cr3+, Fe2+, Fe3+, Co2+, Zn2+, Ni2+ и др.): групповой реактив NaOH. При действии группового реактива на данные ктаионы образуются окрашенные в различные цвета гидроксиды: белые Be(OH)2, Ti(OH)4, Zr(OH)4, Mn(OH)2, Al()OH)3, Zn(OH)2, зеленые Cr(OH)3, Fe(OH)2, Ni(OH)2, бурокрасный Fe(OH)3, розовый Co(OH)2, черные Mn(OH)4, Ni(OH)3, Co(OH)3, желтый UO2(OH)2. Примеры:
| Fe3+ + 3OH- = Fe(OH)3 | Co3+ + 2OH- = Co(OH)2 | Zr4+ + 4OH- = Zr(OH)4 |
Катионы второй аналитической группы (Hg2+, Cu2+, Bi3+, Cd2+, Pd2+, Sn2+, Sn4+, As3+ и др.): групповой реактив NaOH. При действии группового реактива на данные ктаионы образуются окрашенные в различные цвета гидроксиды: белые Sn(OH)2, Cd(OH)2, Bi(OH)3, краснобурые Au(OH)3, Pd(OH)2, сине-черный Ir(OH)3, Ir(OH)4 и др. Образующийся гидроксид ртути разлагается на желтую окись и воду. Примеры:
| Hg2+ + 2OH- = Hg(OH)2 = HgO + H2O | Cu3+ + 2OH- = Cu(OH)2 | Sn4+ + 4OH- = Sn(OH)4 |
851. Пятая аналитическая группа катионов (группа серебра): Ag+, Hg22+, Pb2+ и др. При добавлении к растворам группового реактива аммиака происходят следующие реакции:
| Ag+ + NH4OH = AgOH + NH4+, 2AgOH = Ag2O(бурый) + H2O, Оксид серебра растворяется в избытке аммиака Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]OH |
| Hg22+ образует черный осадок металлической ртути при реакции с аммиаком: Hg2Cl2 + 2NH4OH = ClHgNH2 + Hg + NH4Cl + 2H2O. |
| Pb2+ при действии аммиака дает белый осадок Pb(OH)2 нерастворимый в избытке осадителя |
852. а) Анионы первой аналитической группы (SO42-, CO32-, PO43-, SiO32-, SO32-, S2O32-). Групповой реактив - BaCl2, AgNO3. Анионы второй аналитической группы (Cl-, Br-, I-, S2- и др.). Групповой реактив - AgNO3 (бариевые соли растворимы в воде). При действии групповых реагентов данные анионы осаждаются в виде осадков.
| SO42- + Ba2+ = BaSO4- белый | CO32 + Ba2+ = BaCO3 - белый | SiO32 + Ba2+ = BaSiO3- белый |
| Cl- + Ag+ = AgCl - белый | I- + Ag+ = AgI - желтый | S2- + Ag+ = Ag2S - черный |
В третью группу собраны специфические анионы, поэтому на анионы этой группы нет группового реактива.
853. Из всех хлоридов металлов только два выпадают в осадок – Pb2+ + 2Cl- = PbCl 2 и Ag+ + Cl- = AgCl – это хлорид свинца и хлорид серебра
В аммиаке растворяется AgCl: AgCl + 2NH3 = [Ag(NH3)2]Cl.
854. Раствор содержит Pb2+. Pb2+ + 2Cl- = PbCl2. Хлорид свинца растворим в горячей воде.
855. Это Ni2+: Ni2+ + 2OH- = Ni(OH)2 - зеленый. Ni(OH)2 + Br2 + 4OH- = 2Ni(OH)3 + 2Br- - черно-бурый.
856. Данным катионом является Cr3+. 2Cr(OH)3 + 3NaBiO3 + 4HNO3 = Na2Cr2O7 = NaNO3 + 3Bi(NO3)3 + 2H2O.
857. Трехвалентное железо можно обнаружить по реакции: 4Fe3+ +3[Fe(CN)6]4- = Fe4[Fe(CN)6]3- темно-синий, либо Fe3+ + 3CNS- = Fe(CNS)3 - красный.
858. Катион Fe3+ можно обнаружить по следующим реакциям:
а) 4Fe3+ + 3[Fe(CN)6]4+ = Fe4[Fe(CN)6]3 – темно-синий осадок
б) Fe3+ + 3SCN- = Fe(SCN)3 – кроваво-красный цвет
859. С помощью Na3[Co(NO2)6] – гексанитрокобальтата(III) натрия определяют ионы калия:
2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6] ↓ + 2 NaCl
2K+ + Na+ + [Co(NO2)6]3- = K2Na[Co(NO2)6] ↓
860. С помощью данной реакции можно обнаружить катион натрия: NaCl + K[Sb(OH)6] = Na[Sb(OH)6] + KCl. Выпадает белый кристаллический осадок комплексной соли натрия.
861. Молекула воды: H2O. Геометрия: угловая, т.к. гибридизация центрального атома - sp3, атом кислорода имеет 2 неподеленных электронных пары. Расположение электронных пар в пространстве: тетраэдрическое.
Связи в молекуле ковалентные полярные, механизм образования: стр.270, скорик
Масовые доли кислорода и водорода равны:
возьмем 1 моль воды, тогда ее масса равна: m(H2O) = n*M = 1*18 =18 г. Содержание водорода и кислорода: n(H2) =2 моль, n(O2) = 1моль.
m(H2) = n*M = 2*1 = 2 г. w%(H)=m(H)*100% / m(H2O) = 2*100 / 18 = 11.11%
m(O) = n*M = 1*16 = 16 г. w%(O)=m(O)*100% / m(H2O) = 16*100 / 18 = 88.89%
Молекула полярна, т.к. полярность обуславливается разными электроотрицательностями элементов. У водорода э.о. равна 2.1, а у кислорода 3.5. Дипольный момент молекулы равен 6.07*10-29 Кл*м.
862. В отличие от молекул сероводорода, между молекулами воды существуют водородные связи, которые обусловливают более высокую температуру кипения воды, по сравнению с H2S. При кристаллизации воды образуется структура льда, которая характеризуется наличием пустот, из-за чего плотность воды больше плотности льда. Эта аномалия является причиной разрушения горных пород, а также искусственных сооружений, в которых может замерзать вода.
863. В состав тяжелой воды, в отличие обычной Н2О, входит изотоп водорода дейтерий D2O. Содержание тяжелой воды в обычной составляет 0.002%. Получают тяжелую воду многократной дистилляцией воды.
864. Вода является хорошим растворителем по нескольким причинам: молекула воды имеет небольшие размеры и дипольный момент. Кроме того, молекула воды может выступать в роли лиганда в комплексных соединениях. Т.к. при растворении веществ разрушаются старые связи в кристаллических решетках и образуются новые между частицами растворенного вещества и молекулами воды, то процесс растворения практически всегда сопровождается тепловыми эффектами и другими явлениями, характерными для химических реакций.
865. Химические свойства воды определяются ее химическим строением: наличием неподеленных пар электронов и значительной полярностью молекулы. Вода является реакционноспособным веществом. Она может быть восстановителем, окислителем, функционировать в качестве лиганда в комплексных соединениях. В воде растворимо большинство кислот, оснований и солей. Вода является катализатором ряда химических процессов, в ее отсутствие многие вещества не взаимодействуют химически.
| H2O + 2Na = Na2O +H2 | H2O + O3 = H2O2 + O2 |
| H2O + KH = KOH + H2 | H2O + SO3 = H2SO4 |
| H2O + CaO = Ca(OH)2 | H2O + C = HCOH |
866. Вода – Н2О. Молекула полярная, т.к. гибридизация кислорода sp3 и форма молекулы угловая. Вода может выступать в роли окислителя, восстановителя, лиганда в комплексных соединениях и т.п. Вода является растворителем для многих соединений.
| 2H2O + 2K = 2KOH + H2 | H2O + F2 |
| 2H2O + CaH2 = Ca(OH)2 + 2H2 | 3H2O + P2O5 = 2H3PO4 |
| H2O + BaO = Ba(OH)2 | H2O + CH4 = CH3OH + H2 |
867. Гидролиз
| ZnCl2 + H2O = ZnOHCl + HCl | Al2S3 + 6H2O = 2Al(OH)3 + 3H2S |
| Na2CO3 + H2O = NaHCO3 + NaOH | SiCl4 + 4H2O = Si(OH)4 + 4HCl |
868. Природные воды – растворы сложного состава c широким диапазоном по числу и составу компонентов. Они включают в себя неорганические вещества (ионы K, Ca, Na, Mg, Fe, Cl, NO3, SO4, СО3 и др.), органические вещества (фенолы, нефти, пестициды и др.), а также органоминеральные вещества как природного, так и техногенного происхождения. Эти вещества находятся в воде как в истинно растворенном, так и в виде коллоидов и взвесей.
Пробоподготовка вод проводится с целью определения качества воды, содержания в ней примесей. Она состоит из следующих стадий: отбор пробы, консервирование, анализ.
869. В процессе водоподготовки воду осветляют и обескремнивают следующими методами: а) радиационные (гамма-излучение), б) осаждение, ионный обмен, экстракция, в) фильтрация, дистилляция, вымораживание, электродиализ, электроосмос.
870. Кислород, растворенный в воде, вызывает коррозию металла трубопроводов станций, тепловых сетей. Парогенераторов электростанций. Поэтому он должен быть удален из воды. Удаление кислорода осуществляют 1)деаэрацией: уменьшением растворимости кислорода за счет снижения его парциального давления над жидкостью, что достигается путем уменьшением общего давления газа или вытеснением данного газа другим газом. 2)химическим восстановление, например, с помощью гидразина: при взаимодействии кислорода с гидразином образуется азот и вода.
871. Жесткость воды обусловлена наличием в ней растворимых солей кальция, магния, железа: нитратов, хлоридов, гидрокарбонатов и др. Бывает временная(карбонатная) и постоянная жесткость. Временная обусловлена наличием в воде гидрокарбонатов кальция Са(НСО3)2 и магния Mg(НCO3)2, постоянная – наличием хлоридов, нитратов, сульфатов: MgSO4, MgCl2, Fe(NO3)2, и т.д. Общая жесткость воды равна сумме постоянной и временной жесткостей. Постоянную жесткость удаляют только химическим путем, временную можно удалить еще и физически – кипячением: Т
Са(НСО3)2 = СаСО3 + СО2 + Н2О.
Химический путь состоит в переводе этих солей в труднорастворимые соединения:
Са(НСО3)2 + Са(ОН)2 = 2 СаСО3 + Н2О, FeCl3 + Na3PO4 = FePO4 + 3NaCl.
Физико- химический способ основан на пропускании воды через ионообменные смолы, где происходит обмен ионами: Na2R + Ca2+ = CaR + 2Na+, где R – радикал полимерной цепи ионообменника.
872. Жесткость воды измеряется в ммоль . экв/литр. V(H2O) = 0.2 литра, m(CaCO3) = 3.2 мг. Мэ(СаСО3) = М/Э = 100/2 = 50 г/моль. Ж = 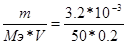 = 0.32 ммоль . экв/литр.
= 0.32 ммоль . экв/литр.
873. Cн1*V1 = Cн2*V2. Ж = 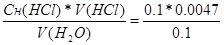 = 4.7 мэкв/л
= 4.7 мэкв/л
874. Мэ(Na2CO3)=106/2 = 53 г/моль. 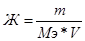 , следовательно,
, следовательно, 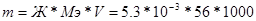 = 296.8 грамм.
= 296.8 грамм.
875. Состав природных вод зависит от их вида и расположения водоема или источника воды. Воды рек обычно имеют невысокое солесодержание: 0.5-0.6 г/л. Более высоким солесодержанием обладают подземные воды. Содержание солей в водах океанов и открытых морей примерно одинаково и составляет 35 г/л. Солесодержание внутренних морей ниже, чем океанов. Например, солесодержание Каспийского моря 3-13 г/л, а Черного моря 17-18 г/л. Обессоливание:
а) Химическое обессоливание воды заключается в последовательной многократной обработке воды в Н-катионитовых и ОН-анионитовых фильтрах. Примеси остаются на ионитах.
б) Ионный метод обессоливания. Ионный обмен протекает на ионитах, представляющих собой твердые полиэлектролиты, у которых ионы одного знака заряда закреплены на твердой матрице, а ионы противоположного знака заряда способны переходить в раствор и заменяться на другие ионы того же знака заряда.
876. Граница между металлами и неметаллами в ПС проходит в общем направлении от бериллия к астату, между элементами бор-алюминий, кремний-германий, мышьяк-сурьма, теллур-полоний. В периоде металлические свойства убывают слева направо, а в группе – снизу вверх. Это связано с изменением радиуса атома элементов. Т. к. металлы – элементы, для которых энергетически выгодно отдавать электроны, то делают они это тем легче, чем дальше от ядра находятся валентные электроны, т.е. чем больше радиус атома. В периоде радиус атома увеличивается слева направо, а в группе – сверху вниз.
877. На легкие и тяжелые металлы разделяются по массе атома: самый легкий – литий, самый тяжелый (из нерадиоактивных) – висмут. По реакционной способности металлы делятся на активные, среднеактивные и малоактивные: наиболее активен франций, наименее активна платина. С самой высокой температурой плавления – вольфрам, с самой низкой температурой плавления – ртуть.
878. Металлические сплавы делятся на три основных типа: замещения, внедрения и вычитания. В сплавах замещения атомы растворенного металла замещают в узлах решетки атомы металла-растворителя. В сплавах внедрения атомы растворенного металла внедряются в междоузлия металлической решетки растворителя. Сплавы вычитания образуются при выпадении атомов из объема решетки.
879. Наиболее общее свойство металлов – способность отдавать электроны в процессе реакции. Внешние электроны металлов удерживаются значительно слабее, чем в атомах неметаллов, поэтому атомы металлов имеют низкие потенциалы ионизации и выступают в качестве восстановителей.
2Na + 2H2O = 2NaOH + H2 , Na0 –1e- = Na+1 , 2Fe + 6HCl = 2FeCl3 + 3H2 , Fe0 –3e- = Fe+3.
880. Металлы отличаются от неметаллов большими радиусами атомов и меньшей заполненностью валентных оболочек. Эти особенности обусловливают легкость отрыва электронов от атомов металлов (восстановительные свойства).
| С неметаллами: 4Al + 3O2 = 2Al2O3 | C водой: 2Na + 2H2O = 2NaOH + H2 |
| Со щелочами: 2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2 | С кислотами: 2K + 2HCl = 2KCl + H2 |
| С солями: Fe + CuSO4 = FeSO4 + Cu |
881. При реакции металла с водой из газов может выделиться только водород. Vэ(Н2) = 11.2 л. Закон эквивалентов: 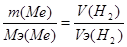 . Мэ(Ме) = 15.6*11.2/4.48 = 39 г/моль. Т.к. валентность металла равна 1, то атомная масса его равна 39 а.е.м. Это калий.
. Мэ(Ме) = 15.6*11.2/4.48 = 39 г/моль. Т.к. валентность металла равна 1, то атомная масса его равна 39 а.е.м. Это калий.
882. Электрохимический ряд напряжений металлов составлен в зависимости от того, насколько активно они отдают в растворе свои электроны, т.е. вступают в электрохимическую реакцию. Ряд напряжений имеет вид: …К….Са…..Мg….Zn….Fe….Sn….H…..Cu…Ag….Au… Свойства: 1)каждый металл способен вытеснять из солей все другие, расположенные правее его в ряду напряжений; 2) металлы, расположенные в ряду левее Н, вытесняют его из кислот; правее – не вытесняют; 3)чем дальше находятся друг от друга два металла, тем большее напряжение будет давать построенный из них гальванический элемент.
883. Более активные металлы вытесняют менее активные из их солей.
| Zn + 2HCl = ZnCl2 + H2 | Ag + HCl = реакция не идет, т.к. серебро менее активно, чем водород |
| Zn + FeSO4 = ZnSO4 + Fe | Cu + FeSO4 = реакция не протекает, т.к. железо активнее меди |
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 495; Нарушение авторских прав?; Мы поможем в написании вашей работы!