
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические источники энергии 1 страница
|
|
|
|
708.
707.
706.
705.
704.
703.
702.
690.
689.
680.
679.
678.
677.
676.
675.
664.
646.
645.
644.
643.
642.
641.
640.
639.
638.
637.
636.
635.
630.
629.
628.
625.
| Дано: m(NaIOH) = 2 г. V(раствора)= 1л. pH, pOH -? | См(NaOH) = m/(M*V) = 2/(40*1) = 0.05 моль/л рОН = -lg[OH-] = -lg0.05 = 1.3 pH = 14 – pOH = 14 – 1.3 = 12.7 |
626. Степнь диссоциации азотной кислоты (a) составляет 82 %, следовательно [H+] = a*Cм = 0.82*1 = 0.82 моль/л. рН = -lg[H+] = -lg[0.82] = 0.086. рОН = 14 – рН = 13.914.
627. СН3СООН = СН3СОО - + Н+ .Кд = 1.754*10-5 , С(СН3СООН) = 0.1 моль/л, [H+] = [CH3COO-] = х,  , х2 = 1.754*10-6 , х = [H+] = 1.32*10-3 моль/л.
, х2 = 1.754*10-6 , х = [H+] = 1.32*10-3 моль/л.
рН = -lg[H+], pH = -lg1.32*10-3 = 2.9, pOH = 14 – pH = 14 – 2.9 = 11.1
| Дано: V(NH3) = 2.24 л V(H2O) = 1 л. pH, pOH -? | Количество аммиака n(NH3) = V/Vм = 2.24/22.4 = 0.1 моль, следовательно, концентрация См(NH3) = n/V = 0.1/1 = 0.1 моль/л.
Найдем концентрацию ОН-групп в растворе: степень диссоциации аммиака равна 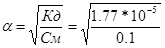 =0.013. [OH-] = a*См = 0.013*0.1 = 1.33*10-3 моль/л. рОН = -lg[OH-] = 2.9, pH = 14 – pOH = 11.1 =0.013. [OH-] = a*См = 0.013*0.1 = 1.33*10-3 моль/л. рОН = -lg[OH-] = 2.9, pH = 14 – pOH = 11.1
|
| Дано: V(HNO3) = 1 л Cм(HNO3) = 1м m(NaOH) = 38 г. рH -? | HNO3 + NaOH = NaNO3 + H2O Определим количества обоих соединений: n(NaOH) = m/M =38/40 = 0.95 моль. n(HNO3) = Cм*V = 1 моль. В растворе останется 1 – 0.95 = 0.05 моль азотной кислоты, т.е. [H+] = 0.05 моль. pH = -lg[H+] = 1.3 |
| Индикатор | Окраска | В среде | рH, при котором Изменяется окраска |
| Кислой | Щелочной | ||
| Лакмус | Красный | Синий | 6,0-7,0 |
| Фенолфталеин | Бесцветный | Малиновый | 8,0-10,0 |
| Метиловый оранжевый | Желтый | Красный | 3,1-4,4 |
631. ПР рассчитывается, как произведение растворимостей ионов, где растворимость – концентрация вещества в его насыщенном растворе. Зная растворимость, можно рассчитать ПР, и наоборот. Трифосфат серебра диссоциирует: Ag3PO4 = 3Ag+ + PO4 -3, тогда
S 3*3.8*10-5 3.8*10-5, n(AgNO3) = m/M = 6.5*10-3 / 170 = 3.8*10-5 моль/л.
Тогда ПР будет S3 (Ag+)*S (PO4-3) = 1.3*10 –20 .
632. ПР рассчитывается, как произведение растворимостей ионов, где растворимость – концентрация вещества в его насыщенном растворе. Зная растворимость, можно рассчитать ПР, и наоборот. Иодид свинца диссоциирует PbI2 = Pb 2+ + 2I -, тогда
S 6,5*10-4 2*6,5*10-4,
Тогда ПР будет S(Pb2+)*S2(I-) = 8,45*10-7
633. Ag2CO3 = 2Ag+ + CO32-
ПР(Ag2CO3) = 6.15*10-12. ПР(Ag2CO3) = [Ag+]2*[CO32-] = (2S)2*S = 4S3. S - растворимость. 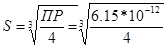 = 1.15*10-4 моль/л. Коэффициент растворимости выражается в граммах вещества, растворяющегося в 100 граммах воды. В одном литре воды растворяется 1.15*10-4 моль соли, следовательно, в 100 граммах растворится S = 1.15*10-4*М(Ag2CO3)/10 = 1.15*10-4*276/10 = 0.003 г/100г.
= 1.15*10-4 моль/л. Коэффициент растворимости выражается в граммах вещества, растворяющегося в 100 граммах воды. В одном литре воды растворяется 1.15*10-4 моль соли, следовательно, в 100 граммах растворится S = 1.15*10-4*М(Ag2CO3)/10 = 1.15*10-4*276/10 = 0.003 г/100г.
634. Zn(OH)2 = Zn2+ + 2OH-
ПР(Zn(OH)2) = 4.0*10-16. ПР(Zn(OH)2) = [Zn2+]*[OH-]2 = S*(2S)2 = 4S3. S - растворимость. 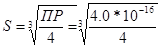 = 4.64*10-6 моль/л. [Zn2+] = S = 4.64*10-6 моль/л, [OH-]= 2S = 2*4.64*10-6 = 9.28*10-6 моль/л.
= 4.64*10-6 моль/л. [Zn2+] = S = 4.64*10-6 моль/л, [OH-]= 2S = 2*4.64*10-6 = 9.28*10-6 моль/л.
| Дано: ПР(FeS) = 3.7*10-19 m(FeS) = 1г. V(H2O) =? | Найдем растворимость (S)данной соли: ПР(FeS) = [Fe2+]*[S2-] = S2, следовательно, S = 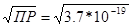 = 6.08*10-10 моль/л, т.е. в одном литре воды растворится 6.08*10-10 моль FeS. n(FeS) = m/M = 1/88 = 0.011 моль.
V(H2O) = n/S = 0.011/6.08*10-10 = 1.7*107 литров = 6.08*10-10 моль/л, т.е. в одном литре воды растворится 6.08*10-10 моль FeS. n(FeS) = m/M = 1/88 = 0.011 моль.
V(H2O) = n/S = 0.011/6.08*10-10 = 1.7*107 литров
|
| Дано: ПР(AgBr)=6.3*10-13 m(AgBr) = 1г. V(H2O) =? | Найдем растворимость (S)данной соли: ПР(AgBr) = [Ag+]*[Br -] = S2, следовательно, S =  = 7.94*10-7 моль/л, т.е. в одном литре воды растворится моль 7.94*10-7 AgBr. n(AgBr) = m/M = 1/188 =5.3*10-3 моль.
V(H2O) = n/S = 5.3*10-3 / 7.94*10-7 = 6.7*103 литров = 7.94*10-7 моль/л, т.е. в одном литре воды растворится моль 7.94*10-7 AgBr. n(AgBr) = m/M = 1/188 =5.3*10-3 моль.
V(H2O) = n/S = 5.3*10-3 / 7.94*10-7 = 6.7*103 литров
|
| Дано: ПР(MgS) = 2*10-15 Cн(Mg(NO3)2) = 4*10-3 н Cн(Na2S) = 6*10-4 н | ПР = [Mg2+]*[S2-] При смешивании двух растворов одинакового объема их концентрация уменьшается в два раза: [Mg2+] = ½Cн(Mg(NO3)2) = 1/4Cм(Mg(NO3)2) = 1/4*0.0004 = 0.0001 моль/л [S2-] = 1/2Cн(Na2S) = 1/4Cн(Na2S) = 1/4*6*10-4 = 1.5 *10-4 моль/л [Mg2+]*[S2-] = 0.0001*0.00015 = 1.5*10-8 < ПР, следовательно, осадок не выпадет. |
| Дано: Cм(Cd(NO3)2) = 10-3 м Cм(Na2CO3) = 0.1 м ПР(CdCO3) = 2.5*10-14 | ПР = [Cd2+]*[CO32-] При смешивании двух растворов одинакового объема их концентрация уменьшается в два раза: [Cd2+] = Cм(Cd(NO3)2) = ½*0.001 = 0.0005 моль/л [CO32-] = Cм(Na2CO3) = ½*0.1 = 0.05 моль/л [Cd2+]*[CO32-] = 0.0005*0.05 = 2.5*10-5 >> ПР, следовательно, осадок выпадет. |
| Дано: ПР(BaCO3) = 7*10-9 ПР(PbCO3) = 1.5*10-13 [Ba2+] / [Pb2+] =? | XCO3 = X2+ + CO32-, ПР = [X2+]*[CO32-]
 ; ;  , [CO32-]1 = [CO32-]2
[Ba2+]/[Pb2+] = ПР(BaCO3)/ПР(PbCO3) = 7*10-9/1.5*10-13 = 4.6*104 , [CO32-]1 = [CO32-]2
[Ba2+]/[Pb2+] = ПР(BaCO3)/ПР(PbCO3) = 7*10-9/1.5*10-13 = 4.6*104
|
| Дано: ПР(BaCrO4) = 2.3*10-10 ПР(SrCrO4) = 3.6*10-5 [Ba2+] = 5*10-4 моль/л [Sr2+] = 5*10-1 моль/л | XCO3 = X2+ + CO32- ПР = [X2+]*[CrO42-], [CrO42-] = ПР/[X2+] Найдем концентрацию CrO42-- ионов, необходимую для выпадения осадков: а) [CrO42-] = ПР(BaCrO4)/[Ba2+] = 2.3*10-10/5*10-4 = 4.6*10-7 моль/л б) [CrO42-] = ПР(SrCrO4)/[Sr2+] = 3.6*10-5/5*10-1 = 7.2*10-5 моль/л Поскольку для выпадения осадка SrCrO4 требуется меньшая концентрация CrO42-, то он выпадет первым |
| А) Na2S + 2HCl = 2NaCl + H2S S2- + 2H+ = H2S – бесцветный газ | В) Sn(OH)4 + 2H2SO4 = Sn(SO4)2 + 4H2O Sn(OH)4 + 4H+ = Sn2+ + 4H2O |
| Б) Pb(NO3)2 + 2NaI = PbI2 + 2NaNO3 Pb2+ + 2I- = PbI2 – желтый осадок | Г) Sn(OH)4 + 2KOH = K2[Sn(OH)6] Sn(OH)4 + 2OH- = [Sn(OH)6]2- |
| А) Ba(OH)2 + 2HCl = BaCl2 + 2H2O 2OH- + 2H+ = 2H2O | В) Al(OH)3 + 3HNO3 = Al(NO3)3 + 3 H2O 3OH- + 3H+ = 3H2O |
| Б)NaHSO4 + NaOH = Na2SO4 + H2O HSO4- + 2OH- = SO42- + H2O | Г) Al(OH)3 + 3KOH = K3[Al(OH)6] Al(OH)3 + 3OH- = [Al(OH)6]3- |
| a) CaCO3 + 2HCl = CaCl2 + H2O + CO2 Ca2+ + 2H+ = H2O + CO2 | Б) Na2S + FeSO4 = FeS + Na2SO4 S2- + Fe2+ = FeS |
| B) Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] Zn(OH)2 + 2OH- = [Zn(OH)4]2- | Г) Zn(OH)2 + 2HCl = ZnCl2 + 2H2O 2OH- + 2H+ = 2H2O |
| Hg2+ + S2- = HgS | CO32- + 2H+ = H2O + CO2 |
| HgCl2 + K2S = HgS + 2KCl Hg(NO3)2 + H2S = HgS + 2HNO3 | Na2CO3 + 2HCl = 2NaCl + H2O + CO2 (NH4)2CO3 + 2HNO3 = 2NH4NO3 + H2O + CO2 |
| Ca2+ + SiO32- = CaSiO3 | Al(OH)3 + 3OH- = [Al(OH)6]3- |
| CaCl2 + Na2SiO3 = CaSiO3 + 2NaCl Ca(NO3)2 + K2SiO3 = CaSiO3 + 2KNO3 | Al(OH)3 + 3NaOH = Na3[Al(OH)6] Al(OH)3 + 3KOH = K3[Al(OH)6] |
| 2NO2- + 2H+ = NO + NO2 + H2O | Ag+ + Br- = AgBr |
| 2KNO2 + 2HCl = NO + NO2 + 2KCl + H2O 2NH4NO2 + 2HCN = NO + NO2 + 2NH4Cl + H2O | AgNO3 + KBr = AgBr + KNO3 AgNO3 + NaBr = AgBr + NaNO3 |
647. Реакция протекает в сторону более слабого электролита, т.е. в сторону образования вещества с наименьшей ПР, Кд, Кн
| а) 2AgCl + Na2CrO4 = Ag2CrO4 + 2NaCl, ПР(Ag2CrO4) = 1.1*10-12< ПР(AgCl) = 1.73*10-10, следовательно реакция протекает в сторону образования Ag2CrO4 |
| б) H2S + 2KNO2 = 2HNO2 + K2S, Кд(HNO2) = 6.9*10-4> Кд(H2S) = 1.0*10-7, следовательно реакция протекает в сторону образования сероводорода. |
| в) [HgBr4]2- + 4Cl- = [HgCl4]2- + 4Br -, Кн([HgCl4]2 -)=8.5*10-16 > Кн([[HgBr4] ]2-) = 2.0*10-22, следовательно реакция протекает в сторону образования [HgBr4]2- |
648. Реакция протекает в сторону более слабого электролита, т.е. в сторону образования вещества с наименьшей ПР, Кд, Кн
| а) Ba3(PO4)2 + 3Na2SO4 = BaSO4 + 2Na3PO4, ПР(Ba3(PO4)2) = 6*10-39 < ПР(BaSO4) = 1.1*10-10, следовательно реакция протекает в сторону образования фосфата бария. |
| б) NH4OH + HCl = NH4Cl + H2O, Кд(NH4OH) = 7.5*10-14 > Кд(H2O) = 1*10-14, следовательно реакция протекает в сторону образования воды. |
| в) [Cu(Cl)4]2- + 4CN- = [Cu(CN)4]2- + 4Cl- Кн([Cu(Cl)4]2-)=6.3*10-6> Кн([Cu(CN)4]2-) = 5*10-28, следовательно реакция протекает в сторону образования [Cu(Cl)4]2- |
649. Реакция протекает в сторону более слабого электролита, т.е. в сторону образования вещества с наименьшей ПР, Кд, Кн
| а) Cd(OH)2 + Na2CO3 = CdCO3 + 2NaOH ПР(Cd(OH)2) = 2.2*10-14 < ПР(CdCO3) = 1.0*10-12, следовательно реакция протекает в сторону образования гидроксида кадмия |
| б) CH3COOH + NaCN = CH3COONa + HCN Кд(CH3COOH) = 1.74*10-5 > Кд(HCN) = 5*10-10, следовательно реакция протекает в сторону образования HCN |
| в) [Zn(OH)4]2- + 4CN- = [Zn(CN)4]2- + 4OH- Кн([Zn(OH)4]2-) = 3.6*10-16 > Кн([Zn(CN)4]2-)=1.3*10-17, следовательно реакция протекает в сторону образования [Zn(CN)4]2- |
650. Реакция протекает в сторону более слабого электролита, т.е. в сторону образования вещества с наименьшей ПР, Кд, Кн
| а) CaSO4 + Na2CO3 = CaCO3 + Na2SO4 ПР(CaSO4) = 2.5*10-5 > ПР(CaCO3) = 3.8*10-9, следовательно реакция протекает в сторону образования карбоната кальция |
| б) Fe(OH)3 + 3NH4Cl = FeCl3 + 3NH4OH ПР(Fe(OH)3) = 6.3*10-29 < Кд(NH4OH) = 1.8*10-5, следовательно реакция протекает в сторону образования гидроксида железа |
| в) [Ni(NH3)4]2+ + 4CN- = [Ni(CN)4]2- + 4NH3 Кн([Ni(NH3)4]2+) = 1.12*10-8 < Кн([Ni(CN)4]2-) = 1.8*10-14, следовательно реакция протекает в сторону образования [Ni(CN)4]2- |
Глава 4.5. Гидролиз солей
651. Гидролиз солей – процесс, обратный реакции нейтрализации, т.е. взаимодействие соли с водой, приводящее к образованию малодиссоциирующих соединений. Типы гидролиза: по катиону (Cu(NO3)2, AlCl3), по аниону (K2CO3, Na2SO3), по обоим ионам одновременно (Al2S3, Ni(CN)2).Гидролиз по катиону и аниону протекают обычно только по первой ступени и являются обратимыми, в то время как гидролиз одновременно по катиону и анионы - необратимая реакция, т.к. она протекает до конца.
652. Гидролиз солей – процесс, обратный реакции нейтрализации, т.е. взаимодействие соли с водой, приводящее к образованию малодиссоциирующих соединений. Образование слабых электролитов – причина протекания гидролиза.
| KNO2 + H2O = HNO2 + KOH NO2- + H2O = HNO2 + OH- | Гидролиз по аниону, среда раствора щелочная |
| CuCl2 + H2O = CuOHCl + HCl Cu2+ + H2O = CuOH+ + H+ | Гидролиз по катиону, среда раствора кислотная |
| Na3AsO4 + H2O = Na2HAsO4 + NaOH AsO4-3 + H2O = HAsO4-2 + OH- | Гидролиз по аниону, среда раствора щелочная |
| Al2S3 + 6H2O = 2Al(OH)3 + 3H2S 2Al3+ + 3S2- + 6H2O = 2Al(OH)3 + 3H2S | Гидролиз по катиону и аниону, среда практически нейтральная |
653. Гидролиз солей – процесс, обратный реакции нейтрализации, т.е. взаимодействие соли с водой, приводящее к образованию малодиссоциирующих соединений.
| K2CO3 + H2O = KHCO3 + KOH CO32- + H2O = HNO2 + OH- | Гидролиз по аниону, среда раствора щелочная |
| NaAlO2 + H2O = NaOH + Al(OH)3 AlO2- + H2O = HAlO2 + OH- | Гидролиз по аниону, среда раствора щелочная |
| (NH4)2SO4 + H2O = 2NH4OH + H2SO4 NH4+ + H2O = NH4OH + H+ | Гидролиз по катиону, среда раствора кислотная |
| Cr2S3 + 6H2O = 2Cr(OH)3 + 3H2S 2Cr3+ + 3S2- + 6H2O = 2Cr(OH)3 + 3H2S | Гидролиз по катиону и аниону, среда практически нейтральная |
654. Гидролиз солей – процесс, обратный реакции нейтрализации, т.е. взаимодействие соли с водой, приводящее к образованию малодиссоциирующих соединений.
| NH4CN + H2O = HCN + NH4OH NH4+ + CN - + H2O = HCN + NH4OH | Гидролиз по катиону и аниону, среда практически нейтральная |
| K3PO4 + H2O = K2HPO4 + KOH PO4-3 + H2O = HPO4-2 + OH- | Гидролиз по аниону, среда раствора щелочная |
| Pb(NO3)2 + H2O = Pb(OH)NO3 + HNO3 Pb+2 + H2O = PbOH+ + H+ | Гидролиз по катиону, среда раствора кислотная |
| Fe2S3 + 6H2O = 2Cr(OH)3 + 3H2S 2Fe + + 3S2- + 6H2O = 2Fe(OH)3 + 3H2S | Гидролиз по катиону и аниону, среда практически нейтральная |
655. Гидролиз солей – процесс, обратный реакции нейтрализации, т.е. взаимодействие соли с водой, приводящее к образованию малодиссоциирующих соединений.
| NH4NO3 + H2O = NH4OH + HNO3 NH4+ + H2O = NH4OH + H+ | Гидролиз по катиону, среда раствора кислотная |
| Na2S + H2O = NaOH + H2S S-2 + H2O = H2S + OH- | Гидролиз по аниону, среда раствора щелочная |
| FeCl3 + H2O = Fe(OH)Cl2 + HCl Fe+2 + H2O = FeOH+ + H+ | Гидролиз по катиону, среда раствора кислотная |
| Al2(CO3)3 +6H2O = 2Al(OH)3 + 3H2CO3 2Al3++3CO32+6H2O=2Al(OH)3+3H2CO3 | Гидролиз по катиону и аниону, среда практически нейтральная |
656. Гидролиз солей – процесс, обратный реакции нейтрализации, т.е. взаимодействие соли с водой, приводящее к образованию малодиссоциирующих соединений.
| CH3COOK + H2O = CH3COOH + KOH CH3COO - + H2O = CH3COOH + OH - | Гидролиз по аниону, среда раствора щелочная |
| Ba(CN)2 + 2H2O = Ba(OH)2+ 2HCN 2CN - + 2H2O = 2HCN + 2OH- | Гидролиз по аниону, среда раствора щелочная |
| 2ZnSO4 + 2H2O = (ZnOH)2SO4 + H2SO4 2Zn+2 + 2H2O = 2ZnOH+ + 2H+ | Гидролиз по катиону, среда раствора кислотная |
| Al(NO2)3 +6H2O = Al(OH)3 + 3HNO2 Al3++3NO2-+6H2O=Al(OH)3+ 3HNO2 | Гидролиз по катиону и аниону, среда практически нейтральная |
657. С позиции химической термодинамики, гидролиз – процесс, обратный реакции нейтрализации, т.е. взаимодействие соли с водой, приводящее к образованию малодиссоциирующих соединений. Чем слабее образующийся электролит, тем полнее гидролизуется соль. А) Из солей KF и KNO2 полнее гидролизуется первая соль, т.к. константа диссоциации HF (6.2*10-4) меньше константы диссоциации HNO2 (6.9*10-4). Б) Соль CH3COONH4 гидролизуется полнее, т.к. она представлена двумя слабыми электролитами (CH3COOН и NH4ОН) и гидролизуется необратимо, в то время как соль CH3COONа представлена анионом слабой кислоты и катионом сильного основания, т.е. гидролизуется только по аниону.
| KNO2 + H2O = KOH + HNO2 NO2- + H2O = HNO2 + OH- среда щелочная | KF + H2O = KOH + HF F- + H2O = HF + OH- среда щелочная |
| CH3COONa + H2O = CH3COOH + NaOH CH3COO- + H2O = CH3COOH + OH- щелочная | CH3COONH4 + H2O = CH3COOH + NH4OH нейтр- CH3COONH4 + H2O = CH3COOH + NH4OH- альная |
658. С позиции химической термодинамики, гидролиз – процесс, обратный реакции нейтрализации, т.е. взаимодействие соли с водой, приводящее к образованию малодиссоциирующих соединений. Чем слабее образующийся электролит, тем полнее гидролизуется соль. А) Из солей KCN и KClO полнее гидролизуется первая соль, т.к. константа диссоциации HCN (5*10-10) меньше константы диссоциации HClO (3*10-8). Б) Соль BeCl2 гидролизуется полнее, чем MgCl2 т.к. Be(OH)2 – более слабое основание, чем Mg(OH)2
| KCN + H2O = KOH + HCN CN- + H2O = HCN + OH- среда щелочная | KClO + H2O = KOH + HClO ClO- + H2O = HClO + OH- среда щелочная |
| MgCl2 + H2O = Mg(OH)Cl + HCl Mg2+ + H2O = MgOH+ + H+ среда кислотная | BeCl2 + H2O = Be(OH)Cl + HCl Be2+ + H2O = BeOH+ + H+ среда кислотная |
659. С позиции строения вещества, гидролиз – процесс, обратный реакции нейтрализации, т.е. взаимодействие соли с полярными молекулами воды. Диполи воды окружают молекулы соли, что приводит к поляризации и диссоциации молекул соли. Чем больше поляризующее действие катиона и поляризуемость аниона, тем сильнее гидролизуется соль. Т.к. поляризующее действие и поляризуемость сильно зависят от радиуса и заряда иона, то соль гидролизуется тем сильнее, чем больше заряд и меньше радиус катиона и меньше заряд и больше радиус аниона. А) Полнее гидролизуется FeCl3, а не FeCl2 т.к. в первой соли заряд катиона железа выше. Б) Na2CO3 гидролизуется менее полно, чем Na2SiO3, т.к. размеры аниона SiO32- больше, чем аниона CO32-.
| FeCl2 + H2O = Fe(OH)Cl + HCl Fe2+ + H2O = FeOH+ + H+ среда кислотная | FeCl3 + H2O = Fe(OH)Cl2 + HCl Fe3+ + H2O = FeOH+2 + H+ среда кислотная |
| Na2СO3 + H2O = NaHCO3 + NaOH CO32- + H2O = HCO3- + OH- cреда щелочная | Na2SiO3 + H2O = NaHSiO3 + NaOH SiO32- + H2O = HSiO3- + OH- cреда щелочная |
660. Гидролиз – процесс, обратный реакции нейтрализации, т.е. взаимодействие соли с полярными молекулами воды. Диполи воды окружают молекулы соли, что приводит к поляризации и диссоциации молекул соли. Чем больше поляризующее действие катиона и поляризуемость аниона, тем сильнее гидролизуется соль. Т.е. гидролиз протекает за счет разрыва ионных связей соли и образования связей между ионами соли и диполями воды.
| KNO2 + H2O = KOH + HNO2 NO2- + H2O = HNO2 + OH- | Гидролиз по аниону, среда раствора щелочная |
| Na2СO3 + H2O = NaHCO3 + NaOH CO32- + H2O = HCO3- + OH- | Гидролиз по аниону, среда раствора щелочная |
| Fe(NO3)3 + H2O = Fe(OH)(NO3)2 + HNO3 Fe3+ + H2O = FeOH2+ + H+ | Гидролиз по катиону, среда кислотная |
661. Ступенчатый гидролиз наблюдается, когда соль образована многоосновными кислотами или многокислотными основаниями. Число ступеней определяется степенью основности кислоты (основания). Степень гидролиза, как правило,от первой ступени к последней уменьшается, т.к. константы диссоциации кислот и оснований падают, например, Н3РО4: Ка1>Ka2>Ka3. В две ступени идет гидролиз FeCl2 + H2O = FeOHCl + HCl (1), FeOHCl + H2O = Fe(OH)2 + HCl
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 364; Нарушение авторских прав?; Мы поможем в написании вашей работы!