
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов
|
|
|
|
590.
589.
588.
587.
586.
585.
584.
583.
582.
581.
580.
579.
578.
577.
576.
575.
574.
573.
572.
571.
570.
569.
568.
567.
566.
564.
563.
562.
561.
| Дано: m(NH4Cl) = 10 г. V(Н2О) = 233 мл. ∆T = -2.8oC Суд = 4.2 Дж/(г*К) | n(NH4Cl) = m/M = 10*53.5 = 0.19 моль.
Qраств(NH4OH) = m(раствора)*∆Т*Cуд = (10+233)*2.8*4.2 = -2.86 кДж
∆Hoраств = 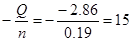 кДж/моль. кДж/моль.
|
| Дано: m(NaOH) = 10 г. V(Н2О) = 250 мл. ∆Hoраств(NaOH) =?. ∆Т = 6.7оС Суд = 4.2 Дж/(г*К) |
n(NaOH) = m/M = 10*40 = 0.25 моль.
Qраств(NaOH) = m(раствора)*∆Т*Cуд = (10+250)*6.7*4.2 = 7.32 кДж
∆Hoраств = 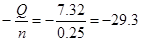 кДж/моль. кДж/моль.
|
| Дано: m(CaCl2) = 10 г. Q = 6.82 кДж m(CaCl2*6H2O) = 10г. Q = -0.87 кДж ∆Hoгидр(СaCl2) =? | n(CaCl2) = m/M = 10/111 = 0.09 моль. ∆Hoраств(CaCl2) = -Q/n = -6.82/0.09 = -75.7 кДж/моль n(CaCl2*6Н2О) = m/M = 10/219 = 0.046 моль. ∆Hoраств(CaCl2*6Н2О) = -Q/n = 0.87/0.046 = 19.05 кДж/моль ∆Hoгидр(СaCl2) = ∆Hoраств(CaCl2) - ∆Hoраств(CaCl2*6Н2О) = -94.75 кДж/моль |
| Дано: ∆Hoраств(CuSO4*5H2O)=11.72 кДж/моль. V(Н2О) = 0.2 литра. ∆Т = 2оС Суд = 4.2 Дж/(г*К) m(CuSO4) = 4 г. | n(CuSO4) = m/M = 4/160 = 0.025 моль Q = m(раствора)*∆Т*Cуд = (200+4)*2*4.2 = 1.71 кДж ∆Hoраств(CuSO4) = -Q/n = – 1.71/0.025 = -68.5 кДж/моль ∆Hoгидр(СuSO4) = ∆Hoраств(CuSO4) - ∆Hoраств(CuSO4*5Н2О) = -68.5 – 11.72 = -80.22 кДж/моль |
565.
| Дано: ∆Hoрастворения(NH4NO3)=26.32 кДж/моль. V(Н2О) = 0.2 литра. ∆Т = 5оС Суд = 3.77 Дж/(г*К) m(NH4NO3) =? | Qраств(NH4NO3) = m(H2O)*∆Т*Cуд = 200*5*3.77 = 3.77 кДж
n = 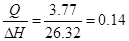 моль.
m(NH4NO3) = n*M = 0.14*80 = 11.46 грамм. моль.
m(NH4NO3) = n*M = 0.14*80 = 11.46 грамм.
|
| Дано: m(H2O) = 25 г m(NaCl) = 8,75 г S -? | Решение: 8,75 г NaCl – 25 г Н2О х г NaCl - 100 г Н2О х = 8,75*100/25 = 35 г NaCl/100г Н2О |
| Дано: V(Н2О) = 50 мл. n(Zn(NO3)2) = 0.003 моль | m(Zn(NO3)2) = n*M = 0.003*189 = 0.567 г.
Растворимость S = 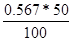 = 1.13 г/100 г воды = 1.13 г/100 г воды
|
| Дано: w(K2Cr2O7) = 45.2%. S -? | Возьмем 100 г раствора: m(K2Cr2O7) = 45.2 г, m(H2O) = 100 –45.2 = 54.8 г.
Растворимость S = 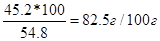
|
| Дано: S (KNO3) = 31.6 г/100 г w -? | Возьмем раствор, в котором m(KNO3) = 31.6 г, тогда m(H2O)=100 г.
w (KNO3) = 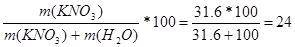 % %
|
| Дано: S (KNO3) = 55 г/100 г m(р-ра) = 60 г. m (KNO3) -? |
w (KNO3) = 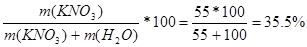 %
В 60 г раствора: m(KNO3) = (60*35.5) / 100 = 21.3 г. %
В 60 г раствора: m(KNO3) = (60*35.5) / 100 = 21.3 г.
|
| Дано: S1(K2CO3)= 155 г/100г S2(K2CO3)= 111 г/100г m(раствора) = 770 г. | Найдем, сколько грамм соли содержится в 770 граммах раствора при 100оС. m1(K2CO3) = 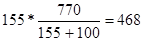 грамм, следовательно воды в растворе содержится 770 – 468 = 302 грамма. Найдем, сколько соли может растворится в 302 г. воды при 00С: m2(K2CO3) = грамм, следовательно воды в растворе содержится 770 – 468 = 302 грамма. Найдем, сколько соли может растворится в 302 г. воды при 00С: m2(K2CO3) = 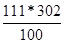 =335г.
Т.е. при охлаждении из раствора выделится 468 – 335 = 133 гр. соли. =335г.
Т.е. при охлаждении из раствора выделится 468 – 335 = 133 гр. соли.
|
| Дано: S1(Pb(NO3)2)= 90 г/100г S2(Pb(NO3)2)= 46 г/100г V(H2O) = 200 мл T = 200C | При 60оС в 200г воды растворяется m1(Pb(NO3)2) = 90*200/100 = 180г При 0оС в 200г воды растворяется m1(Pb(NO3)2) = 46*200/100 = 92 г. В осадок выпадет m1-m2 = 180 – 192 = 92 грамма соли. |
| Дано: Т1 = 100оС, Т2 = 20оС S1(NaNO3) = 176 г/100г S2(NaNO3) = 88 г/100г m(NaNO3) = 120 г. | Найдем массовую долю соли в растворе при обеих температурах: w1% = 176*100%/(176+100) = 63,8%; w2% = 88*100%/(88+100) = 46,8% Пусть m1(р-ра) = х, m2(р-ра) = у, m1(NaNO3) = z, m2(NaNO3) = k. По условию: х-у = 120, z-k = 120 грамм. x = z*100%/w1% = z*1.57, y = k*100%/w2% = k*2.14. Получаем систему уравнений: z*1.57 – k*2.14 = 120иz-k =120. Решая ее, получаем х = 357,4 грамм; z = 228 грамм. |
| Дано: S(H2S) = 2.91 P = 101325 Па T = 200C W%(CO2) =? | В одном литре воды растворяется 2.91 литра H2S.
m(H2O) = 1000 г.
n(H2S) = V/Vм = 2.91/22.4 = 0.13 моль
m(H2S) = n*M = 0.13*34 = 4.42 г.
w%(H2S) = 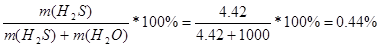
|
| Дано: S(CO2) = 0.878 P =? W%(CO2) = 1 % | В одном литре воды растворяется 0.878 литр диоксида углерода. m(H2O) = 1000 г. n(CO2) = V/Vм = 2.91/22.4 = 0.13 моль m(CO2) = n*M = 0.13*44 = 5.72 г. |
| Дано: W%(C12H22O11) = 10% Т = 100оС Ро = 101.3*105 Па Р’ =? | Ро - Р’ = Ро 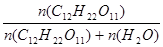 Возьмем 1 кг раствора. m(C12H22O11) = 100 г.
n(C12H22O11) = m/M = 100/342 = 0.292 моль
m(H2O) = 1000-100 = 900 г.
n(H2O) = 900/18 = 50 моль.
101.3*105 - Р’ = 101.3*105
Возьмем 1 кг раствора. m(C12H22O11) = 100 г.
n(C12H22O11) = m/M = 100/342 = 0.292 моль
m(H2O) = 1000-100 = 900 г.
n(H2O) = 900/18 = 50 моль.
101.3*105 - Р’ = 101.3*105 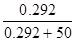 Р’=1.007*105 Па = 755.6 мм.рт.ст. Р’=1.007*105 Па = 755.6 мм.рт.ст.
|
| Дано: Р0 = 8199.325 Па V(H2O) = 540 мл m(C6H12O6) = 1 г. P’ =? | Po - P’ = P0*N(C6H12O6)
n(H2O) = m/M = 540/18 = 30 моль.
n(С6H12O6) = m/M = 36/180 = 0.2 моль.
8199.325 - P’ = 8199.325* 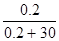 , следовательно, P’ = 8145.025 Па , следовательно, P’ = 8145.025 Па
|
| Дано: Р0 = 23939.35 Па P’ = 21854.4 Па m(ацетона) = 200 г. m(неэлект.)=10.5 г. М =? | Po - P’ = P0*N2
n(ацетона) = m/M = 200/58 = 3.45 моль.
.
23939.35 – 21854.4 = 23939.35*  , следовательно, n (неэлектр.) = 0.329 моль, М(неэлектр.) = m / n = 10.5 / 0.329 = 32 г/моль. , следовательно, n (неэлектр.) = 0.329 моль, М(неэлектр.) = m / n = 10.5 / 0.329 = 32 г/моль.
|
| Дано: Р0 = 47375 Па P’ = 33310 Па n(в-ва) = 1 n(H2O) =? | Po - P’ = P0*N(вещества) => 47375 - 33310 = 47375* 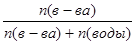 1+n(H2O) = 3.37 => n(H2O) = 2.37 моль.
1+n(H2O) = 3.37 => n(H2O) = 2.37 моль.
|
| Дано: w(С2Н5ОН)=25% Тзам-? | КН2О*См, где См-моляльность р-ра или моль в-ва на 1кг растворителя. КН2О = 1,86. Возьмем 100 грамм раствора, тогда масса этанола будет 0,25*100 = 25 г, а количество в-ва его n = m/M = 25/46 = 0,54 моль. Масса воды тогда будет 100-25 = 75 грамм. Тогда См = n(C2H5OH)/M(H2O) = 0,543/75*10-3 = 7,25 моль/кг. DТзам = 1,86*7,25 = 13,480. Тзам = -13,480С |
| Дано: W%(C6H12O6) = 10% Т(кип) =? | ΔТ(кип) = Е(Н2О)*Сm, где Сm - моляльная концентрация. Найдем моляльность раствора глюкозы: возьмем 100 грамм раствора m(C6H12O6) = 10 г. n(C6H12O6) = m/M = 10/180 = 0.056 моль m(H2O) = 100-10 = 90 г. Сm = n(C6H12O6)/m(H2O) = 0.056/0.090 = 0.62 моль/кг. ΔТ(кип) = Е(Н2О)*Сm = 0.52*0.62 = 0.320. Т(кип) = 100.32 0С |
| Дано: m(x) = 1.6 г. V(H2O) = 250 мл. Т(зам) = -0.2 оС М(х) =? | ΔТ(зам) = К(Н2О)*Сm = 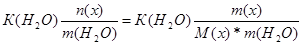 0.2 = 1.86*
0.2 = 1.86* 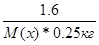 , следовательно, М(х) = 59.52 г/моль , следовательно, М(х) = 59.52 г/моль
|
| Дано: m(x) = 27 г. V(H2O) = 1000 мл. Т(кип) = 100.78 оС М(х) =? | ΔТ(кип) = Е(Н2О)*Сm = 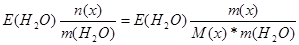 0.78 = 0.52*
0.78 = 0.52* 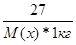 , следовательно, М(х) = 18 г/моль , следовательно, М(х) = 18 г/моль
|
| Дано: m(Ix) = 9.2 г. m(CH3OH) = 100 г. То(кип) = 64.7 оС Т’(кип) = 65 оС М(Iх) =? Е(CН3ОH) = 0.84 | Необходимо найти молярную массу иода, растворенного в метаноле
ΔТ(кип) = Е(CН3ОH)*Сm =  65 - 64.7 = 0.84*
65 - 64.7 = 0.84* 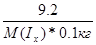 , следовательно, М(Iх) = 257.6 г/моль
Молекула иода состоит из 257.6/127 = 2 атомов. , следовательно, М(Iх) = 257.6 г/моль
Молекула иода состоит из 257.6/127 = 2 атомов.
|
| Дано: m(Sx) = 0.81 г. m(C6H6) = 100 г. ΔТ(кип) = 0.081 оС М(Sх) =? Е(C6H6) = 2.57 | Необходимо найти молярную массу серы, растворенной в бензоле
ΔТ(кип) = Е(C6H6)*Сm = 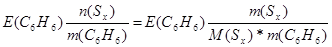 0.081 = 2.57*
0.081 = 2.57* 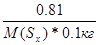 , следовательно, М(Sх) = 257 г/моль
Молекула серы состоит из 257/32 = 8 атомов. , следовательно, М(Sх) = 257 г/моль
Молекула серы состоит из 257/32 = 8 атомов.
|
| Дано: V(H2O) = 30 л. V(C3H5(OH)3) = 9 л. Т(зам) =? p(глицерина) = 1,261 г/мл | ΔТ(зам)=К(Н2О)*Сm= 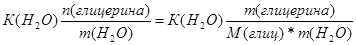 Масса глицерина равна m = V*p = 9000*1.261 = 11349 г.
ΔТ(зам) = 1.86*
Масса глицерина равна m = V*p = 9000*1.261 = 11349 г.
ΔТ(зам) = 1.86* 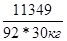 = 7.65о. Раствор замерзает при -7.65оС = 7.65о. Раствор замерзает при -7.65оС
|
| Дано: Т(зам) = -150С m(C2H4(OH)2)=? | ΔТ(зам)=К(Н2О)*Сm= 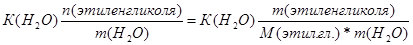 Сm =
Сm = 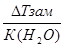 = = 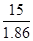 =8.06 моль / кг растворителя.
m(этил.гл.) = Сm * М(этил.гл.) * m(H2O) = 8.06*62*1 = 499.7 г = 0.5 кг. =8.06 моль / кг растворителя.
m(этил.гл.) = Сm * М(этил.гл.) * m(H2O) = 8.06*62*1 = 499.7 г = 0.5 кг.
|
| Дано: Pосм =? w%(сахара) = 4 % Т = 20оС = 293 К p = 1.014 г/мл | Pосм = См*R*T Возьмем 1 литр раствора и найдем См сахара: m(раствора) = V*p = 1000*1.014 = 1014 г. m(сахара) = 1014*4%/100% = 40.56 г. См(сахара) = m/(M*V) = 40.56/(342*1) = 0.12 моль/л Росм = 0.12*8.31*293 = 288.8 кПа, Росм = 0.12*0.082*293 = 2.85 атм. |
| Дано: V(H2O) = 1 л. Pосм = 607950 Па m(глюкозы) = 45 г. Т =? | Pосм = См*R*T = 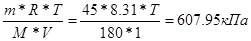 , следовательно Т=293.6К , следовательно Т=293.6К
|
| Дано: W%(C) = 39.56 % W%(H) = 7.69 % W%(O) = 52.75 % V(H2O) = 1 л. Pосм = 9.00*105 Па m(маннита) = 72 г. Т = 00С = 273 К | Pосм = См*R*T = 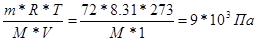 М(маннита) = 181 г/моль
Возьмем 1 моль маннита. Масса одного моль маннита 181 грамм. В них содержится:
m(C) = 39.56%*181/100% = 72 г. n(С) = m/M = 72/12 = 6 моль
m(Н) = 7.69%*181/100% = 14 г. n(Н) = m/M = 14/1 = 14 моль
m(О) = 52.75%*181/100% = 96 г. n(О) = m/M = 96/16 = 6 моль
Формула маннита: С6Н14О6
М(маннита) = 181 г/моль
Возьмем 1 моль маннита. Масса одного моль маннита 181 грамм. В них содержится:
m(C) = 39.56%*181/100% = 72 г. n(С) = m/M = 72/12 = 6 моль
m(Н) = 7.69%*181/100% = 14 г. n(Н) = m/M = 14/1 = 14 моль
m(О) = 52.75%*181/100% = 96 г. n(О) = m/M = 96/16 = 6 моль
Формула маннита: С6Н14О6
|
591. Электролитами называются вещества, диссоциирующие в растворе. Согласно теории электролитической диссоциации, кислоты- вещества, которые при диссоциации дают катионы водорода. Основания при диссоциации дают ОН-группы. Соли диссоциируют на катион и анион кислотного остатка. Кислые и основные соли называют промежуточными соединениями, т.к. они являются продуктами неполной реакции нейтрализации.
592. Возможность электролитической диссоциации определяется природой вещества (сильный или слабый электролит), природой растворителя, температурой и т.п. Ионизирующую силу растворителя характеризует диэлектрическая проницаемость: вода – 81.0, спирт – 25.8, бензол – 2.23, фтороводород – 32.3. Диссоциация NaCl:
NaCl + H2O = 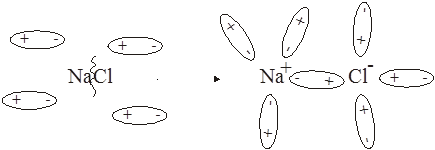
|
593. В воде хлорид натрия диссоциирует на ионы практически полностью, а спирт практически не диссоциирует. Т.к. ионы, образующиеся при диссоциации, проводят электрический ток, то раствор NaCl проводит электрический ток, а раствор CH3CH2OH не проводит.
594. Для количественной характеристики электролитической диссоциации применяются константа диссоциации (Кд) и степень диссоциации (а). Кд – отношение произведения концентраций продуктов к произведению концентраций исходных веществ. а – отношение количества диссоциированных молекул к исходному количеству молекул. Постоянной величиной при различных концентрациях является Кд.
595. По величине электролитической диссоциации электролиты делятся на: сильные (Кд >>1), средние (1> Кд > 10-2) и слабые (Кд << 1). К первым относится HNO3(Кд = 43.6): HNO3 = H+ + NO3- . Ко вторым – HIO4 (Кд = 2/3*10-2): HIO4 = H+ + IO4-. К слабым электролитам относят NH4OH (Кд = 1.76*10-5): NH4OH = NH4+ + OH-.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 381; Нарушение авторских прав?; Мы поможем в написании вашей работы!