
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические источники энергии 2 страница
|
|
|
|
В три ступени Na3PO4 + H2O = Na2HPO4 + NaOH (1)
Na2HPO4 + H2O = NaH2PO4 + NaOH (2)
NaH2PO4 + H2O = H3PO4 + NaOH (3)
662. Константа гидролиза солей многоосновных кислот или многокислотных оснований обычно велика только для первой ступени, а для второй невысока. Поэтому гидролиз таких солей проходит только в две ступени.
Гидролиз в две ступени: K2S + H2O = KHS + KOH, KHS + H2O = H2S + KOH
Гидролиз в три ступени: AlCl3 + H2O = Al(OH)Cl2 + HCl, Al(OH)Cl2 + H2O = Al(OH)2Cl + HCl, Al(OH)2Cl + H2O = Al(OH)3 + HCl
663. Константа гидролиза – это константа равновесия реакции гидролиза, т.е. реакции взаимодействия соли с водой. Константа гидролиза тем больше, чем более слабые электролиты образуются при гидролизе, чем выше температура. От концентрации раствора константа гидролиза не зависит.
| NH4NO3 + H2O = NH4OH + HNO3 | Кг = 
|
| KNO2 + H2O = KOH + HNO2 | Кг = 
|
| KClO + H2O = KOH + HClO ClO- + H2O = HClO + OH- | Кг = 
|
| K2S + H2O = KHS + KOH S2- + H2O = HS- + OH- | Кг = 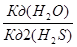
|
| AlCl3 + H2O = HCl + AlOHCl2 Al3+ + H2O = AlOH2+ + H+ | Кг = 
|
665. Степень гидролиза – это отношение количества диссоциировавших молекул к количеству недиссоциированных молекул.  . При увеличении концентрации раствора и уменьшении температуры степень гидролиза уменьшается. Введение в раствор щелочи или кислоты влияет на степень гидролиза по-разному. Если соль гидролизуется по катиону, то степень гидролиза усиливается при введении щелочи, а уменьшается при введении кислоты. Если соль гидролизуется по аниону, то степень гидролиза усиливается при введении кислоты, а уменьшается при введении щелочи.
. При увеличении концентрации раствора и уменьшении температуры степень гидролиза уменьшается. Введение в раствор щелочи или кислоты влияет на степень гидролиза по-разному. Если соль гидролизуется по катиону, то степень гидролиза усиливается при введении щелочи, а уменьшается при введении кислоты. Если соль гидролизуется по аниону, то степень гидролиза усиливается при введении кислоты, а уменьшается при введении щелочи.
666. Степень гидролиза соли тем выше, чем слабее образующиеся электролиты.
| Соль | Кд | По возрастанию степени гидролиза | Уравнения гидролиза |
| NaNO2 | НNO2 – 6.9*10-4 | NaNO2 + H2O = NaOH + HNO2 NO2- + H2O = HNO2 + OH- | |
| NaCN | HCN – 5.0*10-10 | NaCN + H2O = NaOH + HCN CN- + H2O = HCN + OH- | |
| NaClO | HClO – 3*10-8 | NaClO + H2O = NaOH + HClO ClO- + H2O = HClO + OH- | |
| NaClO2 | HClO2 – 1.1*10-2 | NaClO2 + H2O = NaOH + HClO2 ClO2- + H2O = HClO2 + OH- |
667. При уменьшении концентрации соли в растворе и при увеличении температуры степень гидролиза возрастает. При разбавлении растворов солей хлорида сурьмы и нитрата висмута степень гидролиза этих солей увеличивается – гидролиз протекает до конца и выпадают осадки соответствующих гидроксидов: SbCl3 + 3H2O = Sb(OH)3 + 3HCl, Bi(NO3)3 + 3H2O = Bi(OH)3 + 3HNO3.
668. При увеличении температуры степень гидролиза солей возрастает. При нагревании раствора ацетата натрия степень гидролиза увеличивается: CH3COONa + H2O = CH3COOH + NaOH. В растворе растет концентрация ОН- групп, в результате фенолфталеин обесцвечивается. При охлаждении равновесие гидролиза соли смещается влево: раствор индикатора вновь приобретает малиновую окраску.
669. При уменьшении концентрации соли в растворе и увеличении температуры степень гидролиза возрастает. При добавлении хлорида железа по каплям в кипящую воду, гидролиз соли увеличивается настолько, что протекает до конца: FeCl3 + 3H2O = Fe(OH)3 + 3HCl
670. Гидролиз уменьшает введение ионов одноименных ионам, образующимся при гидролизе. Если соль гидролизуется по катиону: FeCl3 + H2O = FeOHСl2 + HCl, то уменьшать гидролиз будут Н+. Если соль гидролизуется по аниону: NaClO2 + H2O = NaOH + HClO2, то уменьшать гидролиз будут ОН- анионы.
671. При приготовлении растворов солей олова, сурьмы и висмута необходимо добавление кислоты для подавления гидролиза этих солей. При отсутствии избытка кислоты соли гидролизуются до образования гидроксидов, например, SbCl3 + 3H2O = Sb(OH)3 + 3HCl, Bi(NO3)3 + 3H2O = Bi(OH)3 + 3HNO3.
672. При приготовлении растворов алюминатов и хромитов необходимо добавление щелочи для подавления гидролиза этих солей. При отсутствии избытка щелочи соли гидролизуются до образования гидроксидов, например, NaAlO2 + 2H2O = NaOH + Al(OH)3.
673. При совместном гидролизе солей сульфата хрома и сульфида натрия гидролиз солей протекает до конца, т.к. образуются одноименные ионы, усиливающие гидролиз второй соли:
| Na2S + H2O = NaHS + NaOH S2- + H2O = HS- + OH- |
| Cr2(SO4)3 + 2H2O = 2CrOHSO4 + H2SO4 Cr3+ + H2O = CrOH2+ + H+ |
| H+ + OH- = H2O |
| 3Na2S + Cr2(SO4)3 + 6H2O = 3Na2SO4 + 2Cr(OH)3 + 3H2S |
674. Если при совместном гидролизе двух солей образуются одноименные ионы, усиливающие каждый гидролиз второй соли, то гидролиз таких солей протекает до конца. Это возможно, если из двух солей одна гидролизуется по катиону, а вторая по аниону:
а) Al(NO3)3, ZnCl2 – обе соли гидролизуются по катиону и не усиливают гидролиз друг друга
б) Al2(SO4)3 и Na2CO3 – первая соль гидролизуется по катиону, вторая – по аниону, следовательно гидролиз солей усиливается:
| Al3+ + H2O = AlOH2+ + H+ | CO32– + H2O = HCO3– + OH– |
| H+ + OH– = H2O | |
| 3Na2CO3 + Al2(SO4)3 + 6H2O = 3Na2SO4 + 2Al(OH)3 + 3H2CO3 |
в) AlCl3 и FeCl3 – обе соли гидролизуются по катиону и не усиливают гидролиз друг друга
г) K2S и Pb(NO3)2 – первая соль гидролизуется по аниону, вторая – по катиону, следовательно гидролиз солей усиливается:
| Pb2+ + H2O = PbOH+ + H+ | S2– + H2O = HS– + OH– |
| H+ + OH– = H2O | |
| K2S + Pb(NO3)2 + 2H2O = 2KNO3 + Pb(OH)2 + H2S |
| Дано См(СН3СООNH4) = 0.1м Кг =?, степень гидролиза а=? | СН3СООNH4 + Н2О = CH3COOH + NH4OH
 =3.2*10-5
Закон Оствальда: Кг = См*а2/(1-а) или а ~ =3.2*10-5
Закон Оствальда: Кг = См*а2/(1-а) или а ~  = 0.018 = 1.8%. Т.к. степень гидролиза относительно небольшая, то в данном случае гидролиз нельзя считать необратимым процессом. Поскольку константа диссоциации NH4OH примерно равна константе диссоциации CH3COOH, то среда раствора практически нейтральная. = 0.018 = 1.8%. Т.к. степень гидролиза относительно небольшая, то в данном случае гидролиз нельзя считать необратимым процессом. Поскольку константа диссоциации NH4OH примерно равна константе диссоциации CH3COOH, то среда раствора практически нейтральная.
|
| Дано См(NH4NO2) = 0.1м Кг =?, степень гидролиза а=? | NH4NO2 + Н2О = HNO2 + NH4OH
 = 8.1*10-7
Закон Оствальда: Кг = См*а2/(1-а) или а ~ = 8.1*10-7
Закон Оствальда: Кг = См*а2/(1-а) или а ~  = 0.003 = 0.3%. Т.к. степень гидролиза относительно небольшая, то в данном случае гидролиз нельзя считать необратимым процессом. Поскольку константа диссоциации NH4OH больше константы диссоциации HNO2, то среда раствора щелочная. = 0.003 = 0.3%. Т.к. степень гидролиза относительно небольшая, то в данном случае гидролиз нельзя считать необратимым процессом. Поскольку константа диссоциации NH4OH больше константы диссоциации HNO2, то среда раствора щелочная.
|
| Дано См1(NaNO2) = 1м См2(NaNO2) = 10-3м Кг =?, степень гидролиза а=? PH -? | NaNO2 + Н2О = HNO2 + NaOH
 = 1.45*10-11
Закон Оствальда: Кг = См*а2/(1-а) или а ~ = 1.45*10-11
Закон Оствальда: Кг = См*а2/(1-а) или а ~  a) a1 =
a) a1 =  = 3.8*10-6 б) a2 = = 3.8*10-6 б) a2 = 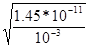 = 1.2*10-4
С увеличением разбавления степень гидролиза соли увеличивается.
[H+] = a1*Cм1 = 3.8*10-6 моль/л.
рН = -lg[H+] = 5.4 = 1.2*10-4
С увеличением разбавления степень гидролиза соли увеличивается.
[H+] = a1*Cм1 = 3.8*10-6 моль/л.
рН = -lg[H+] = 5.4
|
| Дано См(Na2СO3) = 1м Кг =?, степень гидролиза а =? pH -? | Na2СO3 + Н2О = NaHCO3 + NaOH
 = 2*10-4 = 2*10-4
| NaHСO3 + Н2О = H2CO3 + NaOH
 = 2*10-8 = 2*10-8
|
Закон Оствальда: Кг = См*а2/(1-а) или а ~  a1 =
a1 =  = 1.4*10-2,Cм(NaHCO3) = a*Cм(H2CO3) = 0.014 моль/л
б) a2 = = 1.4*10-2,Cм(NaHCO3) = a*Cм(H2CO3) = 0.014 моль/л
б) a2 =  = 1.2*10-3. Степень гидролиза соли по второй ступени небольшая и вклад 2-й = 1.2*10-3. Степень гидролиза соли по второй ступени небольшая и вклад 2-й  = 2*10-8 ступени гидролиза в значение рН можно не учитывать.
[ОH-] = a1*Cм = 0.014 моль/л.
рОН = -lg[ОH-] = 1.8, следовательно рН = 14- рОН = 12.2 = 2*10-8 ступени гидролиза в значение рН можно не учитывать.
[ОH-] = a1*Cм = 0.014 моль/л.
рОН = -lg[ОH-] = 1.8, следовательно рН = 14- рОН = 12.2
|
| Дано См(K2SO3) = 1м Кг =?, степень гидролиза а =? pH -? | K2SO3 + Н2О = KHSO3 + KOH
 = 1.16*10-7 = 1.16*10-7
| KHSO3 + Н2О = H2SO3 + KOH
 = 7.15*10-13 = 7.15*10-13
|
Закон Оствальда: Кг = См*а2/(1-а) или а ~  a1 =
a1 = 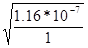 = 3.4*10-4,Cм(KHSO3) = a*Cм(H2SO3) = 3.4*10-4 моль/л
б) a2 = = 3.4*10-4,Cм(KHSO3) = a*Cм(H2SO3) = 3.4*10-4 моль/л
б) a2 =  = 4.6*10-5. Степень гидролиза соли по второй ступени небольшая и вклад 2-й = 4.6*10-5. Степень гидролиза соли по второй ступени небольшая и вклад 2-й  = 7.15*10-13 ступени можно не учитывать.
[ОH-] = a1*Cм = 3.4*10-4 моль/л. рОН = -lg[ОH-] = 4.5, рН = 14- рОН = 9.5 = 7.15*10-13 ступени можно не учитывать.
[ОH-] = a1*Cм = 3.4*10-4 моль/л. рОН = -lg[ОH-] = 4.5, рН = 14- рОН = 9.5
|
1) КNO2 + Н2О = КOH + HNO2
 = 1.15*10-11 = 1.15*10-11
| 2) NaNO2 + Н2О = NaOH + HNO2
 = 1.15*10-11 = 1.15*10-11
|
Закон Оствальда: Кг = См*а2/(1-а) или а ~ 
a1 = a2 =  = 1.2*10-5,Cм(ЭNO3) = a*Cм(HNO3) = 1.2*10-5 *0.1 = 1.2*10-6 моль/л
= 1.2*10-5,Cм(ЭNO3) = a*Cм(HNO3) = 1.2*10-5 *0.1 = 1.2*10-6 моль/л
[Н+] = 1.2*10-6 моль/л. рН = -lg[H+] = 5.9.
Одинаковый результат для двух разных солей объясняется тем, что при гидролизе обе соли дают одну и туже кислоту - HNO2, константу диссоциации которой мы и подставляем в формулу для расчета константы гидролиза.
683. Окислительно-восстановительный потенциал характеризует окислительно-восстановительную активность вещества, стабильность степеней окисления веществ, возможные переходы между ними.
Чем меньше окислительно-восстановительный потенциал, тем сильнее восстановительные свойства, например: Li (E0 = -3.05 B), K (E0 = -2.93 B). Чем больше окислительно-восстановительный потенциал, тем сильнее окислительные свойства, например: Сl/Cl2 (E0 = 1.36 B), O3 (E0 = 1.51 B).
685. Окислительно-восстановительный потенциал является термодинамическим параметром, т.к. определяет возможность протекания процесса. 
 ,
,  , где Е – электродвижущая сила, F – постоянная Фарадея, R – газовая постоянная, Т - температура, z – количество электронов.
, где Е – электродвижущая сила, F – постоянная Фарадея, R – газовая постоянная, Т - температура, z – количество электронов.
687. MnO4- + 8H+ + 5e- = Mn 2+ + 4H2O, Е = 1.51 В.
См = 1 М, [H+] = 5М, [Mn2+] = 0.01M, Т = 298 К.
Е (MnO4- / Mn 2+) = Е0 (MnO4- / Mn 2+) + (2.3*R*T / n*F) *ln (См MnO4- *См8H+) / См Mn 2+
Е (MnO4- / Mn 2+) = 1.51 + (2.3*8.31*298 / 5*96500) * ln (1*58 /0.01) = 1.72 В.
688. Cr2O7-2 + 14H+ + 6e- = 2Cr 3+ + 7H2O, Е = 1.33 В.
См = 1 М, [H+] = 5М, [Cr3+] = 0.1M, Т = 298 К.
Е (Cr2O7-2 / Cr 3+) = Е0 (Cr2O7-2/ Cr +3) + (2.3*R*T / n*F) *ln (См Cr2O7-2 *См14H+) / См Cr 2+
Е (Cr2O7-2 / Cr 3+) = 1.33 + (2.3*8.31*298 / 6*96500) * ln (1*514 /0.1) = 1.69 В.
| Дано W%(H2SO4) = 60% p = 1.50 г/мл T = 298 K E -? | SO42- + 8H+ + 6e = S + 4H2O E(SO42-/S) = Eo(SO42-/S) +  Найдем концентрацию серной кислоты: возьмем 1 литр раствора.
m(р-ра H2SO4) = V*p = 1000*1.50 = 1500 грамм.
m(H2SO4) = m(р-ра H2SO4)*W%/100% = 1500*60/100 = 900 грамм.
Cм = m/(M*V) = 900/(98*1) = 9.2 моль/л.
См(H2SO4) = См(SO42-) = 9.2, См(Н+) = 2См(H2SO4) = 18.4 моль/л.
E(SO42-/S) = 0.36 +
Найдем концентрацию серной кислоты: возьмем 1 литр раствора.
m(р-ра H2SO4) = V*p = 1000*1.50 = 1500 грамм.
m(H2SO4) = m(р-ра H2SO4)*W%/100% = 1500*60/100 = 900 грамм.
Cм = m/(M*V) = 900/(98*1) = 9.2 моль/л.
См(H2SO4) = См(SO42-) = 9.2, См(Н+) = 2См(H2SO4) = 18.4 моль/л.
E(SO42-/S) = 0.36 +  = 0.46 В = 0.46 В
|
Полученный результат является приблизительным, поскольку вычисления ведутся из предположения, что серная кислота диссоциирует нацело.
| Дано W%(HNO3)=40% p = 1.25 г/мл T = 298 K E -? | NO3- + 4H+ + 3e = NO + 2H2O E(NO3-/NO) = Eo(NO3-/NO) +  Найдем концентрацию азотной кислоты: возьмем 1 литр раствора.
m(р-ра HNO3) = V*p = 1000*1.25 = 1250 г.
m(HNO3) = m(р-ра HNO3)*W%/100% = 1250*40/100 = 500 грамм.
Cм = m/(M*V) = 500/(63*1) = 7.94 моль/л.
См(HNO3) = См(NO3-) = См(Н+) = 7.94 моль/л.
E(NO3-/NO) = 0.96 +
Найдем концентрацию азотной кислоты: возьмем 1 литр раствора.
m(р-ра HNO3) = V*p = 1000*1.25 = 1250 г.
m(HNO3) = m(р-ра HNO3)*W%/100% = 1250*40/100 = 500 грамм.
Cм = m/(M*V) = 500/(63*1) = 7.94 моль/л.
См(HNO3) = См(NO3-) = См(Н+) = 7.94 моль/л.
E(NO3-/NO) = 0.96 +  = 1.048 В = 1.048 В
|
Полученный результат является приблизительным, поскольку вычисления ведутся из предположения, что азотная кислота диссоциирует нацело. Кроме того невозможно учесть концентрацию выделяющегося NO, который влияет на положение равновесия данной реакции.
692. Cr2O72- + 14H+ + 6e - =2Cr3+ + 7H2O, j = 1.33 B.
CrO42- + 4H2O + 3e - =Cr3+ +8OH -, j = -0.13 B.
j(окислителя) > j(восстановителя), в соответствии с этим правилом, хром является более сильным восстановителем в щелочной среде а более сильным окислителем – в кислой среде.
693. Более сильным восстановителем цинк является в щелочной среде, поскольку в ней он имеет потенциал Е0 (Zn2+ /Zn) = - 1.24 В, а в кислой Е0 = -0.76 В.
694. В кислой и нейтральной средах:Al 3+ + 3e - = Al, j = - 0.67 B.
В щелочной среде: Al + 3OH - - 3e - = Al(OН)3 , j = -2.30 B.
Чем меньше потенциал восстановителя, тем больше будет разница между ним и потенциалом окислителя, в соответствии с этим правилом, алюминий является более сильным восстановителем в щелочной среде.
695. Согласно правилу, Е(окислителя) должно быть > Е(восстановителя). Перхлораты в качестве окислителей целесообразно использовать в кислой среде, т.к. максимальный потенциал Е = 1.58 В. хлораты используют в щелочной среде (Е = 1.49 В). Хлориты – в кислой среде (Е = 1.21 В). Гипохлориты - в кислой (Е = 1.63 В).
696. Электроны, находящиеся в объеме металла при контакте его с раствором соли могут переходить в раствор или в металл – возникает заряд. Он называется двойным электрическим слоем и зависит от потенциала металла, концентрации соли и природы металла.
697. Электродные потенциалы металлов и их ионизационные потенциалы определяются различными методами. Ионизационные определяются спектральными методами, а электродные – относительно стандартного водородного электрода, поэтому значения этих двух величин не совпадают.
698. В ряду напряжений металлы расположены в порядке убывания их отрицательных и возрастания положительных потенциалов. Ряд обладает свойствами:
- каждый из находящихся в ряду металлов вытесняет из растворов их солей все металлы, следующие за ним. Поэтому кадмий будет вытеснять медь и серебро, но не вытеснит цинк и магний. В свою очередь кадмий вытеснит любой металл, стоящий слева от него, это может быть калий, магний, алюминий, железо и др.
- все металлы, стоящие в ряду напряжений до водорода вытесняют его из растворов кислот.
- восстановительная способность металлов падает слева направо.
701. I (0.62 B) … Br (1.09) … Cl (1.36) … F (2.87)
Ряд обладает свойствами: чем правее стоит элемент, тем сильнее его окислительная способность.
| HCl + O2 = Cl2 + 2H2O 2Cl-1 – 1e- = Cl2 (E = 1.36 В) O2 + 4H+ + 4e- = 2H2O (Е = 1.23 В) Согласно правилу, Е(окислителя) должно быть > Е(восстановителя). Т.е. окислителем в данной реакции является O2 - реакция протекает в обратном направлении. |
| H3PO4 + HI = H3PO3 +I2 PO4 3- + 2H+ +2e- = PO3 3- + H2O, (E = -0.28 В) 2I -1 - 2e– = I2 (Е = 0.62 В), Е(окислителя) > Е(восстановителя). Т.е. окислителем в данной реакции является H3PO4 - реакция протекает в обратном направлении. |
| 2HCl + 2HNO3 = 2NO + Cl2 + 2H2O 2Cl-1 – 1e- = Cl2 (E = 1.36 В) NO3- + 4H+ + 3e- = NO + 2H2O (Е = 0.96 В) Согласно правилу, Е(окислителя) должно быть > Е(восстановителя). Т.е. окислителем в данной реакции является HNO3 - реакция протекает в обратном направлении. |
| 2FeSO4 + 2I2 + H2SO4 = Fe2(SO4)3 +4HI Fe 2+ - 1e- = Fe 3+ (E = 0.77 В) I2 + 2e– = 2I -1 (Е = 0.62 В) Е(окислителя) > Е(восстановителя). Т.е. окислителем в данной реакции является I2 - реакция протекает в обратном направлении. |
| 2KMnO4 + 8KBr + 4H2O = 2MnO2 + 4Br2 + 8KOH MnO4- + 2H2O + 3e- = MnO2 + 4OH- , E = 1.23 В 2Br- -2e- = Br2, Е = 1.09 В Согласно правилу, Е(окислителя) должно быть > Е(восстановителя). Т.е. окислителем в данной реакции является KMnO4 - реакция протекает в прямом направлении. |
| 2KMnO4 +6Ag + H2O = 2MnO2 + 3Ag2O + 2KOH MnO4- + 2H2O + 3e- = MnO2 + 4OH- , E = 1.23 В 2Ag + 2OH- –2e = Ag2О + H2O, Е = 0.79 В Е(окислителя) > Е(восстановителя). Т.е. окислителем в данной реакции является KMnO4 - реакция протекает в прямом направлении. |
| H3PO3 + SnCl2 + H2O = H3PO4 + Sn + 2HCl PO3 3- + H2O -2e- = PO4 3- + 2H+, E = -0.28 В Sn2+ +2e- = Sn, Е = -0.14 В Согласно правилу, Е(окислителя) должно быть > Е(восстановителя). Т.е. окислителем в данной реакции является SnCl2 - реакция протекает в прямом направлении. |
| SnCl2 + I2 + KCl = SnCl4 + KI Sn2+ -2e- = Sn4+, Е = 0.15 В, I2 +2e- = 2I-, Е = 0.62 В Е(окислителя) > Е(восстановителя). Т.е. окислителем в данной реакции является иод - реакция протекает в прямом направлении. |
| Se + 2H2SO4 + H2O = H2SeO3 + H2SO3 Se + 6OH-– 4e- = SeO32- + 3H2O, (E = -0.37В) SO4-2 + H2O + 2e- = SO32- + 2OH-, (Е = -0.93 В) Согласно правилу, Е(окислителя) должно быть > Е(восстановителя). Т.е. окислителем в данной реакции является H2SO4 - реакция протекает в обратном направлении. |
| Cu + Br2 + Na2SO4 = CuSO4 + NaBr Cu - 2e- = Cu+2 , (E = 0.337 В) Br2 +2e– = 2Br -, (Е = 1.09 В), Е(окислителя) > Е(восстановителя). Т.е. окислителем в данной реакции является Br2 - реакция протекает в прямом направлении. |
| Ag + 2HNO3 = AgNO3 + NO2 + H2O Ag – 1e- = Ag+ (E = 0.790В) NO3- + 2H+ + 1e- = NO2 + H2O (Е = 0.80 В) Согласно правилу, Е(окислителя) должно быть > Е(восстановителя). Т.е. окислителем в данной реакции является HNO3 - реакция протекает в прямом направлении. |
| Cl2 + H2O = HCl + HClO Cl2 + 2e- = 2Cl– (E = 1.36 В) Cl2 + H2O –2e– = 2HClO + 2H+ (Е = 1.63 В) Е(окислителя) > Е(восстановителя). Т.е. окислителем в данной реакции является Cl2 - реакция протекает в прямом направлении. |
| Au + 6HNO3 = Au(NO3)3 + 3NO2 + 3H2O Au – 3e- = Au3+ E = 1.5 В NO3- + 2H+ + 1e- = NO2 + H2O Е = 0.8 В Согласно правилу, Е(окислителя) должно быть > Е(восстановителя). Т.е. окислителем в данной реакции является Au3+ - реакция протекает в обратном направлении. |
| PbSO4 + H2O2 = PbO2 + H2SO4 Pb2+ – 2e- = Pb4+ E = 1.69 В H2O2 = 2H+ + O2- Е = 0.68 В Е(окислителя) > Е(восстановителя). Т.е. окислителем в данной реакции является Pb4+ - реакция протекает в обратном направлении. |
709. а) HIO3 проявляет окислительные свойства (Е = 1.08 В), тогда как HCl – слабый восстановитель (Е = 1.36 В). Поскольку ОВР может протекать при условии, что Е(окислителя) > Е(восстановителя), то данные вещества не будут взаимодействовать и можно на их основе приготовить раствор. б) K2Cr2O7 – сильный окислитель (Е = 1.33 В), а KBr – слабый восстановитель (Е = 1.09 В). Данные вещества могут взаимодействовать и раствор из них приготовить нельзя.
710. Согласно правилу, Е(окислителя) должно быть > Е(восстановителя).
а) Е (HNO3) = 0.80 B, Е (HBr) = 1.09 B. Потенциал окислителя (азотной кислоты) меньше потенциала восстановителя, поэтому HNO3 не будет окислять HBr, раствор можно приготовить.
б) по той же причине железо не восстановит хром до шестивалентного состояния, такой раствор тоже можно приготовить.
711. Гальванические элементы – устройства, преобразующие химическую энергию в электрическую. Простейшим гальваническим элементом является элемент Даниэля-Якоби, разработанного в 1836 году. Элемент Даниэля-Якоби представляет собой медно-цинковый элемент. Медный и цинковый электроды погружены в растворы своих солей и образуют полуэлементы, их разграничивает пористая перегородка, препятствующая смешению растворов, но пропускающая сульфат-анионы.
анод (-) Zn|ZnSO4, H2O||CuSO4 , H2O |Cu(+) катод
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 384; Нарушение авторских прав?; Мы поможем в написании вашей работы!