
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические источники энергии 3 страница
|
|
|
|
(-) Zn – 2e- = Zn2+
(+) Cu2+ + 2e- = Cu
Zn + Cu2+ = Zn2+ + Cu
Источником электрического тока при работе этого элемента является пространственно разделенная окислительно-восстановительная реакция вытеснения более активного металла менее активным из его соли.
712. При работе гальванических элементов стандартными называют условия Т = 298 К, Р = 1.013*105 Па, концентрация катионов соли в растворе – 1 г-ион/л. Элемент Даниэля-Якоби представляет собой медно-цинковый элемент. Медный и цинковый электроды погружены в растворы своих солей и образуют полуэлементы, их разграничивает пористая перегородка, препятствующая смешению растворов, но пропускающая сульфат-анионы.
анод (-) Zn|ZnSO4, H2O||CuSO4 , H2O |Cu(+) катод
(-) Zn – 2e- = Zn2+
(+) Cu2+ + 2e- = Cu
Zn + Cu2+ = Zn2+ + Cu
ЭДС = E0(Cu2+/Cu) - E0(Zn2+/Zn) = 0.34 – (-0.76) = 1.10 В.
713. Электрод – металлическая пластина,контактирующая с электролитом, являющаяся передатчиком электронов от восстановителя к внешнему проводнику и от внешнего проводника к окислителю. Положительно заряжен катод, на котором протекает реакция восстановления (Cu2+ + 2e- = Cu). Отрицательно заряжен анод, на котором протекает реакция окисления (Zn - 2e- = Zn2+).
714. В основу работы гальванического элемента можно положить реакции: Zn + Cu2+ = Zn2+ + Cu, Fe + Pb2+ = Fe2+ + Pb, KMnO4 + FeSO4 + H2SO4 = MnSO4 + Fe2(SO4)3 + K2SO4 + H2O, K2Cr2O7 + K2SO3 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O.
анод (-) Zn|ZnSO4, H2O||CuSO4 , H2O |Cu(+) катод
(-) Zn – 2e- = Zn2+
(+) Cu2+ + 2e- = Cu
Zn + Cu2+ = Zn2+ + Cu
715. В основе расчета ЭДС лежит термодинамический принцип.
анод (-) Zn|ZnSO4, H2O||CuSO4 , H2O |Cu(+) катод
(-) Zn – 2e- = Zn2+
(+) Cu2+ + 2e- = Cu
Zn + Cu2+ = Zn2+ + Cu
ЭДС = E0(Cu2+/Cu) - E0(Zn2+/Zn) = 0.34 – (-0.76) = 1.10 В.
(-)Zn|ZnSO4||AgNO3|Ag(+)
Cн(ZnSO4)=0.01н., Cн(AgNO3)=0.1н.,T = 27oC =300 K
(-) Zn – 2e- = Zn2+
(+) Ag1+ + 1e- = Ag Zn +2Ag1+ = Zn2+ + Ag
[Zn2+] = Cм(ZnSO4) = Сн/2 = 0.01/2 = 0.005 моль/л
[Ag+] = Cм(AgNO3) = Сн = 0.1 моль/л
ЭДС = E(Ag+/Ag) - E(Zn2+/Zn) = E0(Ag+/Ag) - E0(Zn2+/Zn) +  = -0.8 – (-0.76) +
= -0.8 – (-0.76) + 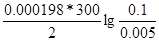 = 1.58B
= 1.58B
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 316; Нарушение авторских прав?; Мы поможем в написании вашей работы!