
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ОсМотичний тик розчинів. Зниження температури замерзання і підвищення температури кипіння розбавлених розчинів неелектролітів
|
|
|
|
.
При дисоціації молекул розчиненої речовини в приведені формули вводять ізотонічний коефіцієнт:  ;
; 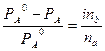 .
.
Відношення числа утворених частинок у розчині Ni. до загального числа молекул розчиненого електроліту No називають ізотонічним коефіцієнтом Вант-Гоффа і позначають і:
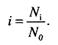
Внаслідок дисоціації усі перелічені вище колігативні властивості розчинів електролітів теж у і разів більші, ніж для розчинів неелектроліту однакової моляльної концентрації:

Значення ізотонічного коефіцієнта залежить від ступеня йонізації електроліту а та числа йонів, на які дисоціює кожна молекула електроліту n. Вираз, що пов'язує ізотонічний коефіцієнт Вант-Гоффа зі ступенем йонізації:
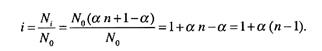
Якщо ступінь дисоціації бінарних електролітів типу NaCl, KBr, LiOH тощо прийняти за одиницю, то одержимо значення ізотонічного коефіцієнта і, що дорівнює 2. Для електролітів, кожна молекула яких дисоціює на три йони (MgCl2, K2SO4, Ca(NO3)2 тощо), і = 3, а для солі A12(SO4)3 i = 5. Це означає, що експериментальні значення ∆Ткип або ∆Тзам розчинів цих речовин у стільки ж разів більші, ніж обчислені теоретично за другим законом Рауля.
Якщо два розчини різної концентрації розділити напівпроникною перегородкою, яка пропускає молекули розчинника і не пропускає молекули чи йони розчиненої речовини, то пройде, тільки одне направлене переміщення молекул розчинника із розчину меншої концентрації у розчин більшої концентрації. Таке явище називається осмосом. Осмос протікає проти градієнту концентрації. Тиск, який треба прикласти до розчину, щоб зупинити осмос, називають осмотичним тиском.
Таким чином, надлишковий гідростатичний тиск, за якого встановлюється осмотична рівновага, називають осмотичним тиском. Величина осмотичного тиску визначається тим зовнішнім тиском, який треба прикласти до розчину, щоб осмос припинився.
Для обчислення осмотичного тиску голландський хімік Я. Вант-Гофф (1887 р.) запропонував застосувати газові закони: осмотичний тиск розчину дорівнює тому тиску, який чинила б розчинена речовина, перебуваючи за тієї ж температури у газоподібному стані і займаючи об'єм, однаковий з об'ємом розчину. Використовуючи об'єднане рівняння газового стану Менделєєва - Клапейрона

і поняття про молярну концентрацію, Вант-Гофф вивів рівняння осмотичного тиску розчину p:

де p – осмотичний тиск розчину, кПа; См – молярність розчину, моль/дм3; R – універсальна газова стала (8,314 Дж/(моль∙К); Т – абсолютна температура, К.
Наведене вище рівняння виражає закон осмотичного тиску Вант-Гоффа, який формулюють так: осмотичний тиск розчину прямо пропорційний його молярній концентрації та абсолютній температурі.
Осмотичний тиск – це колігативна властивість розчину, тобто його величина залежить від загального числа частинок у розчині, інакше – осмотичної концентрації (осмолярності):
p = СосмRT.
Зрозуміло, що для розчинів неелектролітів Сосм = См, а для електролітів Сосм > См на величину і: Сосм = іС м.
Тому при обчисленні осмотичного тиску розведених розчинів електролітів враховують величину ізотонічного коефіцієнта Вант-Гоффа і осмотичний тиск визначають за рівнянням:

Фізико-хімічний метод дослідження, який ґрунтується на вимірюванні осмотичного тиску розчинів, називають осмометрією. Ним переважно користуються для обчислення молярної маси речовини. Вимірявши експериментально осмотичний тиск розчину p із відомою масою речовини т, що за певної температури Т міститься в 1,0 дм3 розчину, можна обчислити молярну масу розчиненої речовини В:
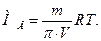
Біологічне значення осмосу і осмотичного тиску. Відомо, що всі біологічні рідини є водними розчинами багатьох мінеральних і органічних речовин. Вони мають певний осмотичний тиск, який підтримується на відносно сталому рівні. Так, для плазми крові людини цей показник дорівнює 770-821 кПа (7,6-8,1 атм) і його називають ізоосмією. Це досягається за рахунок вмісту певних йонів у кількостях і співвідношеннях, характерних для сироватки крові. На відміну від крові, осмотичний тиск сечі та поту коливається у ширших межах. Близько 60 % осмотичного тиску крові створюють наявні в ній йони Na+ і СІ-, а значно меншу його частину зумовлюють високомолекулярні сполуки (в основному білки). Ту частину осмотичного тиску, яку створюють розчинні ВМС, називають онкотичним. Він становить менше 0,5 % від осмотичного тиску плазми крові (3,04–4,05 кПа або 0,03–0,04 атм) і на 80 % визначається вмістом альбумінів.
Завдяки тому, що стінки клітин мають властивості мембран, розподіл води в тканинах залежить від осмотичного тиску. Зокрема, стан осмотичної напруженості клітини, зумовлений підвищеним осмотичним тиском, називають тургором. Він забезпечує пружність та еластичність тканин. У рослинах засушливих зон осмотичний тиск особливо високий, а у болотних рослинах – порівняно низький.
Вода проникатиме в клітину доти, поки різниця осмотичного тиску між клітиною та середовищем не дорівнюватиме нулю, або поки гідростатичний тиск у клітині не зрівняється з осмотичним тиском.
У процесі регуляції осмотичного тиску в організмі людини беруть участь органи виділення, головним чином, нирки і потові залози. Завдяки їх фізіологічній дії вода, що надходить в організм, і продукти метаболізму виводяться із сечею та потом, не спричинюючи суттєвих змін осмотичного тиску.
Розчини з однаковим осмотичним тиском називають ізотонічними або ізоосмотичними. Якщо осмотичний тиск одного розчину більший, ніж іншого, то перший розчин є гіпертонічним відносно до другого, а якщо менший – то гіпотонічним.
Ізотонічність – властивість розчинів мати осмотичний тиск, що дорівнює осмотичному тиску рідин організму (плазми крові, лімфи та ін.). Це одна з вимог, що ставляться до інфузійних розчинів, очних крапель та ін. У медичній практиці ізотонічними розчинами називають такі, осмотичний тиск яких дорівнює осмотичному тиску плазми крові, тобто 7,7-8,1 атм. Такими є розчин натрій хлориду з масовою часткою 0,85-0,9 %; глюкози – 4,5-5,0 %.
Важливо, що зміна осмотичного тиску рідини, яка оточує клітину, призводить до порушення в ній водного обміну. У гіпотонічних розчинах спостерігається явище лізису (розпад, розчинення), тобто клітини набрякають і руйнуються за рахунок розриву клітинної оболонки. Наприклад, якщо еритроцити вмістити в розчин з меншим осмотичним тиском, ніж в еритроциті, то вода проникає всередину еритроциту і останній набрякає, збільшується в об'ємі і руйнується. Явище руйнування оболонки еритроцитів при введенні в плазму крові гіпотонічних розчинів, що супроводжується виходом гемоглобіну в плазму, називають гемолізом. Внаслідок цього процесу (рис. 3.1 ) кров набуває вигляду червоного лаку ("лакова" кров).
Якщо еритроцити вмістити в розчин з більшим осмотичним тиском, ніж всередині еритроцитів, то вони втрачають воду, різко зменшуються в об'ємі і зморщуються. Явище зморщування еритроцитів при введенні в плазму крові гіпертонічних розчинів називають плазмолізом (рис. 3.1 ).
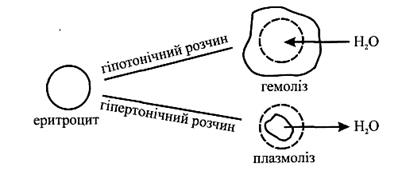
Рис. 3.1. Гемоліз і плазмоліз еритроцитів
Інколи в медичній практиці виникає потреба у внутрішньовенному введенні гіпертонічних розчинів. Щоб не порушити осмотичну рівновагу крові, ін'єкцію гіпертонічних розчинів, наприклад, глюкози (з масовою часткою 20 %, 40 %), проводять дуже повільно, найчастіше крапельним шляхом.
Гіпертонічні розчини, наприклад розчин натрій хлориду (5-10 %) застосовують у хірургії зовнішньо для очищення гнійних ран. При накладанні марлевих пов'язок, змочених цим розчином, рідина з рани рухається в напрямку розчину з більшим осмотичним тиском, і це сприяє очищенню рани від гною, мікроорганізмів тощо.
Кріометрія та ебуліометрія. Із закону Рауля випливають два наслідки, пов'язані з підвищенням температури кипіння і зниженням температури замерзання розчину порівняно з чистим розчинником, їх можна проілюструвати на основі графіка залежності тиску насиченої пари розчинника від температури (рис. 3.2).

Рис. 3.2. Залежність тиску водяної пари від температури
Як видно з рис., з підвищенням температури тиск пари зростає як над розчинником (лінія KL), так і над розчином (лінія MN). Зміну тиску пари розчинника над твердою фазою (льодом) показує лінія СК.
Температура кипіння рідини – це температура, за якої тиск насиченої пари розчинника над рідиною досягне атмосферного тиску. Для того щоб тиск пари над розчином дорівнював атмосферному (101,325 кПа), розчин треба нагріти до вищої температури (Т2), ніж розчинник (Т1). За різницею температур кипіння розчину і розчинника знаходимо підвищення температури кипіння розчину ∆Ткип:
Ткип = Т2 – Т1 або ∆Ткип = Троз-ну – Троз-ка.
Температура замерзання рідини – це температура, за якої тиск насиченої пари над рідиною (розчинником або розчином) дорівнює тиску пари розчинника над твердою фазою. Точки К і М на перетині кривих KL і МN лінією СК відповідають температурі замерзання розчинника (T3) і розчину (T4). Із графіка видно, що розчин замерзає при нижчій температурі порівняно з чистим розчинником. За різницею температур замерзання (початку кристалізації) розчинника і розчину знаходимо зниження температури замерзання (депресію температури замерзання) розчину ∆Тзам :
∆Тзам = Т3 – Т4 або ∆Тзам = Троз-ка – Троз-ну.
Метод дослідження, що ґрунтується на вимірюванні підвищення температури кипіння розчинів, називають ебуліометрією, а зниження температури замерзання – кріометрією.
Розглянемо, від чого залежить величина ∆Ткип чи ∆Тзам розчину. Згідно з другим законом Рауля, підвищення температури кипіння або зниження температури замерзання розчину прямо пропорційні моляльній концентрації розчиненої речовини:

Коефіцієнти пропорційності k е6 і kкр називають відповідно ебуліометричною і кріометричною сталими. Вони залежать лише від природи розчинника і не залежать від природи розчиненої речовини.
Фізичний зміст констант k е6 і k кр випливає з другого закону Рауля: ∆Ткип = k е6, якщо Сm = 1 моль/кг; ∆Тзам = k кр, якщо Сm = 1 моль/кг.
Отже, ебуліометрична стала – це підвищення температури кипіння одномоляльного розчину будь-якого нелеткого неелектроліту, а кріометрична стала – це зниження температури замерзання одномоляльного розчину будь-якого нелеткого неелектроліту.
Обчислення в методах кріометрії та ебуліометрії. За підвищенням температури кипіння або зниженням температури замерзання розчину можна обчислити: а) молекулярну масу розчиненої нелеткої речовини; б) ізотонічний коефіцієнт і ступінь йонізації розчиненого електроліту; в) осмотичний тиск розчину.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 2076; Нарушение авторских прав?; Мы поможем в написании вашей работы!