
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Отримання. 1. окислення спиртів або альдегідів
|
|
|
|
1. окислення спиртів або альдегідів
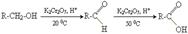
Отримання мурашиної кислоти
1. каталітичне окислення метану
2CH4 + 3O2 → 2H-COOH + 2H2O
2. Взаємодія оксиду Карбогену(ІІ) з гідроксидом Натрію при нагріванні
CO + NaOH → H-COONa;
H-COONa + H2SO4 → H-COOH + NaHSO4
Отримання оцтової кислоти
1. каталітичне окислення бутану
2CH3–CH2–CH2–CH3 + 5O2 → 4CH3COOH + 2H2O
2. Взаємодія оксиду Карбогену(ІІ) з метанолом
CH3OH + CO → CH3COOH
Хімічні властивості
1. карбонові кислоти проявляють всі властивості характерні для неорганічних кислот і є слабкими електролітами:
2СH3COOH + 2Na → 2CH3COONa + H2;
2СH3COOH + Na2O → 2CH3COONa + H2O;
СH3COOH + NaOH → CH3COONa + H2O;
2СH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2;
СH3COOH + NaHCO3 → CH3COONa + H2O + CO2
СH3COONa + H2SO4 → CH3COOH + NaHSO4
2. утворення складних ефірів (реакція етерифікації) у присутності каталізатора - сульфатної кислоти:
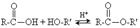
Зворотна реакція називається омиленням або гідролізом складного ефіру.
81) Найважливішою хімічною властивістю естерів є реакція з водою – гідроліз. При нагріванні естеру в присутності розчину лугу естер взаємодіє з водою, знову перетворюючись на кислоту і спирт.
Взаємодія естеру з водою, що призводить до утворення вихідних спирту і кислоти, називається реакцією гідролізу, або омилення.
*кислотний гідроліз (каталізатор - йони Гідрогену) оборотний: C2H5OOCCH3 +Н2О= C2H5OH + CH3COOH
*лужний гідроліз (каталізатор - йони гідроксигрупи) необоротний, оскільки утворюється сіль карбонової кислоти:
C2H5OOCCH3 + NaOH = C2H5OH + CH3COONa
84) Алкани є найпростішими вуглеводнями. Всі атоми вуглецю в молекулах алканів сполучені один з одним простими, одинарними зв'язками. Алкани називають також парафінами, насиченими вуглеводнями. CnH2n+2.За агрегатним складом алкани діляться на газоподібні (С1-С4), рідкі (С5-С17) і тверді (починаючи з С18. Першим членом гомологічног ряду алканів, який має ізомери, є бутан С4Н10.
87) Етиленові вуглеводні (алкени)- вуглеводні аліфатичного ряду, які містять один подвійний зв’язок. Загальна формула СnH2n. Вони становлять гомологічний ряд, першим представником якого є етилен СН2=СН2. починаючи з С4Н8, характерна структурна ізомерія (ізомерія вуглецевого скелета, ізомерія положення подвійного зв’язку), а також геометрична (цис-, транс-) ізомерія, що зумовлено значним бар’єром обертання навколо подвійного зв’язку.
90) К належить до 1 аналіт групи катіонів. 2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6]+ 2NaCl, утвориться кристал. осад подвійної комплексної солі жовтого кольору
Йод належить до 2 аналіт групи аніонів. 2КI + Cl2 = I2 + 2КCl. Колір стає рожево-фіолетовим
91) KNO3- білий CuSo4- блакитний NaCl - мутний NiCl2- салатовий Co(NO3)2- рожевий FeCl3-помаранчевий KMnO4- малиновий K2Cr2O7- помаранчево-червоний
92) К належить до 1 аналіт групи катіонів. 2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6]+ 2NaCl, утвориться кристал. осад подвійної комплексної солі жовтого кольору
Бром належить до 2 аналіт групи аніонів. 2NaBr + Cl2 = 2NaCl + Br2. Бензол, що екстрагує вільний бром, утворює кільце жовтого кольору.
96) Характерна реакція на аніон Cl–
Аргентум нітрат осаджує білий осад AgCl, який не розчиняється в розведених кислотах, але добре розчиняється у водному розчині NH3, утворюючи добре розчинну у воді комплексну сполуку – Аргентум аміакат:
Ag+ + Cl– = AgCl¯;
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl–
CoCl2+ 2AgNO3 = 2AgCl¯ + Co(NO3)2
97) 2KMnO4 + 16 HCl = 2 MnCl2 + 2 KCl + 5 Cl2↑ + 8 H2O
Mn7++ 5ел = Mn 2+ –окиснення, відновник
2Cl-1 – 2ел = Cl20 – відновлення, окисник
K2Cr2O7 + 14HCl = 3Cl2 + 2KCl + 2CrCl3 + 7H2O
Cr6++ 3ел = Cr 3+ –окиснення, відновник
2Cl-1 – 2ел = Cl20 – відновлення, окисник
98) Sr належить до 3 аналіт групи катіонів. SrCl2 + CaSO4= SrSO4↓+ CaCl2 утвориться кристал. осад білого кольору
NO3- належить до 3 аналіт групи аніонів. Дифеніламін окислюється аніонами NO3- до продукту темно-синього кольору. Тому треба додати конц р-н Н2SO4 і дифеніламін.
100) Al належить до 4 аналіт групи катіонів. AlCl3+ NH4OH + NH4Cl + C14H6O2(OH)2=алізарин=комплексна сполука р-н червоного кольору
SO4 належить до 1 аналіт групи аніонівvNa2SO4 + BaCl2 = BaSO4↓+ утворюється білий осад не розчинний у кислотах.
101-102. 1) 2 KMnO4 +3 Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
Mn+7 + 3e = Mn+4 |3|6|2 – окисник
S+4 – 2e = S+6 |2| |3 – відновник
2) 6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O
Fe+2 – 1е = Fe+3 |1|3|3 - відновник
N+5 + 3e = N+2 |3| |1 – окисник
103. CrCl3 – зелений колір (хром) – 4 аналітична група катіонів, 2 – аніонів
Катіон: CrCl3 + 4 NaOH = Na[Cr(OH)4]↓ + 3NaCl – осад, нагріти до зміни забарвлення із зеленого на жовте.
Аніон: СrCl3 + AgNO3 = AgCl↓ + Cr(NO3)3 – білий осад
104. 1) (NH4)2C2O4 + CaCl2 = 2NH4Cl + CaC2O4↓
2 NH4+ + C2O42- + Ca2+ + 2Cl- = 2 NH4+ + 2Cl- + CaC2O4↓
C2O42- + Ca2+ = CaC2O4↓
2) SrCl2 + CaSO4 = SrSO4↓ + CaCl2
Sr2+ + 2Cl- + Ca2+ + SO42- = SrSO4↓ + 2Cl- + Ca2+
Sr2++ SO42- = SrSO4↓
105. Ni(NO3)2 – зелений колір (нікель), 6 аналітична група катіонів, 3 – аніонів
Катіон: Ni(NO3)2 + 6NH3 = [Ni(NH3)6] (NO3)2 ↓ - реактив Чугаєва дає забарвлений в малиновий колір осад
Аніон: Дифеніламін (C6H5)2NH у сильнокислому середовищі взаємодіє з нітрат-йонами (та іншими окисниками в тому числі NO2--іонами), утворюючи сполуку синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
106. Ca2+ - цеглисто-червоний
Sr2+ - карміново-червоний
Ba2+ - жовто-зелений
Na+ - яскраво жовтий
K+ - фіолетовий
107. Al(NO3)3
Катіон 4: Al(NO3)3 + Алізарин (1,2-діокси-антрахінон) = утворює комплексну сполуку червоного кольору Алюміній алізаринат Al(OH)2[C14H6O3(OH)], яка не розчиняється в ацетатній кислоті.
Аніон 3: Al(NO3)3 + дифеніламін (C6H5)2NH = утворюється сполука синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
108. 1) К+ Натрій гексанітрокобальтат (III) Na3[Co(NO2)6] (фармакопейна реакція). Ця комплексна сполука у нейтральному або ацетатнокислому середовищі утворює з йонами K+ важкорозчинний жовтий кристалічний осад подвійної солі K2Na[Co(NO2)6]: 2K+ + Na3[Co(NO2)6] = K2Na[Co(NO2)6]¯ + 2Na+
2) Na+ Мікрокристалоскопічна реакція з цинкуранілацетатом Zn(UO2)3(CH3COO)8. Йони Na+ в оцтовокислому середовищі взаємодіють з (Zn(UO2)3(CH3COO)8 + СН3СООН), при цьому утворюється осад зеленувато-жовтого кольору: NaCl + Zn(UO2)3(CH3COO)8 + СН3СООН = Na Zn(UO2)3(CH3COO)9 + HCl
3) NH4+ Їдкі луги (NaOH або KOH) (фармакопейна реакція) під час нагрівання з розчинами солей амонію виділяють аміак: NH4+ + OH– = NH3 +H2O.
Калій тетрайодомеркурат (II) K2[HgI4] у KOH (реактив Неслера) з йонами NH4+ утворює червоно-бурий осад: NH4+ + 2[HgI4]2– + 4OH– = [NH2Hg2O]I¯ + 7I– + 3H2O
109. Na3PO4
Катіон1: Na3PO4 + 3Zn(UO2)3(CH3COO)8 + 3СН3СООН = 3Na Zn(UO2)3(CH3COO)9 + H3PO4 - утворюється осад зеленувато-жовтого кольору
Аніон 1: Na3PO4 + 12(NH4)2MoO4 + 21HNO3 = (NH4)3[P(Mo3O10)4]¯ +21NH4NO3 + NaNO3 +12H2O – осад білого кольору
110. 108
111. ZnSO4
Катіон4: Дитизон (дифенілтіокарбазон) у розчині чотирихлористого вуглецю (або хлороформу) з іонами Zn2+ утворює внутрішньокомплексну сполуку яскраво-червоного кольору
Аніон 1: ZnSO4 + BaCl2 = BaSO4¯ + Zn Cl2 - утворює білий кристалічний осад, який майже не розчиняється у воді й кислотах
112-113. [Ag(NH3)2]Cl – диамінаргентум(І) хлорид. Центр атом Ag+, координат. число – 2.
[NH2Hg]Cl – амін меркурій хлорид. Центр атом Нg2+, координат. число –?.
114. КІ
Катіон1: 2KІ + Na3[Co(NO2)6] = K2Na[Co(NO2)6]¯ + 2NaІ – кристалічний осад жовтого кольору
Аніон 1: 2КI + Cl2 = I2 + 2КCl – утворюється кільце рожево-фіолетового кольору.
115-116. K3[Fe(CN)6] – трикалій гексаціаноферат(ІІІ). Центр атом Fe 3+, координат. число – 6.
Na[Cr(OH)4] - натрій тетрагідроксохромат(ІІІ). Центр атом С r3+, координат. число – 4.
117. NH4NO3
Катіон1: NH4 NO3+ KOH = NH3 + KNO3+H2O – характерний запах, посиніння вологого лакмусового папірця
Аніон3: Дифеніламін (C6H5)2NH у сильнокислому середовищі взаємодіє з нітрат-йонами (та іншими окисниками в тому числі NO2--іонами), утворюючи сполуку синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
118-119. [Cu(NH3)4](NO2)2 – тетраамін купрум(ІІ) динітрит. Центр атом Сu 2+, координат. число – 4.
K2[HgI4] – дикалій тетрайодомеркурат(ІІ). Центр атом Hg2+, координат. число – 4.
120. Характерна реакція на катіон Mg2+
Натрій або амоній гідрогенфосфат (фармакопейна реакція) з йонами Mg2+, якщо є водний розчин аміаку і NH4Cl, утворює білий кристалічний осад MgNH4PO4 × 6H2O:
Mg2++ HPO42–+ NH3+ 6H2O = MgNH4PO4 × 6H2O¯
Mg(NO3)2 + Na2HPO4 + NH4OH = MgNH4PO4¯ + 2NaNO3 + H2O
Характерна реакція на аніон NO3-
Дифеніламін (C6H5)2NH у сильнокислому середовищі взаємодіє з нітрат-йонами (та іншими окисниками в тому числі NO2--йонами), утворюючи сполуку синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
121. 1) Гексанітрокобальтат(III) натрія
2) Гексаціаноферат(III) заліза(II)
123. Характерна реакція на катіон Mg2+
Натрій або амоній гідрогенфосфат (фармакопейна реакція) з йонами Mg2+, якщо є водний розчин аміаку і NH4Cl, утворює білий кристалічний осад MgNH4PO4 × 6H2O:
Mg2++ HPO42–+ NH3+ 6H2O = MgNH4PO4 × 6H2O¯
MgSO4+ Na2HPO4 + NH4OH = MgNH4PO4¯ + Na2SO4 + H2O
Характерна реакція на аніон SO42–
Барій хлорид (фармакопейна реакція), взаємодіючи з сульфат-йонами, утворює білий кристалічний осад, який майже не розчиняється у воді й кислотах:
SO42–+ Ba2+= BaSO4¯
MgSO4 + BaCl2 = BaSO4¯ + MgCl2
127. Характерна реакція на катіон Mg2+
Натрій або амоній гідрогенфосфат (фармакопейна реакція) з йонами Mg2+, якщо є водний розчин аміаку і NH4Cl, утворює білий кристалічний осад MgNH4PO4 × 6H2O:
Mg2++ HPO42–+ NH3+ 6H2O = MgNH4PO4 × 6H2O¯
MgСl2 + Na2HPO4 + NH4OH = MgNH4PO4¯ + 2NaCl + H2O
Характерна реакція на аніон Cl–
Аргентум нітрат осаджує білий осад AgCl, який не розчиняється в розведених кислотах, але добре розчиняється у водному розчині NH3, утворюючи добре розчинну у воді комплексну сполуку – Аргентум аміакат:
Ag+ + Cl–= AgCl¯;
AgCl + 2NH3= [Ag(NH3)2]++ Cl–
MgCl2 + 2AgNO3 = 2AgCl¯ + Mg(NO3)2
131. Характерна реакція на катіон Mn2+
Натрій бісмутат у розчині нітратної кислоти окиснює йони Mn2+ до MnO4– за рівнянням:
2Mn2++ 5BiO3–+ 14H+= 2MnO4–+ 5Bi3++ 7H2O
2MnSO4 + 16HNO3 + 5NaBiO3 = 2HMnO4 + 5Bi(NO3)3 + 2Na2SO4 + NaNO3 + 7H20
За наявності катіонів Mn2+розчин набирає малино-фіолетового кольору.
Характерна реакція на аніон SO42–
Барій хлорид (фармакопейна реакція), взаємодіючи з сульфат-йонами, утворює білий кристалічний осад, який майже не розчиняється у воді й кислотах:
SO42–+ Ba2+= BaSO4¯
MnSO4 + BaCl2 = BaSO4¯ + MnCl2
135. Характерна реакція на катіон Mn2+
Натрій бісмутат у розчині нітратної кислоти окиснює йони Mn2+ до MnO4– за рівнянням:
2Mn2++ 5BiO3–+ 14H+= 2MnO4–+ 5Bi3++ 7H2O
2MnCl2 + 5HNO3 + 16NaBiO3 = 2HMnO4 + 5Bi(NO3)3 + 4NaCl + NaNO3 + 7H20
Характерна реакція на аніон Cl–
Аргентум нітрат осаджує білий осад AgCl, який не розчиняється в розведених кислотах, але добре розчиняється у водному розчині NH3, утворюючи добре розчинну у воді комплексну сполуку – Аргентум аміакат:
Ag+ + Cl–= AgCl¯;
AgCl + 2NH3= [Ag(NH3)2]++ Cl–
MnCl2 + 2AgNO3 = 2AgCl¯ + Mn(NO3)2
139. Характерна реакція на Cd2+
Амоній або Натрій сульфід (NH4)2S або Na2S. Йони Cd2+ з сульфід-йонами утворюють жовтий осад Кадмій сульфіду. Реакція відбувається в нейтральному або кислому середовищі:
Cd2++ HS-= CdS¯ + H+
Cd(NO3)2 + H2S = CdS¯ + 2HNO3
Характерна реакція на аніон NO3-
Дифеніламін (C6H5)2NH у сильнокислому середовищі взаємодіє з нітрат-йонами (та іншими окисниками в тому числі NO2--йонами), утворюючи сполуку синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
140. реакції
141. NH4Cl+NaOH=NaCl+NH4OH
NH4 + +Cl- + Na+ + OH- = NH4OH + Na+ + Cl- – повне
NH4 ++OH- = NH4OH – скорочене
142. SrCl2+CaSO4= SrSO4 + CaCl2
Sr2+ +2Cl- + Ca2+ + SO42- = SrSO4¯ + Ca2+ + 2Cl- – повне
Sr2++ SO42-= SrSO4¯ – скорочене
143. Pb(NO3)2
Характерна реакція на Pb2+
При взаємодії катіону Рb2+ з кількома краплями КІ утворюється осад плюмбуму (ІІ) йодиду жовтого кольору:
Pb(NO3)2 + 2KI = PbI2 ¯ + 2KNO3
Характерна реакція на аніон NO3-
Дифеніламін (C6H5)2NH окиснюється аніонами NO3-, утворюючи сполуку темно-синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
144. ОВР:
145. 2KMn+7O4 + 3NaN+3O2 + H2O = 2Mn+4O2 + 3NaN+5O3 + 2KOH
Mn+7 + 3ел = Mn+4 – відновлення, окисник 3 6 2
N+3 – 2ел = N+5 – окиснення, відновник 2 3
146. 2Cl0 + 2H2O-2 = 4HCl-1 + 2O20
Cl0+ 2ел = 2Cl-1 – відновлення, окисник 2 8 4
2O-2 – 4ел = O0 – окиснення, відновник 4 2
147. CoCl2
Характерна реакція на катіон Со2+
Катіони Со2+ утворюють з калієм (КSCN) або амонієм роданідом (NH4SCN) комплексну сполуку синього кольору (“реакція блакитного кільця”)
CoCl2 + 4KSCN = K2[Co(SCN)4] + 2KCl
Характерна реакція на аніон Cl–
Аргентум нітрат осаджує білий осад AgCl, який не розчиняється в розведених кислотах, але добре розчиняється у водному розчині NH3, утворюючи добре розчинну у воді комплексну сполуку – Аргентум аміакат:
Ag+ + Cl–= AgCl¯;
AgCl + 2NH3= [Ag(NH3)2]++ Cl–
CoCl2+ 2AgNO3 = 2AgCl¯ + Co(NO3)2
148. ОВР:
149. K2Cr2+6O7 + 3Na2S+4O3 + 4H2SO4 = Cr2+3(SO4)3 + 3Na2S+6O4+ K2SO4 +4H2O
2Cr+6 + 6ел = 2Cr+3 – відновлення, окисник 6 6 1
S+4 – 2ел = S+6 – окиснення, відновник 2 3
150. 2KBr-1 + Cl20 = 2KCl-1 + Br20
2Br-1 - 2ел = Br0 – окиснення, відновник 2 2 1
Cl0 + 2ел = 2Cl-1 – відновлення, окисник 2 1
151. CoSO4
Характерна реакція на катіон Со2+
Катіони Со2+ утворюють з калієм (КSCN) або амонієм роданідом (NH4SCN) комплексну сполуку синього кольору (“реакція блакитного кільця”)
CoSO4 + 4KSCN = K2[Co(SCN)4] + K2SO4
Характерна реакція на аніон SO42–
Барій хлорид (фармакопейна реакція), взаємодіючи з сульфат-йонами, утворює білий кристалічний осад, який майже не розчиняється у воді й кислотах:
SO42–+ Ba2+= BaSO4¯
CoSO4 + BaCl2 = BaSO4¯ + CoCl2
152.ОВР:
153. 2KMn+7O4 + 5Na2S+4O2 + 3H2SO4 = 2Mn+2SO4 + K2SO4 + 5Na2S+6O2 + 3H2O
Mn+7 + 5ел = Mn+2 – відновлення, окисник 5 10 2
S+4 – 2ел = S+6 – окиснення, відновник 2 5
154. 2NaI-1 + Cl20 = 2NaCl-1 + I20
2I-1 - 2ел = I0 – окиснення, відновник 2 2 1
Cl0 + 2ел = 2Cl-1 – відновлення, окисник 2 1
155. KNO3
Характерна реакція на катіон К+
Натрій гексанітрокобальтат (III) Na3[Co(NO2)6] (фармакопейна реакція) у нейтральному або ацетатнокислому середовищі утворює з йонами K+ важкорозчинний жовтий кристалічний осад подвійної солі K2Na[Co(NO2)6]:
2K+ + Na3[Co(NO2)6] = K2Na[Co(NO2)6]¯ + 2Na+
2KNO3 + Na3[Co(NO2)6] = K2Na[Co(NO2)6]¯ + 2NaNO3
Характерна реакція на аніон NO3-
Дифеніламін (C6H5)2NH окиснюється аніонами NO3-, утворюючи сполуку темно-синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
156. Дано:V(H2SO4)=25мл=0,025л
V(KOH)=24,5мл=0,0245л
Сн(KOH)=0,1Н
Сн(H2SO4)=?
С1 V1= С2 V2
Сн(H2SO4)* V(H2SO4)= Сн(KOH)* V(KOH)
Сн(H2SO4)= Сн(KOH)* V(KOH) / V(H2SO4)= 0,1*0,0245/0,025=0,098Н
Відповідь: 0,098Н
157. CaCO3
Характерна реакція на катіон Са2+
Амоній оксалат утворює з йонами Са2+ кристалічний осад кальцію оксалату білого кольору, який розчиняється у НСl, але не розчиняється в СН3СООН:
CaCO3 + (NH4)2C2O4 = (NH4)2CO3 + CaC2O4
Характерна реакція на аніон CO32-
Мінеральні кислоти (фармакопейна реакція) (розведені повільно, концентровані енергійніше), а також ацетатна кислота, виділяють вуглекислий газ:
CO32- + 2H+ = CO2 + H2O
Ca(OH)2 + CO2 = CaCO3 ¯ + H2O
158. Дано:V(HCl)=20мл=0,02л
V(NaOH)=15мл=0,015л
Сн(NaOH)=0,2Н
Сн(HCl)=?
С1 V1= С2 V2
Сн(HCl)* V(HCl)= Сн(NaOH)* V(NaOH)
Сн(HCl)= Сн(NaOH)* V(NaOH) / V(HCl)= 0,2*0,015/0,02=0,15Н
Відповідь: 0,15Н
159. Na2CO3
Характерна реакція на катіон Na+
Мікрокристалоскопічна реакція з цинкуранілацетатом Zn(UO2)3(CH3COO)8. Йони Na+ в оцтовокислому середовищі взаємодіють з (Zn(UO2)3(CH3COO)8 + СН3СООН), при цьому утворюється осад зеленувато-жовтого кольору:
Na2CO3 + 2Zn(UO2)3(CH3COO)8 + 2СН3СООН = 2Na Zn(UO2)3(CH3COO)9 + H2CO3
Характерна реакція на аніон CO32-
Мінеральні кислоти (фармакопейна реакція) (розведені повільно, концентровані енергійніше), а також ацетатна кислота, виділяють вуглекислий газ:
CO32- + 2H+ = CO2 + H2O
NaOH + CO2 = NaCO3 ¯ + H2O
161. Характерна реакція на катіон Na+
Мікрокристалоскопічна реакція з цинкуранілацетатом Zn(UO2)3(CH3COO)8.Йони Na+ в оцтовокислому середовищі взаємодіють з (Zn(UO2)3(CH3COO)8+ СН3СООН), при цьому утворюється осад зеленувато-жовтого кольору:
NaCl + Zn(UO2)3(CH3COO)8+ СН3СООН = Na Zn(UO2)3(CH3COO)9¯+ HCl
Характерна реакція на аніон Cl–
Аргентум нітрат осаджує білий осад AgCl, який не розчиняється в розведених кислотах, але добре розчиняється у водному розчині NH3, утворюючи добре розчинну у воді комплексну сполуку – Аргентум аміакат:
Ag+ + Cl–= AgCl¯;
AgCl + 2NH3= [Ag(NH3)2]++ Cl–
NaCl + AgNO3 = AgCl¯ + NaNO3
162. Наведіть класифікацію об’ємних методів аналізу
Залежно від типу реакцій, на якій ґрунтується об’ємно-аналітичне визначення, виділяють такі методи титриметричного аналізу:
· Кислотно-основне титрування(нейтралізація) – ґрунтується на реакції нейтралізації, яка супроводжується зміною концентрації йонів гідроксонію 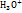 і відповідною зміною рН середовища.
і відповідною зміною рН середовища.
· Оксидометрія – в основі методів оксидиметрії лежать окисно-відновні реакції.
· Осаджуваньне титрування – використовують рекції, в результаті яких утворюються важкорозчинні осади.
· Комплексонометричне титрування – ґрунтується на реакція комплексоутворення.
163. Характерна реакція на катіон Ва2+
Калій дихромат осаджує з розчинів Ва2+ у вигляді осаду BaCrO4жовтого кольору:
2Ba(NO3)2+ K2Cr2O7+ 2CH3COONa + H20 = 2BaCrO4 ¯ + 2KNO3 + 2NaNO3 + 2CH3COOH
Характерна реакція на аніон NO3-
Дифеніламін (C6H5)2NH у сильнокислому середовищі взаємодіє з нітрат-йонами (та іншими окисниками в тому числі NO2--йонами), утворюючи сполуку синього кольору, яка під час дальшого окиснення переходить у безбарвну сполуку.
165. Характерні реакції на катіон Fe3+
Калій гексаціаноферат (II) K4[Fe(CN)6] (фармакопейна реакція) утворює з йонами Fe3+темно-синій осад Fe4[Fe(CN)6]3, так звану берлінську блакить:
4Fe3++ 3[Fe(CN)6]4–= Fe4[Fe(CN)6]3¯
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3¯ + 12KCl
Калій або амоній тіоціанат (KSCN або NH4SCN) – з іонами Fe3+утворює низку забарвлених у червоний колір розчинних комплексних сполук: [FeSCN]2+, [Fe(SCN)2]+, [Fe(SCN)3], [Fe(SCN)4]- тощо.
FeCl3+ 3NH4SCN = Fe(SCN)3+ 3NH4(Cl)
Характерна реакція на аніон Cl–
Аргентум нітрат осаджує білий осад AgCl, який не розчиняється в розведених кислотах, але добре розчиняється у водному розчині NH3, утворюючи добре розчинну у воді комплексну сполуку – Аргентум аміакат:
Ag+ + Cl–= AgCl¯;
AgCl + 2NH3= [Ag(NH3)2]++ Cl–
FeCl3 + 3AgNO3 = 3AgCl¯ + Fe(NO3)3
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 549; Нарушение авторских прав?; Мы поможем в написании вашей работы!