
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приготування розчину
|
|
|
|
Налийте на 1/3 об’єму мірної колби на 100 мл дистильованої води, прилийте з бюретки обчислений об’єм вихідного розчину хлоридної кислоти, перемішайте вміст колби і долийте води до мітки на горлі колби. Концентрація одержаного розчину дорівнює приблизно 0,1 моль-екв/л. Визначити її з високою точністю можна методом об’ємного аналізу – титруванням.
Завдання 2. Визначити точну концентрацію приготованого розчину хлоридної кислоти титруванням.
Закріплену в штативі бюретку заповніть титрованим розчином NaOH і встановіть рівень рідини в бюретці на нульовій поділці. Чистою піпеткою на 10 мл, ополоснутою приготованим розчином НСl, за допомогою груші відберіть 10 мл цього розчину в конічну колбу, додайте 2-3 краплі розчину індикатора фенолфталеїну (безбарвний в кислому середовищі і малиновий – в лужному) і поставте колбу на аркуш білого паперу під бюретку (носик бюретки має на 1-2 см входити в горло колби). При безперервному перемішуванні досліджуваного розчину до нього приливайте з бюретки по краплях розчин натрій гідроксиду до того моменту, поки від однієї краплі лугу розчин в колбі забарвиться в малиновий колір. Це означає, що вся кислота в колбі нейтралізована еквівалентною кількістю лугу, а остання крапля зумовила слабколужну реакцію розчину і зміну забарвлення індикатора. Перше титрування є приблизним.
Точне титрування необхідно провести не менше трьох разів. Послідовність операцій така ж сама. Рівень розчину лугу в бюретці весь час встановлюється на нулі. Луг з бюретки приливайте швидко і тільки останні 1-2 мл – повільно, щоб уловити момент появи забарвлення від однієї краплі лугу.
Результати титрування запишіть в таблицю.
| № титрування | VHCl, мл | VNaOH, мл | СН. NaOH | СН. HCl |
| а | 0,1 | - | ||
| б | 0,1 | - | ||
| с | 0,1 | - | ||
| Середнє | Сер. | 0,1 | Сер. |
Обчисліть СН.(НСl) за формулою, яка виражає закон еквівалентів для розчинів:
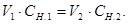
Підставте в формулу VNaOH (середнє).
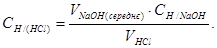
Відсоток похибки досліду обчисліть за формулою:
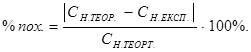
(СН.ТЕОР.= 0,1н.)
Відносна похибка не має перевищувати 1%.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 427; Нарушение авторских прав?; Мы поможем в написании вашей работы!