
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальні закономірності метаболізму. Метаболізм вуглеводів, ліпідів, амінокислот та його регуляція. 1 страница
|
|
|
|
Модуль 2.
Перелік питань та відповіді для підсумкового модульного контролю.
| 1. Біохімічні компоненти клітини, їх біохімічні функції. Класи біомолекул. Ієрархія біомолекул, їх походження. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Біохімічні компоненти клітини. Біомолекули — біоорганічні сполуки, що входять до складу живих організмів та спеціалізовані для утворення клітинних структур і участі в біохімічних реакціях, які становлять сутність обміну речовин та фізіологічних функцій живих клітин.
Функції біомолекул у живих організмах:
а) участь у біохімічних реакціях обміну речовин в ролі субстратів та проміжних продуктів (метаболітів). Прикладами є моносахариди та їх фосфорні ефіри, жирні кислоти та продукти їх окислення, амінокислоти, кетокислоти, дикарбонові кислоти, пуринові та піримідинові основи тощо;
б) участь в утворенні інших, більш складних молекул — білків, нуклеїнових кислот, полісахаридів, ліпідів (наприклад, амінокислоти, нуклеотиди, вищі жирні кислоти тощо), або біологічних структур (мембран, рибосом, ядерного хроматину тощо);
в) участь у регуляції біохімічних процесів та фізіологічних функцій окремих клітин та цілісного організму. Біомолекулами-регуляторами є вітаміни, гормони та гормоноподібні сполуки, внутрішньоклітинні регулятори—циклічні нуклеотиди цАМФ, цГМФ тощо.
Головні класи біомолекул, що складають основу структури та функції живих організмів.
Білки та амінокислоти. Білки - біоорганічні високомолекулярні сполуки, молекули яких є гетерополімерами, побудовані із залишків α-L-амінокислот, об’єднаних кислото-амідними (пептидними) зв’язками (—СО—NН-). Пептиди
(поліпептиди) - біомолекули, що відрізняються від власне білків меншою молекулярною масою (меншою 5-6 кД) та фізико-хімічними характеристиками. При гідролізі природних білків та пептидів вивільняється близько 20 α-L-амінокислот, розміщення кожної з яких в поліпептидному ланцюзі кодується триплетом нуклеотидів в ДНК геному, що кодує даний білок.
Нуклеїнові кислоти та нуклеотиди. Нуклеїнові кислоти — ДНК, РНК — біополімери (біомакромолекули), що складаються з п’яти основних нуклеотидів пуринового та піримідинового ряду, є носіями генетичної інформації у всіх живих організмах, починаючи від найпростіших вірусів до організму людини.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ферменти: визначення; властивості ферментів як біологічних каталізаторів. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ферменти (ензими) - біологічні каталізатори білкової природи, які синтезуються в клітинах живих організмів і забезпечують необхідні швидкість і координацію біохімічних реакцій, що становлять обмін речовин (метаболізм). Властивості ферментів - ферменти значно підвищують швидкість перебігу біохімічних реакцій, але не входять до складу кінцевих продуктів реакції; - ферменти забезпечують перебіг лише тих біохімічних реакцій, які можливі згідно з законами термодинаміки; - ферменти прискорюють швидкість як прямої, так і зворотної реакції перетворення субстрату, не змінюючи константи рівноваги (Кр) реакції та зменшуючи термін часу до досягнення стану рівноваги (або стаціонарного стану у відкритій метаболічній системі); - протягом реакції фермент певним чином взаємодіє із субстратом, що перетворюється, але до складу кінцевих продуктів реакції не входить. Під час перебігу біохімічної реакції, що каталізується, відбувається циклічний процес, в ході якого фермент та субстрат підлягають ступінчастому перетворенню з утворенням продукту реакції та регенерацією ферменту; - ферменти є високоспецифічними каталізаторами, тобто діють, як правило, на структурно близькі субстрати, що мають певний хімічний зв’язок, структурно подібні радикали або функціональні групи. Проявом високої специфічності ферментів є їх стереоспецифічність, тобто здатність перетворювати тільки певні стереоізомери, наприклад L- або L-амінокислоти, D- або L-моносахариди; - відповідно до білкової природи, каталітична активність ферментів дуже чутлива до змін фізико-хімічних властивостей середовища (рН, температури), які можуть впливати на структурну організацію молекул ферментів, спричиняючи в певних умовах їх денатурацію; - активність ферментів може суттєво змінюватися під впливом певних хімічних сполук, що збільшують (активатори) або зменшують (інгібітори) швидкість реакції, яка каталізується. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Класифікація та номенклатура ферментів, характеристика окремих класів ферментів. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Класифікація ферментів Ферменти поділяють на класи згідно з типом реакції, яку вони каталізують; класи ферментів поділяють на підкласи, а останні - на підпідкласи, у складі яких кожному ферменту відповідає певний номер. 1-й клас. Оксидоредуктази - ферменти, що каталізують окислювально-відновлювальні реакції різних типів. До оксидоредуктаз належать дегідрогенази - ферменти, що каталізують реакції дегідрування; оксидази та оксигенази, що окислюють субстрати шляхом приєднання кисню; цитохроми - переносники електронів тощо. 2-й клас. Трансферази - ферменти, що каталізують реакції міжмолекулярного переносу хімічних груп. Трансферази поділяють на амінотрансферази, метилтрансферази, ацил-трансферази, фосфотрансферази, глікозилтрансферази — ферменти, що переносять амінні, метальні, ацильні, фосфатні, глікозильні групи відповідно. До трансфераз належать також кінази, зокрема протеїнкінази - ферменти, що каталізують фосфорилування субстратів та інших білків за рахунок фосфатного залишку АТФ. 3-й клас. Гідролази - ферменти, що каталізують реакції гідролізу, тобто розщеплення субстратів за участю молекули води. Гідролази здатні розщеплювати складноефірні, пептидні, глікозидні та інші зв’язки - естерази, пептидази та протеази, глікозидази. 4-й клас. Ліази - ферменти, що каталізують реакції розщеплення ковалентних зв’язків між атомами С, О, N, S негідролітичним шляхом. До ліаз належать декарбоксилази - ферменти, що відщеплюють від органічних кислот карбоксильну групу у вигляді С02; альдолази, що розщеплюють вуглець-вуглецеві зв’язки з утворенням альдегідів; дегідратази, які відщеплюють від субстратів молекулу води з утворенням подвійного зв’язку. 5-й клас. Ізомерази - ферменти, що каталізують реакції ізомеризації субстратів (рацемізації, епімеризації, внутрішньомолекулярної оксидоредукції тощо) - рацемази, епімерази тощо. 6-й клас. Лігази (синтетази) - ферменти, що каталізують реакції синтезу біомолекул, тобто утворення нових хімічних зв’язків за рахунок енергії АТФ. Код ферменту (за систематичною класифікацією ферментів - КФ) складається з чотирьох цифр, що позначають: клас - підклас - підпідклас - порядковий номер ферменту в підпідкласі. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Будова та механізми дії ферментів. Активний та алостеричний (регуляторний) центри. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Більшість ферментів має чотири рівні структурної організації (первинну, вторинну, третинну і четвертинну), тобто є олігомерними білками, що складаються із протомерів. Кожна із субодиниць або окремі їх частини відіграють певну роль у процесі функціонування ферменту. Прості (однокомпонентні) ферменти здійснюють ферментативне перетворення субстрату з участю власне білкової молекули. Безпосередню участь у реакції бере не весь поліпептидний ланцюг ферменту, а тільки незначна його частина, що близько прилягає до субстрату. У ферментативну реакцію включається тільки декілька залишків амінокислот. Ці залишки можуть розташовуватися в поліпептидному ланцюзі як поруч, так і далеко один від одного, але просторово вони повинні бути досить зближені. Та частина молекули ферменту, яка з'єднується із субстратом, називається активним центром ферменту. Активний центр відповідає за специфічну спорідненість ферменту із субстратом, утворення ферменто-субстратного комплексу і каталітичне перетворення субстрату. В активному центрі ферменту умовно розрізняють так звану каталітичну ділянку, де відбувається каталітичне перетворення субстрату, і контактну, або якірну ділянку, що зв'язує фермент із субстратом. За утворення активного центру ферменту, як і за його каталітичну дію, відповідає третинна структура білкової молекули. Отже, при порушенні третинної структури (денатурація) роз'єднуються просторово поєднані амінокислотні залишки і, як наслідок, фермент втрачає активність. У складі активного центру простого ферменту знаходиться приблизно 15 залишків амінокислот. Активний центр утворюють залишки таких амінокислот, як серин, цистеїн, гістидин, тирозин, лізин та деякі інші, що надають ферменту як просторової, так і електричної спорідненості із субстратом. В утворенні тимчасового комплексу між ферментом і субстратом важлива роль належить дисульфідним, іонним, а також слабким зв'язкам (водневі зв'язки, гідрофобна взаємодія). В утворенні активних центрів беруть участь також кофактори даного ферменту: простетичні групи, іони металів. Активний центр складних (двокомпонентних) ферментів містить у своєму складі як кофермент, так і ту частину апоферменту, що просторово прилягає до нього. Кофермент при цьому може відповідати за утворення зв'язку із субстратом, формування третинної або четвертинної структури апоферменту і каталітичне перетворення субстрату. Ферменти можуть мати 1, 2, 3 і більше активних центрів, що залежить від кількості протомерів (субодиниць), які входять у його структуру. Крім активних центрів, у ферментах можуть бути ще так звані алостеричні центри (від грец. алос — інший, другий; стереос — просторовий, структурний). Алостеричні центри служать місцем впливу на фермент різних регуляторних чинників, тому їх ще називають регуляторними центрами, а речовини, що взаємодіють з алостеричним центром, отримали назву ефекторів. Приєднання до алостеричного центру ефектора призводить до певних структурних змін в активному центрі та, як наслідок, пригнічення або підвищення активності ферменту. Ефекторами можуть служити продукти ферментативних реакцій, гормони, медіатори нервової системи, метали. Алостеричних центрів (як і активних) фермент може мати декілька, відповідно до кількості протомерів. Важливо зазначити, що алостеричні й активні центри у ферментах просторово відокремлені, тобто знаходяться один від одного на певній відстані. Механізми дії ферментів Ферменти збільшують швидкості біохімічних реакцій, які вони каталізують, у 108-1020 разів; при відсутності ферменту будь-яка метаболічна реакція практично не відбувається. Відомо, що константа швидкості хімічної реакції залежить від її енергії активації та температури, що виражається рівнянням Арреніуса в експоненційній формі: k = Ае-∆Е/RT. Під енергією активації (∆Е в рівнянні Арреніуса) в хімічній термодинаміці розуміють додаткову енергію, необхідну для переходу молекул (субстратів S) у перехідний (активований) стан (S*), який передує їх перетворенню в продукти реакції. Згідно з цим, експоненційний член рівняння е-∆Е/RT (фактор Больцмана) - частка молекул у системі, які мають енергію, достатню для хімічного перетворення. Оскільки всі метаболічні процеси в живих організмах перебігають в ізотермічних умовах, каталітична дія ферментів реалізується за рахунок зниження енергії активації (∆Е) біохімічної реакції, що збільшує фактор Больцмана і, відповідно, константу швидкості реакції на декілька порядків. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Кофактори та коферменти. Будова та властивості коферментів; вітаміни як попередники в біосинтезі коферментів. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кофактори та коферменти Кофактори.Багато ферментів потребують для реалізації своєї каталітичної активності наявності певних низькомолекулярних небілкових сполук кофакторів. Роль кофакторів можуть відігравати біоорганічні сполуки різної хімічної природи або іони металів (Mg2+, Ca2+, Fe3+, Fe2+, Cu2+, Cuj+ та ін.). Іони металів зв'язані з апоферментом або входять до складу небілкової простетичної групи - найчастіше порфіринового кільця гемінових ферментів (цитохромів, пероксидаз, каталази). Ферменти, які міцно зв'язані з іонами металів і не втрачають цього зв'язку за умов виділення та фракціонування ферменту, назваються металоферментами. У деяких випадках іони металів не входять до складу ферментів як інтегральні структурні компоненти, а виконують лише функцію їх активаторів. Коферменти (коензими) — біоорганічні сполуки небілкової природи, що є необхідними для дії ферменту, тобто перетворення субстрату в каталітичному акті. Коферменти можуть сполучатися з білковою частиною (апоферментом) нековалентними фізико-хімічними або ковалентними зв'язками (в останньому випадку вони є простетичними групами ферментного білка - флавінові коферменти, піридоксаль-фосфат, ліпоєва кислота тощо); інколи коферменти утворюють комплекси з апоферментом лише в ході каталітичного процесу (НАД, НАДФ). За хімічною природою коферменти підрозділяють на: - похідні вітамінів, зокрема: вітаміну В, - тіаміндифосфат; вітаміну В2 - флавінмононуклеотид (ФМН); вітаміну В6 - піридоксальфосфат, піридоксамінфосфат; пантотенової кислоти - коензим А; вітаміну В12 - метилкобаламін, дезоксиаденозилкобаламін; вітаміну Н (біотину) - карбоксибіотин; фолієвої кислоти - тетрагідрофолієва кислота; - динуклеотиди (похідні нікотинаміду - НАД, НАДФ; похідна рибофлавіну - ФАД); - нуклеотиди - похідні пуринів та піримідинів (АТФ, АДФ, ЦТФ, ЦДФ, УТФ, УДФ); - комплекси порфіринів з іонами металів. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. Коферменти: типи реакцій, які каталізують окремі класи коферментів. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7. Вітамін В1 (тіамін): будова, біологічні властивості, механізм дії. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8. Вітамін В2 (рибофлавін): будова, біологічні властивості, механізм дії. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9. Вітамін РР (нікотинова кислота, нікотинамід): будова, біологічні властивості, механізм дії. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10. Вітамін В6 (піридоксин): будова, біологічні властивості, механізм дії. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11. Вітамін В12 (кобаламін): біологічні властивості, механізм дії. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Вітамін В12 — один із найскладніших за структурою вітамінів. Молекула його складається із двох частин: хромофорної (тетрапірольна сполука, подібна до гему, так зване коринове ядро, що містить кобальт) і нуклеотидної. Пірольні кільця містять як замінники різні радикали — метильні, ацетамідні (СН3 СО NН2), пропіонамідні (СН3 СH2 СО NН2). Атом кобальту зв'язаний із чотирма азотами пірольних кілець. Під час виділення вітаміну одержують ще і ціановий радикал (-СN), але це артефакт виділення. Нуклеотидна частина представлена 5,6-диметил-бензімід-азолрибонуклеотидом. Вітамін В12 не синтезується ні в рослинах, ні в тваринних організмах. Його здатні утворювати тільки мікроорганізми. Основним джерелом вітаміну В12 для людини є продукти тваринного походження — печінка, нирки, серце, м'ясо та ін. Частково він синтезується мікрофлорою кишечника за умов надходження з їжею кобальту. Добова потреба у вітаміні В12 для дорослої людини складає 2,5-5 мкг. Всмоктування кобаламіну відбувається в тонкій кишці. Але для цього необхідний так званий внутрішній фактор Кастла, що утворюється в обкладкових клітинах шлунка. За своєю природою він являє собою глікопротеїн, який має здатність вибірково зв'язуватись з вітаміном В12. Комплекс вітамін В12 — внутрішній фактор заноситься в кишечник, тут відбувається приєднання його до специфічних рецепторів мембран ентероцитів, перенесення через мембрану і всмоктування. Встановлено, що кофермент метилкобаламін входить до складу ферменту, який переносить метильну групу 5-метилтетрагідрофолієвої кислоти на гомоцистеїн з утворенням метіоніну. Таким чином, вітамін В12 функціонально тісно пов'язаний із фолієвою кислотою. Разом з нею він сприяє синтезу метіоніну, утворенню креатину, пуринових і піримідинових основ, амінокислот, білків, нуклеїнових кислот і ін. Кофермент дезоксиаденозилкобаламін у складі ферменту метилмалоніл КоА-мутази перетворює метилмалоніл-КоА в сукциніл-КоА. Ця реакція має місце в завершальній стадії окиснення жирних кислот з непарною кількістю вуглецевих атомів у циклі Кребса, окисненні бокового ланцюга холестерину, тиміну, амінокислот (метіонін, ізолейцин, треонін, валін). Встановлено, що кобаламін сприяє депонуванню та утворенню коферментних форм фолієвої кислоти і за рахунок цього бере участь в синтезі ДНК і проліферації кровотворних клітин. Гіповітаміноз В12 виникає найчастіше як ускладнення гастриту, зокрема при гіпо- або анацидних гастритах, після оперативного видалення шлунка чи частини його, де виробляється внутрішній фактор. Тому вітамін В12 не всмоктується, він виводиться з калом і як наслідок розвивається злоякісна анемія Адісона-Бірмера, або мегалобластична. Порушення кровотворення при цьому гіповітамінозі аналогічні тим, що мали місце у хворих з дефіцитом фолієвої кислоти. Але при нестачі кобаламіну спостерігається підвищення виділення з сечею метилмалонової кислоти, яка не засвоюється; можливі також ураження задніх і бокових стовпів спинного мозку (фунікулярний мієлоз). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12. Вітамін Вс (фолієва кислота): біологічні властивості, механізм дії. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Вітамін В10 (фолієва кислота, фоліацин, антианемічний).За хімічною природою це птероїлглугамінова кислота. В основі її будови лежать залишки циклічної сполуки птерину, параамінобензойної та глутамінової кислот. Для дорослої людини добова потреба в цьому вітаміні складає 0,2-0,5 мг. Основним джерелом фолієвої кислоти для людини є рослинна і тваринна їжа. Багато її міститься в листках рослин, овочах, фруктах, а також у печінці та м'ясі. Додатковим джерелом фолієвої кислоти є і мікрофлора кишечника. Всмоктується фолієва кислота в тонкій кишці, де з неї утворюється тетрагідрофолієва кислота (ТГФК). Процес відбувається у дві стадії. Спочатку за допомогою ферменту фолатредуктази утворюється дигідрофолієва кислота (ДГФК), яка з участю іншого ферменту — дигідрофолатредуктази — відновлюєтьсяя до ТГФК. Після відновлення фолієвої кислоти в 5, 6, 7, 8 положеннях вона, перетворившись у ТГФК, набуває властивостей коферменту. У такій активній формі фолієва кислота бере участь в обміні одновуглецевих залишків: метильних — СН3, оксиметильних — СН2ОН, формільних — НСО та ін., які, приєднуючись до ТГФК, переносяться на різні сполуки. Саме тому ця кислота має відношення до біосинтезу азотистих основ нуклеїнових кислот, креатину, метіоніну, гліцину, серину й ін. Оскільки ці речовини є необхідним компонентом біосинтезу білків і нуклеїнових кислот, стає зрозумілим значне порушення обміну речовин, поділу клітин та зупинка росту організму при нестачі фолієвої кислоти. Вітамін В10 (фолієва кислота, фоліацин, антианемічний).За хімічною природою це птероїлглугамінова кислота. В основі її будови лежать залишки циклічної сполуки птерину, параамінобензойної та глутамінової кислот. Для дорослої людини добова потреба в цьому вітаміні складає 0,2-0,5 мг. Основним джерелом фолієвої кислоти для людини є рослинна і тваринна їжа. Багато її міститься в листках рослин, овочах, фруктах, а також у печінці та м'ясі. Додатковим джерелом фолієвої кислоти є і мікрофлора кишечника. Всмоктується фолієва кислота в тонкій кишці, де з неї утворюється тетрагідрофолієва кислота (ТГФК). Процес відбувається у дві стадії. Спочатку за допомогою ферменту фолатредуктази утворюється дигідрофолієва кислота (ДГФК), яка з участю іншого ферменту — дигідрофолатредуктази — відновлюєтьсяя до ТГФК. Після відновлення фолієвої кислоти в 5, 6, 7, 8 положеннях вона, перетворившись у ТГФК, набуває властивостей коферменту. У такій активній формі фолієва кислота бере участь в обміні одновуглецевих залишків: метильних — СН3, оксиметильних — СН2ОН, формільних — НСО та ін., які, приєднуючись до ТГФК, переносяться на різні сполуки. Саме тому ця кислота має відношення до біосинтезу азотистих основ нуклеїнових кислот, креатину, метіоніну, гліцину, серину й ін. Оскільки ці речовини є необхідним компонентом біосинтезу білків і нуклеїнових кислот, стає зрозумілим значне порушення обміну речовин, поділу клітин та зупинка росту організму при нестачі фолієвої кислоти.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13. Вітамін Н (біотин): біологічні властивості, механізм дії. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
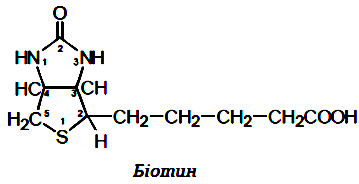 Вітамін Н (біотин, антнсеборейннй).За хімічною природою вітамін Н являє собою сполуку, що складається із тіофену та імідазолу, до яких приєднана валеріанова кислота. Можна також розглядати біотин як сполуку, що утворилася в результаті конденсації сечовини із тіофенвалеріановою кислотою (2'-кето,3,4-імідазолідо-2-тетрагідротіофенвалеріанова кислота). Біотин є коферментом у реакціях приєднання СО2 (точніше, іонів гідрокарбонату). В "біотинових" ферментах молекула біотину приєднана до апоферменту амідним зв'язком із кінцевою NH2-групою лізину, що входить в активний центр ферменту. Коферментною формою біотину вважається N5-карбоксибіотин. Він входить до складу піруваткарбоксилази, ацетил-КоА-карбоксилази, пропіоніл-КоА-карбоксилази та інших ферментів. Отже, біотин має відношення до утворення щавлевооцтової кислоти, глюконеогенезу, утворення жирних кислот, окиснення пропіонової кислоти в циклі Кребса. Вітамін Н (біотин, антнсеборейннй).За хімічною природою вітамін Н являє собою сполуку, що складається із тіофену та імідазолу, до яких приєднана валеріанова кислота. Можна також розглядати біотин як сполуку, що утворилася в результаті конденсації сечовини із тіофенвалеріановою кислотою (2'-кето,3,4-імідазолідо-2-тетрагідротіофенвалеріанова кислота). Біотин є коферментом у реакціях приєднання СО2 (точніше, іонів гідрокарбонату). В "біотинових" ферментах молекула біотину приєднана до апоферменту амідним зв'язком із кінцевою NH2-групою лізину, що входить в активний центр ферменту. Коферментною формою біотину вважається N5-карбоксибіотин. Він входить до складу піруваткарбоксилази, ацетил-КоА-карбоксилази, пропіоніл-КоА-карбоксилази та інших ферментів. Отже, біотин має відношення до утворення щавлевооцтової кислоти, глюконеогенезу, утворення жирних кислот, окиснення пропіонової кислоти в циклі Кребса.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 14. Вітамін В3 (пантотенова кислота): біологічні властивості, механізм дії. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 15. Вітамін С (аскорбінова кислота): будова, біологічні властивості, механізм дії. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16. Вітамін Р (флавоноїди): будова, біологічні властивості, механізм дії. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17. Ізоферменти, особливості будови та функціонування, значення в діагностиці захворювань. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 18. Механізми дії та кінетика ферментативних реакцій: залежність швидкості реакції від концентрації субстрату, рН та температури. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
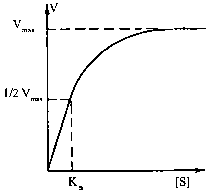
Залежність швидкості реакції від концентрації ферменту та субстрату. Швидкість ферментативної реакції буде прямо пропорційно залежати від концентрації ферменту, а саме: V = k [E], тобто збільшення в клітині рівня певного ферментного білка повинно супроводжуватися зростанням швидкості реакції, що каталізується цим ферментом. Складнішою є залежність швидкості ферментативної реакції від концентрації субстрату.
Графічно ця залежність зображується гіперболою. Як видно з ходу гіперболи, ця залежність має складний характер: при низьких концентраціях субстрату швидкість реакції прямо пропорційна його концентрації (реакція першого порядку), а при високих концентраціях досягається ефект насичення, тобто незалежність V від [S]. Рівняння залежності V від [S], або рівняння Міхаеліса - Ментен: 
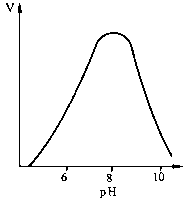 Залежність швидкості реакції від рН та температури. Кожен фермент має свій рН-оптимум, тобто значення рН середовища, при якому його каталітична активність максимальна. "Дзвоноподібна" залежність активностей ферментів від змін рН визначається їх білковою природою, зсувами в дисоціації іоногенних груп та (при екстремальних значеннях рН) розвитком конформаційних змін молекул. Більшість внутрішньоклітинних та тканинних ферментів організму людини найактивніші в нейтральному, слаболужному або слабокислому середовищі (зазвичай у межах рН між 5,0 та 9,0). Ферментами з оптимумами при екстремальних значеннях рН є пепсин (рН = 1-2) і аргіназа (рН = 10-11). Залежність швидкості реакції від рН та температури. Кожен фермент має свій рН-оптимум, тобто значення рН середовища, при якому його каталітична активність максимальна. "Дзвоноподібна" залежність активностей ферментів від змін рН визначається їх білковою природою, зсувами в дисоціації іоногенних груп та (при екстремальних значеннях рН) розвитком конформаційних змін молекул. Більшість внутрішньоклітинних та тканинних ферментів організму людини найактивніші в нейтральному, слаболужному або слабокислому середовищі (зазвичай у межах рН між 5,0 та 9,0). Ферментами з оптимумами при екстремальних значеннях рН є пепсин (рН = 1-2) і аргіназа (рН = 10-11).
 Вплив температури на активність ферментів. Ферменти, відповідно до своєї білкової природи, є термочутливими та термолабільними утвореннями: Вплив температури на активність ферментів. Ферменти, відповідно до своєї білкової природи, є термочутливими та термолабільними утвореннями:
 - зростання температури до оптимальних значень (для більшості ферментів - у межах 37-40 °С) супроводжується збільшенням швидкості ферментативної реакції відповідно за рівнянням Арреніуса (за рахунок частіших ефективних зіткнень між молекулами); ступінь збільшення швидкості реакції при зростанні t на 10 °С позначають як температурний коефіцієнт Q10;
- при збільшенні температури вище оптимального значення швидкість ферментативної реакції різко зменшується за рахунок конформаційних (денатураційних) змін у структурі ферментного білка. - зростання температури до оптимальних значень (для більшості ферментів - у межах 37-40 °С) супроводжується збільшенням швидкості ферментативної реакції відповідно за рівнянням Арреніуса (за рахунок частіших ефективних зіткнень між молекулами); ступінь збільшення швидкості реакції при зростанні t на 10 °С позначають як температурний коефіцієнт Q10;
- при збільшенні температури вище оптимального значення швидкість ферментативної реакції різко зменшується за рахунок конформаційних (денатураційних) змін у структурі ферментного білка.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19. Активатори та інгібітори ферментів: приклади та механізми дії. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Активування ферментів.Речовини, які підвищують активність ферментів, одержали назву активаторів. Присутність активатора вкрай важлива для ферменту. До активаторів належать кофактори, іони металів, різноманітні модифікатори тощо. Субстрат у певних межах концентрацій є активатором - після досягнення насичених концентрацій субстрату активність ферменту не зростає. Субстрат полегшує формування потрібної конформації активного центру ферменту (індукція), підвищує його стабільність. Досить часто роль активаторів виконують іони металів: вони можуть входити до складу каталітичної ділянки активного центру ферменту; сприяти зв'язуванню субстрату з посадочною ділянкою ферменту (зв'язуючий місток); іноді метали можуть сполучатися не з ферментом, а із субстратом, утворюючи металосубстратний комплекс, на який краще діє фермент; вони можуть діяти непрямим шляхом, зв'язуючи присутній інгібітор тощо. Активація деяких ферментів може здійснюватися шляхом приєднання до алостеричного центру ферменту якої-небудь специфічної модифікуючої групи, що сприяє змінюванню конформації ферменту і його активного центру. Прикладами можуть бути іони хлору, які є активаторами амілази слини; іони водню, які підвищують активність пепсину; жовчні кислоти, які посилюють дію ліпази підшлункової залози; лужна фосфатаза може активуватися катіонами. Активація деяких ферментів (особливо тих, що виробляються в шлунково-кишковому тракті) може відбуватися протеолітичним шляхом. Спочатку ферменти виробляються в неактивній формі у вигляді проферментів або зимогенів (попередників ферментів), у яких активний центр замаскований додатковою ділянкою пептидного ланцюга. Внаслідок цього субстрат не може з'єднатися з активним центром. Видалення такої додаткової ділянки може відбуватися різними шляхами і сприяє звільненню активного центру та можливості утворення фермент-субстратного комплексу. Наприклад, проферментом пепсину є пепсиноген, який виробляється в стінках шлунка. Відщеплення від його молекули невеликого пептидного ланцюга за участю соляної кислоти в шлунку призводить до утворення пепсину і формування його активного центру. Профермент трипсиноген утворюється в підшлунковій залозі, до складу його поліпептидного ланцюга входить 229 амінокислотних залишків. У дванадцятипалій кишці під впливом ферменту ентерокінази розривається пептидний зв'язок між 6 і 7 амінокислотними залишками і відщеплюється гек-сапептид. Після відщеплення гексапептиду створюються умови, які сприяють утворенню активного центру ферменту, і трипсиноген перетворюється в трипсин. Цей же процес може здійснюватися аутокаталітично, тобто під впливом уже утворених трипсину і пепсину - у випадку пепсиногену. Інгібітори ферментів.Інгібітори - хімічні сполуки, що зменшують каталітичну активність ферментів. Навідміну від речовин, які інактивують ферменти за рахунок їх денатурації (концентровані кислоти та луги, солі важких металів у високих концентраціях), дія інгібіторів є специфічною стосовно певних ферментів або груп ферментів, вони мають низьку концентрацію. За допомогою інгібіторів отримують цінну інформацію про специфічність дії ферментів, природу функціональних груп їх активних центрів, про механізм дії і т. ін. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 20. Типи інгібування ферментів: зворотнє (конкурентне, неконкурентне) та незворотнє інгібування. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Залежно від характеру змін, що відбуваються в молекулі ферменту, розрізняють: 1) оборотне інгібування, що описується таким рівнянням взаємодії ферменту з інгібітором І:  2) необоротне інгібування: 2) необоротне інгібування: 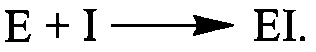 Оборотне інгібування ферментів, залежно від механізму взаємодії ферменту з інгібітором, поділяється на конкурентне та неконкурентне. Конкурентне інгібування спричиняють ліганди, що за своєю хімічною структурою близькі до субстрату і взаємодіють із тим самим активним центром на молекулі ферменту, що і субстрат, утворюючи комплекс ЕІ: Оборотне інгібування ферментів, залежно від механізму взаємодії ферменту з інгібітором, поділяється на конкурентне та неконкурентне. Конкурентне інгібування спричиняють ліганди, що за своєю хімічною структурою близькі до субстрату і взаємодіють із тим самим активним центром на молекулі ферменту, що і субстрат, утворюючи комплекс ЕІ:  Класичним прикладом конкурентного інгібітора є малонова кислота яка про тидіє зв'язуванню активним центром ферменту сукцинатдегідрогенази справжнього субстрату - бурштинової кислоти (сукцинату). Конкурентне інгібування викликають різні антиметаболіти, тобто сполуки, близькі за будовою до справжніх клітинних метаболітів: антивітаміни; речовини, близькі до амінокислот, пуринових та піримідинових основ і нуклеотидів. У зв'язку з високою біологічною активністю деякі антиметаболіти застосовують як
антибактеріальні засоби (сульфаніламіди, антибіотики), протипухлинні препарати. Конкурентне інгібування ферменту можна перебороти за рахунок підвищення концентрації субстрату в інкубаційному середовищі. Неконкурентні інгібітори не мають структурної подібності до субстрату. Вони реагують з іншими, відмінними від активних центрів, ділянками на молекулі ферменту і можуть зв'язуватися не тільки з вільним ферментом, а й із фермент-субстратним комплексом: Класичним прикладом конкурентного інгібітора є малонова кислота яка про тидіє зв'язуванню активним центром ферменту сукцинатдегідрогенази справжнього субстрату - бурштинової кислоти (сукцинату). Конкурентне інгібування викликають різні антиметаболіти, тобто сполуки, близькі за будовою до справжніх клітинних метаболітів: антивітаміни; речовини, близькі до амінокислот, пуринових та піримідинових основ і нуклеотидів. У зв'язку з високою біологічною активністю деякі антиметаболіти застосовують як
антибактеріальні засоби (сульфаніламіди, антибіотики), протипухлинні препарати. Конкурентне інгібування ферменту можна перебороти за рахунок підвищення концентрації субстрату в інкубаційному середовищі. Неконкурентні інгібітори не мають структурної подібності до субстрату. Вони реагують з іншими, відмінними від активних центрів, ділянками на молекулі ферменту і можуть зв'язуватися не тільки з вільним ферментом, а й із фермент-субстратним комплексом:  . Приєднання неконкурентного інгібітора до ферменту зменшує його активність (максимальну швидкість реакції (V), але не впливає на спорідненість ферменту із субстратом. Неконкурентними інгібіторами є іони важких металів (Cu2+, Hg2+, Ag+) та їх похідні, що оборотно зв'язуються із SH-групами цистеїну в молекулах ферментів.
Необоротне інгібування ферментів - процес, що відбувається внаслідок руйнування або необоротної хімічної модифікації однієї чи декількох функціональних груп ферменту. Необоротні інгібітори мають властивості клітинних отрут. Прикладом такої модифікації молекули ферменту є дія алкілуючих агентів (зокрема, йодацетаміду), що необоротно реагують із каталітично активними SH-групами: . Приєднання неконкурентного інгібітора до ферменту зменшує його активність (максимальну швидкість реакції (V), але не впливає на спорідненість ферменту із субстратом. Неконкурентними інгібіторами є іони важких металів (Cu2+, Hg2+, Ag+) та їх похідні, що оборотно зв'язуються із SH-групами цистеїну в молекулах ферментів.
Необоротне інгібування ферментів - процес, що відбувається внаслідок руйнування або необоротної хімічної модифікації однієї чи декількох функціональних груп ферменту. Необоротні інгібітори мають властивості клітинних отрут. Прикладом такої модифікації молекули ферменту є дія алкілуючих агентів (зокрема, йодацетаміду), що необоротно реагують із каталітично активними SH-групами:
 Практично важливим прикладом необоротного інгібування ферменту шляхом ковалентного зв'язування інгібітора з активним центром є вплив фосфорорганічних сполук (ФОС) на активність ферменту ацетилхолінестерази (АХ-естерази). Препарати ФОС є високотоксичними отрутами відносно комах (пестициди) та теплокровних тварин, механізм антихолінестеразного ефекту яких полягає у взаємодії з ОН-групою серину в активному центрі ферменту.
Практично важливим прикладом необоротного інгібування ферменту шляхом ковалентного зв'язування інгібітора з активним центром є вплив фосфорорганічних сполук (ФОС) на активність ферменту ацетилхолінестерази (АХ-естерази). Препарати ФОС є високотоксичними отрутами відносно комах (пестициди) та теплокровних тварин, механізм антихолінестеразного ефекту яких полягає у взаємодії з ОН-групою серину в активному центрі ферменту.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 21. Регуляція ферментативних процесів. Шляхи та механізми регуляції: алостеричні ферменти; ковалентна модифікація ферментів. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Існують два принципових шляхи регуляції інтенсивності, або швидкості біохімічних ферментативних реакцій: А - через зміну каталітичної активності ферменту. Б - через зміну кількості ферменту (або ферментів), що визначають перебіг ферментативного процесу. А. Перший шлях регуляції передбачає наявність у ферментному пулі клітини спеціальних регуляторних ферментів, які містяться звичайно на головних, ключових ланках метаболізму. Цей шлях забезпечує термінову адаптацію ферментного апарату організму і реалізується протягом декількох секунд або хвилин - механізм "швидкого реагування". Існують чотири основних механізми регуляції каталітичної активності ферментів (L. Stryer, 1995): 1. Алостерична регуляція активності ферментів. 2. Регуляція активності ферментів за рахунок їх ковалентної модифікації. 3. Активація ферментів шляхом обмеженого протеолізу. 4. Активація та гальмування активностей ферментів за допомогою особливих регуляторних білків. Алостеричні ферменти - це різновид регуляторних ферментів, що, крім активного центру, мають додатковий регуляторний (алостеричний) центр, з яким взаємодіють алостеричні регулятори (ефектори, модулятори). Алостеричні ефектори можуть бути як позитивними, тобто такими, що збільшують каталітичну активність ферменту (алостеричні активатори), так і негативними, тобто такими, що її гальмують (алостеричні інгібітори). За своєю молекулярною будовою алостеричні регуляторні ферменти складаються, як правило, з декількох поліпептидних ланцюгів, тобто мають четвертинну структуру. Активний та регуляторний (алостеричний) центри локалізуються на різних білкових субодиницях - каталітичній ті регуляторній, відповідно. Модифікація каталітичної активності такого ферменту здійснюється шляхом передачі на каталітичні субодиниці конформаційних змін із регуляторних субодиниць, які відбуваються в останніх після взаємодії з лігандами - ефекторами. Ковалентна модифікація ферментів.Постсинтетична ковалентна модифікація ферментних білків є одним із поширених механізмів контролю за перебігом метаболічних процесів. Шляхами такої модифікації є оборотне фосфорилування-дефосфорилування (найбільш поширений механізм регуляції), метилування, аденілування, АДФ-рибозилування білків-ферментів. Б. Другий шлях регуляції є механізмом довготривалої адаптації ферментного апарату. Для його включення і повної реалізації необхідно декілька годин або діб. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 22. Циклічні нуклеотиди (цАМФ, цГМФ) як регулятори ферментативних реакцій та біологічних функцій клітини. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Важливою та поширеною біологічною системою контролю за ферментативними реакціями, що поєднує в собі різні молекулярні механізми регуляції, є система циклічних нуклеотидів. Циклічні нуклеотиди 3',5'-АМФ (цАМФ) та 3',5' ГМФ (цГМФ) - це внутрішні (3'5' дифосфорні ефіри аденілової (АМФ) та гуанілової (ГМФ) кислот. Найбільш поширеними є цАМФ-залежні системи контролю за внутрішньоклітинними біохімічними процесами, зокрема за такими, що підлягають нейрогуморальній регуляції з боку цілісного організму, яка реалізується гормонами та нейромедіаторами. Регуляція ферментативних процесів за участю цАМФ включає декілька послідовних
стадій передавання і трансформації хімічного (регуляторного) сигналу.
1. Утворення циклічних нуклеотидів у реакціях, що каталізуються ферментами циклазами: аденілатциклазою та гуанілатциклазою з нуклеозидтрифосфатів АТФ та ГТФ, відповідно: Важливою та поширеною біологічною системою контролю за ферментативними реакціями, що поєднує в собі різні молекулярні механізми регуляції, є система циклічних нуклеотидів. Циклічні нуклеотиди 3',5'-АМФ (цАМФ) та 3',5' ГМФ (цГМФ) - це внутрішні (3'5' дифосфорні ефіри аденілової (АМФ) та гуанілової (ГМФ) кислот. Найбільш поширеними є цАМФ-залежні системи контролю за внутрішньоклітинними біохімічними процесами, зокрема за такими, що підлягають нейрогуморальній регуляції з боку цілісного організму, яка реалізується гормонами та нейромедіаторами. Регуляція ферментативних процесів за участю цАМФ включає декілька послідовних
стадій передавання і трансформації хімічного (регуляторного) сигналу.
1. Утворення циклічних нуклеотидів у реакціях, що каталізуються ферментами циклазами: аденілатциклазою та гуанілатциклазою з нуклеозидтрифосфатів АТФ та ГТФ, відповідно:
 Розщеплення цАМФ та цГМФ до звичайних, нециклічних нуклеозидмонофосфатів каталізується фосфодіестеразою циклічних нуклеотидів. Фермент аденілатциклаза розміщений у плазматичних мембранах клітин і його активація відбувається в результаті взаємодії з рецепторами мембран певних фізіологічно активних сполук, зокрема гормонів адреналіну, глюкагону тощо.
2. Активація циклічним АМФ протеїнкіназ, функцією яких є фосфорилування інших ферментних білків. Ці цАМФ-залежні протеїнкінази є регуляторними ферментами, що активуються цАМФ за механізмом алостеричного контролю. Розщеплення цАМФ та цГМФ до звичайних, нециклічних нуклеозидмонофосфатів каталізується фосфодіестеразою циклічних нуклеотидів. Фермент аденілатциклаза розміщений у плазматичних мембранах клітин і його активація відбувається в результаті взаємодії з рецепторами мембран певних фізіологічно активних сполук, зокрема гормонів адреналіну, глюкагону тощо.
2. Активація циклічним АМФ протеїнкіназ, функцією яких є фосфорилування інших ферментних білків. Ці цАМФ-залежні протеїнкінази є регуляторними ферментами, що активуються цАМФ за механізмом алостеричного контролю.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 23. Ензимопатії – уроджені (спадкові) вади метаболізму вуглеводів, амінокислот, порфіринів, пуринів. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Первинні, або спадкові, ензимопатії виникають унаслідок змін у генетичному коді синтезу ферментів. Причинами ферментативних дефектів можуть бути: аномальна структура ДНК, порушення перенесення генетичного коду від ДНК до РНК, змінена структура РНК і порушення в передачі інформації від РНК до рибосом. Крім того, причиною метаболічних розладів можуть бути генетично зумовлені порушення співвідношення природних активаторів та інгібіторів ферментів. Причиною спадкових ензимопатій є мутації, що виявляються характерними змінами в активності відповідних ферментів. При цьому ферментативна активність відсутня або знижена, або (дуже рідко) підвищена. Можуть з’являтися патологічні ферменти, які в нормі не трапляються. 1. Галактоземії (дефіцит галактозо- 1-фосфатуридилтрансферази, або галактокінази). При цій патології відбувається накопичення в крові й тканинах галактозо-1-фосфату, вільної галактози та спирту дульциту продукту відновлення галактози. Високий їх уміст діє токсично, у немовлят після споживання молока спостерігають блювання й пронос, збільшується печінка, розвивається катаракта, затримується розумовий розвиток. 2. Фруктоземії (дефіцит фруктозодифосфатальдолази, або фруктокінази). Генетичний дефект альдолази фруктозо-1-фосфату зумовлює істотні порушення в обміні вуглеводів, гіпоглікемію, ураження печінки. 3. Глікогенози: I тип, гепаторенальний глікогеноз, хвороба Гірке (дефіцит глюкозо-6-фосфатази). II тип, генералізований глікогеноз, хвороба Помпе (дефіцит кислої 1,4-а-глюкозидази). Спостерігають збільшення розмірів серця (кардіомегалія) з гіпотонією та серцево-легеневою недостатністю. Смерть настає в дитячому віці. III тип, нирково-м’язовий глікогеноз, хвороба Корі (дефіцит аміло-1,6-глюкозидази). IVтип, печінково-циротичний ендотеліальний глікогеноз, хвороба Андерсена (дефіцит 1,4-а-глюкан-6-а-глюкозилтрансферази). У хворих спостерігають гепатомегалію та спленомегалію, печінкову недостатність. V тип, м’язовий глікогеноз, хвороба Мак-Ардля (дефіцит м’язової фосфорилази). 4. Непереносність дисахаридів Аглікогеноз (дефіцит глікогенсинтетази) характеризується гіпоглікемією з судомами, блюванням, порушенням розумового розвитку. 5.Мукополісахаридози, різні типи (дефіцит глюкуронозилдисульфоглюкозамінглюкуронідази, сульфатази, N-ацетилгексозамінідази, ідуронідази, N-ацетилглюкозаміні дази). 6. Гемолітичні анемії, зумовлені дефіцитом ферментів обміну вуглеводів в еритроцитах. 7. Муковісцидози (дефіцит ферментів обміну глікопротеїнів). Спадкові захворювання, що характеризуються ушкодженням залоз внутрішньої секреції, патологічними змінами органів дихання й травлення, наявністю в’язкого слизу у вивідних протоках екзокринних залоз (переважно підшлункової та бронхіальних). 1. Еритропоетичні порфірїі: а) природжена еритропоетична порфіріл, або хвороба Гюнтера (дефіцит уропорфіриноген ІІІ-косинтази). У результаті цього біохімічного дефекту відбувається утворення нефізіологічного ізомера уропорфіриногену — уропорфіриногену І. Для цієї патології характерне забарвлення сечі у червоний колір (зумовлене накопиченням нирками уропорфіриногену І, може бути забарвлення кісток і зубів; б) еритропоетична копропорфірія (дефіцит ферменту копропорфіриногеноксидази). Клінічні прояви такі самі, як і при еритропоетичній протопорфірії. Уміст протопорфірину в еритроцитах зростає у 30—80 разів порівняно з нормою; в) еритропоетична протопорфірія (дефіцит ферохелатази). Спостерігають підвищену чутливість до сонячного випромінювання (набряк, свербіж, почервоніння шкіри), у разі тривалого перебування на сонці — геморагічні висипи. В еритроцитах уміст протопорфірину IX зростає у 20—100 разів. Спадкові порушення біосинтезу порфіринів (порфіри) -дефекти метаболізму (ензимопатії), за яких порфірини та їх попередники в надмірних кількостях накопичуються в тканинах людського організму, зокрема в шкірі і підшкірній клітковині, та екскретуються з сечею і фекаліями. а) піролопорфірія, або гостра переміжна порфірія (дефіцит уропорфіриногенсинтази); підвищена активність 5-АЛК-синтетази. Вияляється в ранньому дитячому віці. Характеризується нападами гострого болю в животі з диспепсією, лейкоцитозом, поліневритами, галюцинаціями. З сечею виділяється значна кількість порфобіліногену, а також 5-АЛК. Сеча таких хворих має червоне забарвлення; б) спадкова копропорфірія (дефіцит копропорфіриногеноксидази); у сечі й кал: значно зростає кількість копропорфірину. Захворювання характеризується неврологічною симптоматикою, як і при гострій переміжній порфірії. Одночасно спостерігаються шкірні симптоми: набряк, везикули, склеродермія; в) природжена пізня шкірна порфірія (дефіцит копропорфіриногеноксидази). Захворювання характеризується вираженою шкірною симптоматикою, яка виявляється у віці після 40 років; г) змішана природжена порфірія (дефіцит ферохелатази й уропорфіриногендекарбоксилази). Ензимопатії при обміні білків 1.Фенілпіровиноградна олігофренія (дефіцит фенілаланін-4-монооксигенази. Відсутність у печінці фенілаланін-4-монооксигенази призводить до розвиту фенілкетонурії. 2. Алкаптонурія (дефіцит гомогентизинат-1,2-діоксигенази). Це спадкове захворювання розвивається внаслідок генетичного дефекту гомогентизинат-1,2-діоксигенази — ферменту катаболізму фенілаланіну. 3.Тирозиноз, тирозинеміяі типу (дефіцит фумарилацетоацетатгідролази), тирозинемія II типу (синдром Ріхнера—Ханхарта) і тирозинемія новонароджених (транзиторна тирозинемія). 4. Альбінізм (дефіцит тирозинази) — молекулярна хвороба. Спадкова відсутність тирозинази призводить до альбінізму. 5.Гіперамоніємія (дефіцит ферментів синтезу сечовини: карбамоїлфосфатсинтази, аргініносукцинатліази, орнітинкарбамоїлтрансферази, аргініносукцинатсинтетази, аргінази). 6. Гіпергістидинемія (дефіцит гістидинази). Це спадкове захворювання виникає внаслідок відсутності гістидинази, що каталізує окисне дезамінування гістидину. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 24. Ензимодіагностика патологічних процесів та захворювань. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Для ранньої діагностики низки захворювань використання ферментів виявилося інформативнішим порівняно з іншими біохімічними тестами. Так, зміну активності аланінамінотрансферази, аспартатамінотрансферази, альдолази при інфекційному гепатиті у більшості хворих виявляють значно раніше, ніж інші біохімічні показники (тимолова проба, вміст білірубіну, білкових фракцій тощо). Підвищення активності лужної фосфатази при рахіті, креатинфосфокінази, аспартатамінотрансферази — при інфаркті міокарда використовують для ранньоїдіагностики цих захворювань. При багатьох захворюваннях зміна активності ферментів може бути настільки специфічною, що є одним із вирішальних критеріїв під час установлення діагнозу. Переконливим прикладом може бути використання сорбітолдегідрогенази для діагностики печінкових і обтураційних жовтяниць, креатинфосфокінази та аспартатамінотрансферази — для диференціації інфаркту міокарда й стенокардії. Нерідко активність ферментів змінюється ще до прояву клінічних ознак загострення. Наприклад, підвищення активності аланінамінотрансферази передує збільшенню вмісту білірубіну, погіршенню самопочуття хворого. Це допомагає своєчасно розпізнати ускладнення і змінити терапевтичну тактику. Ферменти успішно використовують у клінічній практиці для оцінювання ефективності лікування, прогнозу захворювання. Відсутність зміни активності ферментів на тлі використання лікарських та інших методів лікування свідчить про низьку їх ефективність. Так, визначення активності амінотрансфераз у сироватці крові достовірніше відображує ступінь репаративних процесів у печінці при гепатиті порівняно із вмістом білірубіну. Багато ферментів використовують у клініці для прогнозування перебігу захворювання. Наприклад, стійке зниження активності холінестерази при хронічному гепатиті свідчить про прогресування процесу й ускладнення захворювання. Різке зниження активності амінотрансфераз на тлі зростання вмісту білірубіну (ферментно-білірубінова дисоціація) свідчить про виснаження тканинних джерел ферментів за рахунок тяжкого ушкодження паренхіми печінки, що визначає відповідний прогноз. Перспективним для ферментодіагностики є дослідження ізоферментів. Доведено, що в разі ушкодження тканин ізоферменти надходять у кров та інші біологічні рідини і їхній ізоферментний спектр стає близьким до тканинного, що покладено в основу використання ізоферментів у діагностиці. Знаючи топографію ізоферментів у клітині, особливості їх тканинних і сироваткових спектрів, можна встановити локалізацію патологічного процесу. Дослідження ізоферментів має переваги перед визначенням загальної активності ферментів, оскільки їм властиві одночасно висока чутливість і специфічність. Ізоферментні спектри широко використовують для діагностики різних видів патології, насамперед у гепатології, кардіології, при захворюваннях нирок, підшлункової залози, легенів, скелетних м’язів, в онкології, гематології тощо. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 25. Ензимотерапія – застосування ферментів, їх активаторів та інгібіторів в медицині. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ензимотерапія — використання ферментів як лікарських засобів проводиться переважно в разі нестачі в організмі якогось ферменту, коферменту або як допоміжний засіб при деяких захворюваннях. Засоби замісної терапії використовують досить давно. Передусім це ферменти шлункового соку (пепсин, абомін) та підшлункової залози (панкреатин), а також багатокомпонентні препарати, що містять у своєму складі ферменти, які чинять комплексний вплив на білки, жири, вуглеводи (фестал, панзинорм, дигестал, онотон, ктазим, комбіцин). їх застосовують для поліпшення функціональ
Дата добавления: 2015-05-07; Просмотров: 2084; Нарушение авторских прав?; Мы поможем в написании вашей работы! |
Генерация страницы за: 0.017 сек.