
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрическое титрование
|
|
|
|
Визуальное титрование
МЕТОДЫ ОПРЕДЕЛЕНИЯ КИСЛОТНОСТИ
Все растительное сырье, используемое в спиртовом и ликероводочном производствах, содержит различные свободные и связанные с органическими соединениями кислоты. В присутствии воды, а также под действием ферментов кислые соли выделяются из органических соединений и переходят в водные растворы вместе со свободными кислотами. Существуют нормативные показатели кислотности сырья и полуфабрикатов, которые могут повышаться, например, при неправильном их хранении. Поэтому показатель кислотности необходимо определять, так как он дает представление о качестве продуктов.
Различают титруемую и активную кислотность.
Под титруемой кислотностью продукта понимают содержание всех кислых компонентов продукта, которые оттитровываются раствором щелочи в присутствии индикаторов.
В основу метода определения титруемой кислотности положено прямое кислотно-основное титрование, базирующееся на реакции
Титруемую кислотность выражают в градусах. За градусы титруемой кислотности принимают количество кубических сантиметров раствора гидроксида натрия (или калия) концентрации 1 моль/дм3, необходимое для нейтрализации кислот, содержащихся в 100 г продукта.
Титрование проводят до точки эквивалентности. Для правильного установления точки эквивалентности при визуальном титровании важен выбор индикатора, который должен иметь хорошую четкую окраску, изменяющуюся в небольшом интервале рН. Изменение окраски должно быть обратимым. Поэтому следует строго придерживаться условий применения того или иного индикатора.
Определение титруемой кислотности проводят визуальным или потенциометрическим методом.
Анализ состоит из двух этапов. Первый этап — экстрагирование кислот из анализируемой пробы продукта с помощью воды с последующей фильтрацией смеси. Фильтрат используют для титрования.
В жидких продуктах титрование проводят непосредственно в самом продукте.
Второй этап — титрование.
Титрование может быть визуальным и потенциометрическим.
При визуальном титровании в титруемый раствор добавляют 2— 3 капли индикатора фенолфталеина и титруют раствором гидроксида натрия (калия) при непрерывном перемешивании до получения розовой окраски, не исчезающей в течение 30 с. Отмечают объем израсходованного на титрование раствора гидроксида натрия (или калия).
При потенциометрическом титровании определяют объем титранта (стандартного раствора), содержащего количество стандартного вещества, эквивалентное количеству определяемого вещества в титруемом (анализируемом) растворе, т. е. точку эквивалентности. Зная эквивалентный объем стандартного раствора, рассчитывают концентрацию или количество определяемого вещества.
Для проведения анализа стакан с анализируемым раствором устанавливают в потенциометр, в раствор опускают электроды (индикаторный и электрод сравнения) и измеряют величину рН.
Отметив величину рН, начинают приливать из бюретки раствор гидроксида калия (или натрия) концентрации 0,1 моль/дм3. При титровании по мере приближения рН к 7,0 раствор гидроксида натрия (или калия) приливают по каплям при тщательном перемешивании титруемого раствора стеклянной палочкой. Титрование заканчивают, когда рН жидкости в стакане достигает значений 7,0— 7,2. После этого отмечают объем гидроксида натрия (или калия), израсходованный на титрование.
Титруемая кислотность (град):
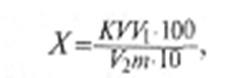 (6)
(6)
где К— поправочный коэффициент раствора гидроксида натрия (калия); V— объем раствора гидроксида натрия, израсходованный на титрование, см3; V— объем мерной колбы, в которой растворена навеска, см5; 100 —коэффициент пересчета на 100 г продукта; V2 — объем фильтрата, взятый на титрование, см3; т — масса навески продукта, г;!0 — коэффициент пересчета раствора гидроксида натрия (калия) концентрации 0,1 моль/дм3 в 1 моль/дм3.
Результаты параллельных определений вычисляют до второго десятичного знака и округляют до первого десятичного знака.
Предел допускаемых значений погрешности измерения — 0,3 град при доверительной вероятности Р= 0,95.
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 873; Нарушение авторских прав?; Мы поможем в написании вашей работы!