
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплоемкость. Зависимость теплоемкости от температуры. Расчет количества теплоты, необходимой для нагревания веществ
|
|
|
|
Первый закон термодинамики
Первый закон термодинамики – это закон сохранения энергии, устанавливающий связь между количеством теплоты, полученной или отданной в процессе, изменением внутренней энергии системы и работой. Для конечного изменения состояния системы первый закон термодинамики выражается уравнением:
Q = ΔU + A (интегральная форма), (1.1)
где Q – количество теплоты; ΔU – изменение внутренней энергии; A – работа.
В дифференциальной форме первый закон термодинамики записывается следующим образом:
δQ = dU + δA. (1.2)
Если δА – работа при расширении, то
δQ = dU + PdV. (1.3)
Для изохорных процессов (V = const)
δQV = dU; (1.4)
для изобарных процессов (P = const)
δQP = dH; (1.5)
где H – энтальпия (H = U + PV).
На основе первого начала термодинамики возможно определение тепловых эффектов химических и физико-химических процессов.
Теплоемкость системы (C) определяется отношением количества сообщенной ей теплоты к произошедшему при этом изменению температуры. Различают истинную и среднюю теплоемкость. Истинная теплоемкость:
 (1.6)
(1.6)
средняя теплоемкость численно равна количеству теплоты, которое надо сообщить системе, чтобы нагреть ее на 1 К:

 (1.7)
(1.7)
Если теплоемкость относится к единице массы вещества, то она называется удельной и измеряется в Дж/(кг·К) или в Дж/(г·К), а к 1 моль – мольной теплоемкостью с размерностью Дж/(моль·К). Таким образом, удельная теплоемкость – это количество теплоты, необходимой для нагревания 1 кг или 1 г вещества на 1 градус, а мольная теплоемкость – это количество теплоты, необходимой для нагревания 1 моля вещества на 1 градус (1 оС = 1 К).
Для условий перехода теплоты при V = const и P = const различают, соответственно, изохорную (CV) и изобарную (CР) теплоемкости, которые на основе первого закона термодинамики с учетом соотношений (1.4) и (1.5) могут быть выражены как частные производные от внутренней энергии и энтальпии по температуре при постоянстве соответствующих параметров:
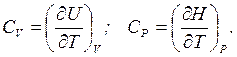 (1.8)
(1.8)
На основании уравнений (1.8) количество теплоты, необходимой для нагревания 1 моля вещества в изобарных условиях (ΔH) от температуры T1 до температуры T2 , можно рассчитать после интегрирования:
 , (1.9)
, (1.9)
где СP – изобарная мольная теплоемкость.
Для n молей нагреваемого вещества:
 . (1.10)
. (1.10)
Мольные и удельные теплоемкости веществ зависят от их природы, фазового состояния и от температуры. Их значения приводятся в справочной литературе. Для узкого интервала температур, близких к стандартной температуре Т = 298 К, в расчетах может быть использована стандартная мольная теплоемкость  (табл. 7.2).Учет зависимости теплоемкости от температуры может быть произведен в приближенных расчетах с применением средних значений теплоемкости в рассматриваемом интервале температур (табл. 7.1).
(табл. 7.2).Учет зависимости теплоемкости от температуры может быть произведен в приближенных расчетах с применением средних значений теплоемкости в рассматриваемом интервале температур (табл. 7.1).
При подстановке в выражение (1.10) постоянных значений теплоемкости после интегрирования получим изменение энтальпии при нагревании n молей вещества от Т1 до Т2:
 . (1.11)
. (1.11)
Более точные расчеты проводятся с учетом экспериментально установленных зависимостей теплоемкостей от температуры в виде степенных рядов. Для неорганических веществ зависимости СP = f(T) имеют вид:
CP = a + bT + c΄/ T2;(1.12)
для органических веществ:
CP = a + bT + cT2, (1.13)
где a, b, c, c΄ – эмпирически найденные коэффициенты, приводимые в справочной литературе (табл. 7.2).
При установлении зависимости теплоемкости от температуры по справочным таблицам необходимо обратить внимание на порядок величин коэффициентов, вынесенный в заголовок справочных таблиц, и на единицы измерения теплоемкости. Например, в табл. 1.1 для газообразного монооксида углерода b ·103 = 4,1; следовательно, b = 4,1·10–3.
Уравнения СP = f(T) далее подставляют в формулу (1.10), производят определенное интегрирование и рассчитывают изменение энтальпии. Ниже для напоминания приводятся формулы, применяемые в данном случае при определенном интегрировании:

П р и м е р 1.1. Рассчитать количество теплоты, которое необходимо для нагревания 50 кг газообразного монооксида углерода СО от температуры 298 К (Т1) до температуры 600 К (Т2) при P = const (изменение энтальпии при нагревании), используя значения стандартной теплоемкости; средней теплоемкости данного вещества в указанном интервале температур; а также с учетом зависимости его теплоемкости от температуры. Необходимые справочные данные приведены в табл. 1.1.
Таблица 1.1
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 4013; Нарушение авторских прав?; Мы поможем в написании вашей работы!