
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет стандартных тепловых эффектов химических реакций по стандартным теплотам образования веществ, участвующих в реакции
|
|
|
|
Термохимия
Мольные теплоемкости газообразного монооксида углерода
 , Дж/(моль·К) , Дж/(моль·К)
|  ,
Дж/(моль·К)
(298-600 К) ,
Дж/(моль·К)
(298-600 К)
| Коэффициенты уравнения CP = a + bT + c΄/T2, Дж/(моль·К) | ||
| a | b·103 | c΄·10-5 | ||
| 29,14 | 29,99 | 28,41 | 4,10 | – 0,46 |
Р е ш е н и е
Находим количество молей нагреваемого монооксида углерода (СО):
n = g /M,
где g – масса диоксида углерода, в г; M = 28 г/моль – молярная масса СО;
n = 50·103/28 = 1785,71 моль.
Количество теплоты, которое необходимо для нагревания 50 кг газообразного монооксида углерода СО от температуры 298 К до температуры 600 К при P = const (изменение энтальпии), если для расчета используется стандартная теплоемкость или средняя теплоемкость данного вещества в интервале температур 298 – 600 К, рассчитываем по уравнению (1.11), соответственно:
ΔH = 1785,71·29,14· (600 – 298) = 15714747 Дж = 1,571· 104 кДж;
ΔH = 1785,71·29,99· (600 – 298) = 16173139 Дж = 1,617· 104 кДж.
Точный расчет производим с учетом экспериментально установленной зависимости теплоемкости от температуры. На основе справочных данных (табл. 1.1) устанавливаем вид уравнения CP = f(T):
CP = 28,41 + 4,10· 10–3 Т – 0,46· 105/ T 2,
которое затем подставляем в уравнение (1.10):
 =1785,71· [28,41· (600 – 298) + (4,1·10-3/2) · (6002 – 2982) +
=1785,71· [28,41· (600 – 298) + (4,1·10-3/2) · (6002 – 2982) +
+ 0,46·105· (1/600 – 1/298)] = 16175104 Дж = 1,618·104 кДж.
Химические реакции сопровождаются выделением или поглощением теплоты. Термохимия – это раздел физической химии, в котором изучаются тепловые эффекты химических и физико-химических процессов.
Тепловым эффектом химической реакции называется количество теплоты, которое выделяется или поглощается при необратимом протекании реакции, если осуществляется только работа расширения или сжатия, а исходные и конечные вещества имеют одинаковую температуру.
В соответствии с первым законом термодинамики тепловой эффект химической реакции, проходящей в изохорных условиях (QV), равен изменению внутренней энергии, а тепловой эффект химической реакции, проходящей в изобарных условиях (QP), равен изменению энтальпии:
QV = ΔU; QP = ΔH. (1.14)
Если реакция протекает в растворе или в твердой фазе, где изменение объема невелико, то
ΔH = ΔU + Δ(PV) ~ ΔU. (1.15)
Если в реакции участвуют идеальные газы, то при Т = const:
ΔH = ΔU + Δν · RT, (1.16)
где Δν – изменение числа молей газообразных веществ за счет прохождения химической реакции; R = 8,314 Дж/(моль·К) – универсальная газовая постоянная.
Химические реакции, проходящие с выделением теплоты, называются экзотермическими. Для этих реакций ΔH < 0 и ΔU < 0. Если химическая реакция протекает с поглощением теплоты, то она называется эндотермической (ΔH > 0, ΔU > 0).
Большинство химических процессов протекает при нормальном атмосферном давлении при условии P = const, поэтому рассмотрим подробно расчет изменений энтальпии при прохождении химических реакций.
1.4.1. Закон Гесса. Расчет тепловых эффектов химических реакций при стандартных условиях
Тепловые эффекты химических реакций можно определять экспериментально или рассчитывать теоретически на основе закона Гесса, который формулируется следующим образом: при постоянном давлении или объеме тепловой эффект химической реакции зависит от природы и состояния исходных веществ и продуктов реакции и не зависит от пути процесса. Другой формулировкой закона Гесса является следующее утверждение: тепловой эффект непосредственного превращения исходных реагентов в продукты реакции равен сумме тепловых эффектов промежуточных стадий.
Для сопоставления тепловых эффектов различных реакций используется представление о стандартном состоянии – это состояние чистого вещества при давлении 1 атм (1,013·105 Па) и температуре 25 оС (298,15 К). Символы термодинамических функций в стандартном состоянии обозначаются с верхним индексом «О» и указанием стандартной температуры. Например, стандартное изменение энтальпии (стандартный тепловой эффект при P = const) записывается следующим образом: ΔHO298.
Теоретически тепловые эффекты химических реакций рассчитывают, если известны тепловые эффекты других химических реакций, в которых участвуют данные вещества, с использованием следствий из закона Гесса.
Стандартной теплотой образования (энтальпией образования) вещества называется энтальпия реакции образования 1 моля этого вещества из элементов (простых веществ, то есть состоящих из атомов одного вида), находящихся в наиболее устойчивом стандартном состоянии. Стандартные энтальпии образования индивидуальных веществ  (кДж/моль) приводятся в справочниках. При использовании справочных значений необходимо обращать внимание на фазовое состояние веществ, участвующих в реакции. Энтальпия образования наиболее устойчивых простых веществ равна 0.
(кДж/моль) приводятся в справочниках. При использовании справочных значений необходимо обращать внимание на фазовое состояние веществ, участвующих в реакции. Энтальпия образования наиболее устойчивых простых веществ равна 0.
Следствие из закона Гесса о расчете тепловых эффектов химических реакций по теплотам образования: стандартный тепловой эффект химической реакции равен разности теплот образования продуктов реакции и теплот образования исходных веществ с учетом стехиометрических коэффициентов (количества молей) реагентов:
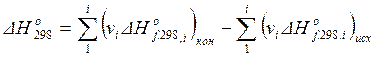 . (1.17)
. (1.17)
П р и м е р 1.2. Рассчитать стандартный тепловой эффект и изменение внутренней энергии при прохождении следующей реакции при P = const:
CH4 + 2 CO = 3 C(графит) + 2 H2O.
газ газ тв. газ
Теплоты образования веществ в указанных фазовых состояниях приведены в табл. 1.2.
Таблица 1.2
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 3672; Нарушение авторских прав?; Мы поможем в написании вашей работы!