
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В. Пневматична хімія
|
|
|
|
Ятрохімія принесла значну користь хімії, оскільки сприяла звільненню її від нашарування хибних, схоластичних поглядів алхімії, а також значно розширила набір відомих речовин та інформацію про їх властивості.
Але ятрохімія з часом виявилася і гальмом у розвитку хімії, оскільки звужувала поле її діяльності. Адже фармація − це ще не вся хімія. На щастя в цей же період інтенсивно розвивалась і технічна хімія, яка не була пов'язана з догмами ятрохімії. Проте вона (технічна хімія) не мала жодної теоретичної бази, оскільки всі її рецепти були створені на базі методу "проб і помилок". У цей час з'являються перші дослідники (XVII -XVIII ст.), які своїми відкриттями допомогли створенню перших наукових теорій в хімії.
Одним з найважливіших започаткованих ними напрямків стало дослідження газів. Ці роботи лягли в основу т. зв. пневматичної хімії. По ходу при цьому відкриті фізичні закони залежності об'єму газів від тиску (Бойль, 1660 і Маріотт, 1677), пізніше Гей-Люссак (1802) установив і вплив температури.
Власне, ініціатором пневматичної хімії був Ван Гельмонт, який не тільки ввів саме поняття "газ", але й почав систематичне дослідження т. зв. "лісного газу" (gas silvestre). Річ у тому, що до нього всі газоподібні речовини вважалися різновидами повітря. Ван Гельмонт установив, що "лісний газ", тобто СО2 утворюється, коли діяти кислотою на вапняк, або при спалюванні вугілля. Його послідовник Блек назвав цей газ "газ, що зв'язується", бо він поглинався розчином лугу (на відміну від повітря).
Проте найвизначнішим представником напрямку пневматичної хімії, безсумнівно, належить вважати Роберта Бойля (1627-1691).
Він був 7-им з 14 дітей графа Корка, вчився в Ітоні і багато подорожував по Європі. З 27-річного віку присвятив себе науковим дослідженням. Він виділявся рідкісною скромністю і добротою. Будучи глибоко релігійним, уникав усяких суперечок і навіть не вдавався в наукову полеміку.
Бойль розглядав хімію не як утилітарну науку (для отримання ліків чи металів), а так, як її повинен розглядати філософ. Він вважав, що тільки експериментальний метод і пов'язані з ним спостереження повинні складати єдину основу для наукових висновків. Наукову спадщину Бойля можна розділити на:
1. Фізичні дослідження − результатом стали його газові закони.
2. Хімічні дослідження − вивчав процеси горіння, обпалювання металів, дихання − установив, що в них бере участь певна частина повітря. Він наблизився до відкриття кисню, у всякому разі відкинув алхімічні домисли щодо горіння, бо встановив, що при обпалюванні металів їх вага зростає. Також учений помітив, що хлорид срібла при стоянні чорніє − це він пояснити не зміг, але припускав, що відбувається взаємодія з повітрям. Вивчаючи відкритий у 1669 p. алхіміком Брандтом Фосфор (шляхом перегонки залишку сечі), Бойль прийшов до відкриття фосфатної кислоти і фосфіну. Він уперше вжив слово "аналіз" і ввів індикатори (рослинного походження) для визначення кислотності чи лужності розчинів.
3. Корпускулярна теорія. Бойль переглянув застарілі поняття про "елементи" Аристотеля, твердив, що елементи − це не розкладувані далі складові частини тіл, і існують вони в більшому числі, ніж раніше думали. Його корпускулярна теорія є, по суті, атомістичною. Бойль прийшов до висновку, що "корпускули", з яких складаються тіла, залишаються незмінними при хімічних перетвореннях. Так, ми бачимо, твердив він, що якщо розчинити золото в царській воді, а мідь чи срібло - в нітратній кислоті, то ці метали щезають, але їх корпускули, розчинені в кислотах, не змінюються, бо відповідними операціями з цих розчинів знову можна виділити вказані метали.
Хоча ці погляди справді були новими, але їх виявилося недостатньо для побудови наукової теорії, бо бракувало поняття "атомної ваги" (яке ввів аж через більше ніж 100 років Дальтон). Бойль запозичив у стародавніх учених поняття про "універсальну матерію", з якої складаються всі тіла і корпускули. Цій "матерії" відповідають три основні якості: форма, величина і рух.
За допомогою своєї корпускулярної теорії Бойль пояснював різні агрегатні стани матерії. Так, газоподібний стан зумовлений наявністю часток різної форми, тому гази пружні. Корпускули рідини торкаються частково одна одної, а в твердому стані вони сильно зв'язані і не можуть рухатись.
З-посеред найважливіших творів Бойля належить назвати "Хімік-скептик", ''Досліди і міркування про кольори". Вони мали великий успіх не тільки у сучасників, але й у дослідників наступних поколінь.
4 С. Флогістика
Наприкінці XVII - початку XVIII ст. накопичилось достатньо експериментальних даних для створення всеохоплюючої хімічної теорії, в першу чергу, щодо обпалювання металів, дихання, горіння. На жаль, при її створенні не були враховані прогресивні уявлення Бойля про елементи, сполуки і суміші.
У цих умовах виникла і розповсюдилася теорія флогістону від (грецького флогістос - здатний запалюватись). Цей термін давно вживався лікарями для позначення запального стану органів дихання.
Засновником теорії флогістону (ТФ) є Ґеорг Ернст Шталь (1659-1734). Він був професором медицини в Ієні, потім у Галле, а з 1716 р. особистий лікар короля Пруссії.
Суть його теорії полягала в тому, що існує особлива речовина − флогістон − яка є складовою частиною всіх горючих тіл, яка виділяється з них при горінні або обпалюванні. За Шталем, хіміки XVIII ст. вважали своїм головним завданням виділити гіпотетичний флогістон. Виходило так, що при нагріванні металів з них виділяється флогістон і залишається оксид, який являє собою метал, позбавлений флогістону. Якщо ж тепер до цього оксиду додати речовини, багатої флогістоном, наприклад, вугілля, то оксид наповнюється флогістоном і знову утворюється метал. Отже, схема була такою:
обпалювання
Метал ———————→ оксид + флогістон
Флогістиків не засмучувало те, що вже було відомо про обпалювання металів: при цьому маса металу зростає. Вони пояснювали це тим, що флогістон має негативну вагу, так що чим його в металі (оксиді) менше, тим більша маса залишку. Ми бачимо, наскільки нехтування експериментом було ще живучим у хіміків того часу.
Попри свою хибність (для нас), теорія флогістону дозволяла пояснити зовнішні прояви процесів горіння, була дохідливою для навчання в університетах.
Зауважимо, що в цілому ТФ була результативною і цей період у значній мірі сприяв прогресу в хімії. У великій мірі це було заслугою флогістиків - послідовників Шталя.
Джозеф Блек спочатку був послідовником Шталя, але потім перейшов на позиції Лавуазьє, з чого останній дуже тішився. З фактичного доробку Блека вкажемо на його детальні дослідження карбонатів і "зв'язаного повітря" (СО2). Спочатку Блек установив різницю між карбонатом і оксидом магнію. Обидві речовини давали з кислотою магній сульфат, але тільки перша виділяла при цьому СО2. Цей газ він назвав "зв'язуючим повітрям", а Лавуазьє згодом − "крейдяна кислота" (1775). Блек установив також, що СО2 є складовою частиною звичайного повітря.
Генрі Кавендіш (1731-1810) займався фізикою і хімією. Внесок у хімію газів дає підставу вважати його батьком пневматичної хімії: він визначив природу водню як особливого газу; твердив,що повітря − це суміш кисню й азоту; вода утворена з кисню і водню; електрична іскра у вологому повітрі приводить до утворення нітратної кислоти.
Джозеф Прістлі (1733-1801) - теолог, філософ і хімік. Будучи незалежною людиною, він був у складних відносинах з англійською церквою. Врешті змушений був емігрувати у Францію, потім у США. Хоча хімією займався лише в 1772-77 pp., досяг значних результатів. Досліджував повітря та різні його складові частини ("зв'язане повітря" = СО2; дефлогістоване повітря = О2) азот (повітря, в якому згоріла свічка). Отримав "селітряне повітря":
HNО3 + Cu = Cu(NО3)2 + H2О + NO
При стоянні NО з Fe утворювався новий газ:
NO + Fe + Н2 О = N2О + Fe (OH)3
Але найзнаменитіше його відкриття − виділення чистого кисню (1774):
HgO = Hg + О2 або Рb3 О4 = РbО + О2
Він назвав кисень "дефлогістоване повітря", бо був прихильником теорії флогістону. Про свої відкриття він повідомив Лавуазьє, а той зробив з цього правильні висновки.
Карл Вільгельм Шееле (1742-1786) відкрив кисень ще в 1771 p., але опублікував ці праці лише у 1777 p. Він назвав кисень "вогняним повітрям", а вже потім Лавуазьє "оксигеном", тобто "породжуючим кислоти".
Проте ні Прістлі, ні Шееле не змогли оцінити свого відкриття, яке по суті було ударом по теорії флогістону.
Шееле розробив кілька нових методів добування кисню:
МеСОз = Me + СО2 + О2
Mg(NО3)2 = MgO + NО2 + О2
МnO2 + H2SO4 = MnSO4 + Н2O + O2
Крім того, він вивчав процеси дихання і горіння. Також відкрив хлор, помітив, що залізо, мідь, ртуть проявляють різні ступені окислення. Ці його досліди суттєво вплинули на розвиток вчення про валентність.
4 D.Лавуазьє і хімія XVIII ст.
Фігура Лавуазьє однозначно виділяється на тлі хімічної науки 2-ї половини XVIII ст. В історії хімії Саме з його іменем, його дослідами, його ідеями пов'язують розрив зі теорією флогістону, перехід всього хімічного світогляду на наукові рейки.
Перед тим, як розглянути складний життєвий шлях Лавуазьє і його внесок в розвиток хімії, потрібно зробити деякі зауваження щодо оцінки його діяльності, особливо в світлі і перебільшень, і приниження його ролі.
Переважно французькі дослідники, зокрема Вюрц, твердили, що Лавуазьє "створив хімію". Інші, переважно німецькі, намагалися довести протилежне − що наука могла би нібито взагалі обійтися без Лавуазьє. Більше того, лунали звинувачення, нібито він привласнив собі чужі результати. Останнє могло мати певні підстави, бо сам Лавуазьє писав про те, що він не знав результатів Рея про збільшення маси металів під час їх обпалювання. Потрібно чітко усвідомлювати, що в 17-18 ст. обмін науковою інформацією був дуже слабкий. У зв'язку з цим результати Ломоносова, який спостерігав збільшення маси металів при їх прожарюванні за рахунок приєднання частини повітря, хоча й були отримані за 40 років до Лавуазьє, теж не можуть поставити під сумнів заслуги Лавуазьє, оскільки праці Ломоносова до кінця XIX ст. не були відомі на Заході, тому вплив на розвиток хімічної думки жодним чином не виявили.
Антуан Лоран Лавуазьє народився 1743 року в Парижі, в багатій сім'ї. Отримав гуманітарну освіту, але незабаром виявив велику схильність до природничих наук і математики. Згодом він повністю віддався хімічним дослідам у домашній лабораторії. Нещастям Лавуазьє стало те, що він був "відкупщиком податків" короля Франції. Таких людей народ не любив і після революції 1789 р. він був заарештований і засуджений до страти. Загинув на гільйотині 8.05.1794 р. Він міг цього уникнути, покинувши Францію, як інші відкупщики. Мабуть, Лавуазьє вірив, що Франція не знесе голови такому вченому, як він. Даремна ілюзія. Революційний трибунал на це не звернув уваги, а його колеги Фуркруа, Морво, Бертолле навіть не стали на його захист. Лавуазьє прийняв смерть мужньо, показавши, що він був не тільки великим ученим, але й видатною людиною. Очевидно, що така людина не могла привласнити собі наукові здобутки інших. Не можна без глибокого жалю думати про те, як передчасна смерть позбавила хімію людини, яка так багато зробила для її розвитку.
Наукова діяльність Лавуазьє ділиться на 2 частини:
1) Правильне висвітлення процесів спалювання та дихання, або боротьба проти теорії флогістону.
2) Реформа хімії з визначенням хімічного елемента й експериментальне доведення закону збереження речовини.
Розглянемо ці напрямки діяльності Лавуазьє.
1. Боротьба проти теорії флогістону. Ще 1694 року встановлено, що при сильному нагріванні алмаз поступово щезає без залишку. Лавуазьє показав, що це є процес горіння, при чому утворюється "повітря, яке зв'язується" (СО2).
Також він установив, що при горінні S, Р має місце приріст ваги. Це ж спостерігається і при обпалюванні Sn, Pb. Далі він виявив, що дихання - це теж своєрідний процес горіння, пов'язаний з виділенням СО2. Цим усім він привів у велике замішання прихильників ТФ. У цей же час (1771-1776) Прістлі і Шееле відкрили кисень, його отримав і Лавуазьє (1776):
HgSО4 = Hg2 SО4 + Hg + SО2 + О2
Кисень він назвав: "повітря, придатне до дихання", "життєвий газ", зрештою "оксиген". Далі він довів, що саме цей газ зумовлює горіння і дихання. Це був смертельний удар по теорії флогістону.
1783 року Лавуазьє показав, що кисень при сполученні з сіркою дає Н2SO4, з N2 - HNO3, з P - НРO3, з С –СО2, з Н2 - Н2О. Він встановив якісний і кількісний склад води і тим показав, що вода не є "елемент", бо може бути розкладена і знову синтезована. Хоча деякі вчені до Лавуазьє проводили подібні досліди, вони не змогли узагальнити отримані результати − це зробив лише Лавуазьє, завдавши нищівного удару теорії флогістону.
Цікаво до цього додати, що Лавуазьє розглядав теплоту як "флюїд" і навіть у 1789 р. у своєму "Елементарному курсі хімії" помістив "теплород" у список хімічних елементів. Ці його дослідження, хоча й були об'єктивно хибними, поклали основу науковому трактуванню термохімії. Разом з Лапласом Лавуазьє дійшов висновку, що "кількість тепла, яка потрібна для розкладу сполуки на складові, точно дорівнює кількості тепла, яка виділяється при утворенні сполуки зі складових частин". По суті, це була предтеча закону Геса.
2. Лавуазьє і атомістика ХУІІІ ст. Власне, спеціально атомістикою Лавуазьє не займався; але в ході своїх дослідів націлених проти теорії флогістону, він змушений був визначитися і з цим питанням. Лавуазьє дійшов висновку, що немає сенсу спекулювати, скільки елементів (простих речовин) є в природі. На все відповідь повинен дати експеримент. Він писав: "... Я скажу лише, що якщо назвою "елемент" позначити прості і неподільні молекули, що складають тіла, то, ймовірно, ми всіх не знаємо..."
У своєму "Курсі" він наводить таблицю простих тіл, поділивши їх на 4 великих класи:
1. Які належать до трьох царств природи, тобто прості речовини, які можна розглядати як елементи: світло, теплород, кисень, азот, водень.
2. Прості неметалічні речовини, які здатні оксидуватись і давати кислоти: S, Р, С, мурієвий радикал (Сl), плавиковий радикал (F), борний радикал (В).
3. Прості металічні речовини, які здатні оксидуватись і давати кислоти (Sb, As, Ag, Ві, Co, Cu, Sn, Fe, Mn, Hg, Mo, Ni, Au, Pt, Pb, W, Zn).
4. Прості землисті речовини, здатні давати солі вапно, магнезія, барит, глинозем, кремнезем).
Як бачимо, в групі 4 є складні речовини. Лавуазьє відчував, що це сполуки, бо вони не реагують з киснем, тому припускав, що це наслідок того, що "вони вже насичені киснем"...
З проблемою елементів тісно пов'язане і формулювання закону збереження речовин (1789), хоча перші його спостереження відносяться до 1783 р. У 1787 р. разом із Морво, Бертолле і Фуркруа він складає "Метод хімічної номенклатури", де вперше дано позначення хімічних елементів, частково знаками, частково буквами, причому враховувалися три агрегатні стани. Наприклад:
| Елемент | Твердий | Рідкий | Газоподібний |
| Азот | 
| 
| 
|
| Водень | 
| 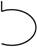
| 
|
| Срібло | 
| 
| 
|
| Мідь | 
| 
| 
|
| Алкоголь | 
| 
| 
|
| Муріятний радикал | 
| 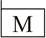
| 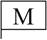
|
Отже, праці Лавуазьє були переломними в розвитку хімії. Він показав хибність теорії флогістону, заклав основи кількісних законів хімії, вніс ясність у питання горіння та дихання, ввів систематику елементів.
3. Нова школа та хімічна номенклатура. Праці Лавуазьє, чіткість і логіка його експериментів та ідей зробили прихильниками його поглядів усіх видатних хіміків того часу. З-посеред них у розвитку його ідей відзначимо Луї Бернара Гітон де Морво (1737-1816), який відомий головним чином як один з творців "Методу хімічної номенклатури". Проте його ставлення до Лавуазьє після арешту того не може не викликати осуду з боку тих, хто вважає великодушність однією з основних якостей людини і осуджує невдячність.
Клод Луї Бертолле (1748-1822) зблизився з Лавуазьє з 1786 р. Був науковим радником Наполеона, займався питаннями фарбування, вперше застосував хлор для відбілювання паперу і тканин, відкрив гіпохлорити лужних металів і калій хлорат (бертолетова сіль). Вважав, що елементи можуть сполучатися між собою в різних співвідношеннях залежно від маси реагуючих речовин, проти чого виступав Пруст.
Антуан Франсуа Фуркруа (1755-1809). Соратник Лавуазьє, який також залишив його в біді підчас Революції. Зробив внесок у хімію фізіологічних і патологічних процесів. Співавтор "Номенклатури", написав ще й "Хімічну філософію" (1792) та "Систему хімічних знань" у 11-ти томах (1801-2).
Луї Ніколя Воклен (1763-1829) провів серйозні і точні дослідження в неорганічній та органічній хімії. Відкрив хром, оксид берилію.
Мартін Генріх Клапрот (1743-1817). Працював з великою точністю за методом Лавуазьє, Воклена. Відкрив 4 елементи: U і Zn (1789), Ti (1795), Се (1803). Зробив великий внесок у розвиток аналітичних методів.
4 Е. Експериментальна хімія в XVIII ст.
18-те століття, безсумнівно, багате відкриттями, які значно сприяли становленню хімії як науки. Почала розвиватися промисловість, на місці малих феодальних князівств поставали великі об'єднані держави. Це все сприяло розвиткові технічної хімії. Поступово, вслід за фізиками, хіміки відкидали нічим не підтверджені теорії та гіпотези, серед яких було багато фантастичних, і все більше схилялися до думки, що в основі всякої науки лежить експериментальний доказ гіпотез і теорій. У першу чергу це вплинуло на розвиток аналітичної хімії, бо треба ж було знати склад руд, з яких витоплювали метали, оцінювати якість сировини для фарб, скла, кераміки тощо. Більшість учених схиляється до думки, що засновником аналітичної хімії є Р. Бойль, а її кількісний бік інтенсивно почав розвивати німецький хімік Берґман. Він, зокрема, до аналізів за допомогою паяльної трубки (Кронштедт) долучив аналіз мінералів мокрим шляхом (дією кислот). Він же розробив методи визначення кислот і основ тощо.
Усе це привело до успіхів у відкритті нових елементів: Co (1742, Брандт), Ni (1750, Кронштедт), Pt, Те, U, Zr, Cr, Мn − все це сталося у 2-ій половині XVIII ст. Важливим був і дальший (після кисню) пошук Шееле:
1774 − хлор: МnO2 + HC1(к) = МnС12 + Н2O + С12
1775 − розробив промисловий спосіб добування фосфору дією кислоти на обпалені кістки тварин:
Са3(РO4)2 + H2SO4 = Ca(H2PO4)2 + CaSO4
Са(Н2РO4)2 = Са(РO3)2 +H2O
Са(РO3)2 + С = Са3(РO4)2 + Р + CO.
Він же відкрив і гліцерин (1779): нагрівав оливкову олію зі свинцевим глетом. Група органічних кислот була ним значно розширена − винна, молочна, цитринова, оксалатна (окисненням цукру нітратною кислотою), слизева, сечева, галлева, бензойна, ціанідна:
K4[Fe(CN)6] + H2SO4(p.) = K2SO4 + K2Fe[Fe(CN)6] + HCN.
Хоча процеси бродіння використовувались уже давно, хіміки вважали, що до складу спирту входять олія і вода. Лише Лавуазьє показав, що (як і для інших органічних речовин) складові частини − це С, О, Н. З кислот і спиртів отримували рідкі ефіри (головно, Шееле).
На підставі цього всього накопичилось достатньо даних, щоби провести різницю між неорганічними й органічними речовинами (Берґман,1784). Проте вважалося, що перші і другі не піддаються взаємоперетворенню. Лише 1828 р. Велер спростував це, здобувши штучно сечовину.
У цей період також істотно розвивалась фармацевтична хімія. Були отримані важливі солі: K2SO4, MgSO4 (гірка або англійська сіль, бо в природі її знаходили в англійських озерах), MgCl2 (біла магнезія), FeCl3.
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 910; Нарушение авторских прав?; Мы поможем в написании вашей работы!