
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Введение. Заблуждения Нильса Бора
|
|
|
|
Заблуждения Нильса Бора
ВТОРАЯ ЛЕКЦИЯ
Сейчас мы попытаемся найти истоки заблуждений Нильса Бора, в результате которых сформировалось ошибочное представление об орбитальном движении электронов в атомах. Начало этих заблуждений связано с ошибками, скрытыми в анализе спектра атома водорода [1], [2].
Спектроскописты - экспериментаторы зарегистрировали уже сотни тысяч спектральных линий атомов, ионов и молекул. Это самый большой массив экспериментальной информации о микромире [3], [4]. Поэтому для формирования правильных представлений о микромире правильная интерпретация спектров имеет исключительно важное значение. Сейчас мы увидим, как неправильная интерпретация спектра атома водорода укрепила ошибочную идею об орбитальном движении электрона в атоме. Известно, что сделал это Нильс Бор, за что и получил в 1922 г. Нобелевскую премию с такой формулировкой: «За заслуги в изучении строения атома» [5]. Поэтому есть основания показать его ошибку и исправить её.
В основе этой ошибки лежит ошибочная идея Луи Де Бройля о волновой природе электрона, за что он получил Нобелевскую премию в 1929 г. Со следующей формулировкой: «За открытие волновой природы электрона» [5]. В последующих лекциях мы детально опишем электромагнитную структуру электрона и покажем, что это частица, а не волна. Дифракционные картины формируются в результате взаимодействия спинов элементарных частиц в момент пересечения их траекторий движения. Поэтому указанные картины не имеют никакого отношения к волновым свойствам элементарных частиц [2].
Таким образом, в соответствии с ошибочной идеей Луи Де Бройля в окружности радиуса  , описываемой электроном при его орбитальном движении, укладывается целое число
, описываемой электроном при его орбитальном движении, укладывается целое число 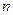 волн
волн 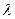 электрона. На основании этого имеем [6]
электрона. На основании этого имеем [6]
 . (16)
. (16)
Представим это равенство так
 . (17)
. (17)
Учитывая, что 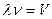 и
и  , получаем постулированное соотношение Нильса Бора
, получаем постулированное соотношение Нильса Бора
 . (18)
. (18)
Далее, из законов Кулона и Ньютона следует равенство между кулоновской электростатической силой 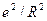 и ньютоновской силой инерции
и ньютоновской силой инерции  , действующей на электрон при его орбитальном движении в атоме
, действующей на электрон при его орбитальном движении в атоме
 . (19)
. (19)
Решая уравнения (18) и (19) совместно, найдем
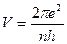 . (20)
. (20)
 . (21)
. (21)
Тогда формула для кинетической 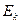 энергии электрона в его орбитальном движении становится такой
энергии электрона в его орбитальном движении становится такой
 . (22)
. (22)
Это в два раза меньше, чем в выражении (19) и мы не знаем почему? Тем не менее, можем написать уравнения кинетических энергий электрона, в момент пребывания его на орбитах  и
и  :
:
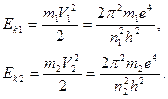 (23)
(23)
Разность этих энергий равна энергии  излученного или поглощенного фотона. При этом считается, что масса электрона не изменяется
излученного или поглощенного фотона. При этом считается, что масса электрона не изменяется  . С учетом этого имеем
. С учетом этого имеем
 (24)
(24)
Это и есть Боровская формула для расчета спектра атома водорода, полученная из орбитального его движения вокруг ядра, то есть – протона [7]. Считается, что выражение 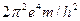 равно энергии ионизации
равно энергии ионизации 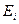 [7]. Тогда энергия
[7]. Тогда энергия  излученного или поглощенного фотона определится по формуле
излученного или поглощенного фотона определится по формуле
 . (25)
. (25)
Логичность изложенного и связь теоретического результата с экспериментом не оставляют сомнений в том, что формула (25) реально отражает процесс орбитального движения электрона в атоме водорода.
И все - таки, у нас есть основания для сомнения. Первое из них. А если в атоме не один электрон, а несколько или несколько десятков, то, как они могут соединять атомы в молекулы, летая по орбитам??? Ответа нет.
Далее, при переходе с орбиты на орбиту у электрона должна меняться сила связи с ядром. Поэтому должна существовать энергия, соответствующая этой силе, и она обязательно должна содержаться в спектрах атомов. Причем, должен быть закон зависимости этой энергии от номера орбиты, на которой находится электрон, то есть от величины 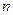 . Все это даёт нам основание полагать, что формула (25) для расчета спектров имеет еще один вывод и не исключено, что в этом выводе будет другой физический смысл. Сейчас мы найдем новый вывод этой формулы и увидим, что у электрона нет энергии, соответствующей его орбитальному движению, но есть энергия связи его с ядром атома.
. Все это даёт нам основание полагать, что формула (25) для расчета спектров имеет еще один вывод и не исключено, что в этом выводе будет другой физический смысл. Сейчас мы найдем новый вывод этой формулы и увидим, что у электрона нет энергии, соответствующей его орбитальному движению, но есть энергия связи его с ядром атома.
Предварительно отметим, что идеи Бора об орбитальном движении электрона в атоме нашли последователей и получили дальнейшее развитие в тупиковом направлении. Наибольший вклад в это направление внесли Э. Шредингер и П. Дирак, которые получили Нобелевские премии в 1933 г с такой формулировкой: «За открытие новых форм атомной теории», фактически за развитие ошибочных идей Бора [5]. Нобелевская премия, выданная П. Паули в 1945 г «За открытие принципа, названного его именем (принципа Паули)», окончательно закрепила ошибочную идею Бора об орбитальном движении электрона в атоме [5].
Венцом теории спектроскопии считается уравнение Э. Шредингера [8], [9], [11], [12], [13]. Оно позволило рассчитать спектры всех водородоподобных атомов (атомов с одним электроном) и анализировать вероятностное поведение электрона в атоме. Однако возможности уравнения Э. Шредингера оказались весьма ограниченными. Спектры всех последующих электронов, считая от ядра атома, с помощью уравнения Э. Шредингера уже не рассчитываются точно. В этих случаях, как отмечено в фундаментальной работе [10], для расчета спектров атомов и ионов привлекаются приближенные методы, которые основаны на уравнениях Э. Шредингера и Д. Максвелла.
Эмпирический характер приближенных методов затрудняет формирование представлений о взаимодействии электрона с ядром атома. В силу этого в современной Квантовой физике в соответствии с принципом В. Паули электроны распределяются по оболочкам, уровням и подуровням [14].
Особо отметим, что польза от приближенных методов расчета спектров атомов, ионов и молекул близка к нулю. Полезными можно признать лишь те методы, которые позволяют устанавливать закономерность формирования энергий связей между ядрами атомов и их электронами, а также между валентными электронами атомов в молекулах [1], [2].
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 507; Нарушение авторских прав?; Мы поможем в написании вашей работы!