
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водород
|
|
|
|
Атом водорода по сравнению с атомами других элементов наиболее простой по структуре: 1s1. Но это, конечно, не означает, что его химия наиболее проста. Наоборот, она во многом отличается от химии других элементов. Основная особенность атома водорода заключается в том
- что в отличие от всех других элементов (кроме гелия) его валентный электрон находится непосредственно в сфере действия атомного ядра
- у него нет промежуточного электронного слоя. Положительный ион водорода Н+ представляет собой элементарную частицу – протон.
Особенность строения электронной оболочки атома водорода (как и гелия) не позволяет однозначно решить, в какой группе периодической системы он должен находиться. Действительно, если исходить из числа валентных электронов его атома, то водород должен находиться в I группе, что подтверждается также сходством спектров щелочных металлов и водорода. Со щелочными металлами сближает водород и его способность давать в растворах гидратированный положительно однозарядный ион Н+ (р). Однако в состоянии свободного иона Н+ (р) – протона – он не имеет ничего общего с ионами щелочных металлов. Кроме того, энергия ионизации атома водорода намного больше энергии ионизации атомов щелочных металлов.
Если же исходить из того, что для завершения внешнего электронного слоя атому водорода не хватает одного электрона, то водород следует поместить в УII группе. Кроме того, как и атомы галогенов, атомы водорода характеризуются высокими значениями энергии ионизации. Многие ученые помещают водород в УII группу периодической системы. Вместе с тем водород элемент особый, и размещение его в той или иной группе таблицы в значительной мере условно.
Энергия ионизации атома водорода (13,6 эВ, 1312 кДж/моль) столь велика, что соединения водорода (I) даже с такими сильными окислителями, как фтор и кислород, не могут быть ионными. Если же допустить образование в соединениях ионов Н+, их исключительно высокое поляризующее действие все равно привело бы к образованию ковалентной связи. По этим же причинам ионы Н+ не могут существовать в свободном состоянии при обычных химических явлениях. Специфика строения атома водорода обусловливает особый, присущий - только соединениям водорода (I) вид химической связи - водородную связь
Процесс образования отрицательного нона Н- из атома экзотермический (сродство к электрону 0,75 эВ), поэтому для водорода в степени окисления -1 возможны ионные соединения.
Таким образом, водород – неметаллический элемент. В соединениях он может иметь степени окисления -1 и +1. Для него, как и для галогенов, характерны ионные соединения, в которых он выступает в качестве простого иона Н-. При положительной степени окисления водород образует только ковалентные соединения и может играть роль комплексообразователя в анионных комплексах.
Водород широко распространен в природе. Содержание его в земной коре (атмосфера, литосфера и гидросфера) составляет 3,0 мол. доли, %. Он входит в состав воды, глин, каменного и бурого угля, нефти и т.п., а также во все животные и растительные организмы. В свободном состоянии водород встречается крайне редко (в вулканических и других природных газах). Водород – самый распространенный элемент космоса: он составляет до половины массы Солнца и большинства звезд. Гигантские планеты солнечной системы Юпитер и Сатурн в основном состоят их водорода. Он присутствует в атмосфере ряда планет, в кометах, газовых туманностях и межзвездном газе.
Водород имеет три изотопа с массовыми числами соответственно 1, 2, 3:
1Н р (e) протий
2D (2H) (p+n)e дейтерий
3T (3H) (p+2n)e тритий
Протий и дейтерий – стабильные изотопы. Нормальный изотопный состав природных соединений водорода соответствует отношению D:H =1:6800 (по числу атомов). Тритий – бета-радиоактивен. Период полураспада Т1¤2 = 12,26 года:
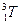 =
= 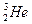 + b-
+ b-
Полагают, что эта реакция – главный источник изотопа 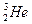 , найденного в атмосфере. Содержание трития в атмосферном водороде составляет 4×10-15 мол. доли, %, и в атмосферных осадках» 3×10-18 мол. доли, %. Очевидно, олн образуется в результате ядерных реакций, вызванных действием космических лучей. Тритий можно искусственно получить 6Li (n, a) 3T.
, найденного в атмосфере. Содержание трития в атмосферном водороде составляет 4×10-15 мол. доли, %, и в атмосферных осадках» 3×10-18 мол. доли, %. Очевидно, олн образуется в результате ядерных реакций, вызванных действием космических лучей. Тритий можно искусственно получить 6Li (n, a) 3T.
Простые вещества.  Имея один электрон, водород образует лишь двухатомные молекулы с электронной конфигурацией невозбужденного состояния
Имея один электрон, водород образует лишь двухатомные молекулы с электронной конфигурацией невозбужденного состояния 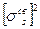 . При этом возможны молекулы легкого водорода – протия Н2, тяжелого водорода – дейтерия D2, T2, протодейтерия HD, прототрития HT, дейтеротрития DT.
. При этом возможны молекулы легкого водорода – протия Н2, тяжелого водорода – дейтерия D2, T2, протодейтерия HD, прототрития HT, дейтеротрития DT.
Молекулы водорода отличаются большой прочностью и малой поляризуемостью, незначительными размерами и малой массой, а следовательно, и большой подвижностью. Поэтому у водорода очень низкая температура плавления (-259,1 оС) и кипения (-252,6 оС); он уступает в этом отношении лишь гелию. По тем же причинам он очень незначительно растворяется в воде и органических растворителях. У твердого водорода гексагональная решетка. Вследствие высокой энергии диссоциации (435 кДж/моль) распад молекул Н2 на атомы происходит в заметном количестве лишь при температуре выше 2000 оС.
Особенностью водорода является наличие двух сортов молекул: орто -формы о-Н2 (спины протонов параллельны), пара -формы р-Н2 (спины протонов антипараллельны). При комнатной температуре в равновесной смеси находится 75% о-Н2. При температуре близкой к 0 К смесь содержит только р-Н2.
Согласно теоретическим исследованиям при огромных давлениях водород должен переходить в металлическое состояние. При давлении около 2×1011 Па и при обычной температуре должно происходить превращение молекулярного водорода в атомарный. В этих условиях должна образоваться кристаллическая решетка, в узлах которой находятся протоны, а электроны стали общими; такой кристалл будет обладать металлической проводимостью.
Водород проявляет и восстановительные, и окислительные свойства. В обычных условиях благодаря прочности молекул он сравнительно мало активен и непосредственно взаимодействует лишь со фтором. При нагревании же вступает во взаимодействие с многими неметаллами — хлором, бромом, кислородом и пр. Восстановительная способность водорода используется для получения некоторых простых веществ из оксидов и галогенидов:
CuO + H2 = Cu + H2O
В качестве окислителя водород взаимодействует с активными металлами:
2Na + H2 = 2NaH
В промышленности водород получают главным образом из природных и попутных газов, продуктов газификации топлива (водяного и паровоздушного газов) и коксового газа. В основе производства водорода лежат каталитические реакции взаимодействия с водяным паром (конверсии) соответственно углеводородов (главным образом метана) и оксида (II) углерода, например:
800°С
СН4 + Н2О «СО + ЗН2, DН0298 = 206,2 кДж/моль;
600 °С
СО + Н2О «СО2 + Н2, DНо298 = — 41,2 кДж/моль.
Водород получают также неполным окислением углеводородов, например:
2СН4 + О2 = 2СО + 4Н2, DНо298 = —71,З кДж.
В связи с уменьшением запасов углеводородного сырья большой интерес приобретает метод получения водорода восстановлением водяного пара раскаленным углем:
С + Н2О = СО + Н2, DНо298 = 131,3 кДж/моль.
При этом образуется генераторный газ. Затраты энергии на его получение можно скомпенсировать за счет реакции неполного окисления угля:
2С + О2 = 2СО, DНо298 = -221,0 кДж.
При комбинировании этих двух процессов получается водяной газ, состоящий в основном из смеси Н2 и СО.
Из главных смесей с большим содержанием водорода его выделяют глубоким охлаждением смеси. Водород производят также электролизом воды. В лабораторных условиях водород получают взаимодействием цинка с соляной или серной кислотой.
Водород широко используется в химической промышленности для синтеза аммиака, метанола, хлорида водорода, для гидрогенизации твердого и жидкого тяжелого топлива, жиров и т. д. В смеси с СО (в виде водяного газа) применяется как топливо. При горении водорода в кислороде возникаёт высокая температура (до 2600°С), используемая для сварки и резки тугоплавких металлов, кварца и др. Жидкий водород используют как одно из наиболее эффективных реактивных топлив. В атомной энергетике для осуществления ядерных реакций большое значение имеют изотопы водорода — тритий и дейтерий.
В настоящее - время проблема использования водорода приобрела особое значение. Энергетический кризис, проблема защиты окружающей среды от непрерывного и угрожающего загрязнения нефтью и продуктами сгорания органических топлив — все это стимулирует резкое возрастание интереса к водороду как «экологически чистому» горючему. Водород основа химической технологии и энергетики будущего.
Соединения со степенью окисления водорода —1. В зависимости от природы связанного с ним элемента атомы водорода в соединениях могут быть поляризованы положительно (степень окисления +1) или отрицательно (степень окисления —1):
| LiH | BeH2 | B2H6 | CH4 | H3N | H2O | HF |
| NaH | MgH2 | AlH3 | SiH4 | H3P | H2S | HCl |
| KH | CaH2 | GaH3 | GeH4 | AsH3 | H2Se | HBr |
| RbH | SrH2 | InH3 | SnH4 | SbH3 | H2Te | HI |
| CsH | BaH2 | |||||
| соединения Н-1 | промежуточные соединения | соединения Н+1 |
Кроме того, имеется группа соединений в которых связь Э — Н близка к неполярной. Эти соединения в соответствующих условиях можно
рассматривать и как производные Н+1, и как производные Н-1.
В тех случаях, когда водород выступает в качестве окислителя, он ведет себя как галоген, образуя аналогичные галидам гидриды.
Однако образование иона Н- из молекулы Н2 – процесс эндотермический (энтальпия образования Н- составляет DНо298 = + 150,5 кДж/моль):
½ H2 (г) = Н (г), DНо298 = 217,4 кДж/моль
Н (г) + e = Н- (г), DНо298 = -66,9 кДж/моль
___________________________________________________________
½ H2 (г) + e = Н- (г), DНо298 = 150,5 кДж/моль
Поэтому по окислительной активности водород существенно уступает галогенам. По этой же причине ясно выраженный ионный характер проявляют лишь гидриды наиболее активных металлов — щелочных и щелочноземельных, например КН и СаН2,
Ионные гидриды представляют собой белые кристаллические вещества с высокими температурами плавления, т. е. соли. Их расплавы характеризуются высокой электрической проводимостью, при электролизе расплавленных гидридов водород выделяется на аноде. Гидриды s -элементов I группы, как и большинство галидов этих элементов, имеют структуру типа NаСI. В химическом отношении ионные гидриды ведут себя как основные соединения.
К ковалентным относятся гидриды менее электроотрицательных, чем сам водород, неметаллических элементов. К ковалентным относятся, например, гидриды состава SiН4 и ВH3. По химической природе гидриды неметаллов являются кислотными соединениями.
Различие в химической природе гидридов можно легко установить по их поведению при гидролизе. Характерной особенностью гидролиза гидридов является выделение водорода. Реакция протекает по окислительно-восстановительному механизму. Отрицательно поляризованный атом Н-1 в гидриде и положительно поляризованный атом Н+1 в воде переходят в состояние с нулевой степенью окисления:
KH-1 + H+1OH = KOH + H2o; SiН4-1 + 3Н+1ОН = H2SiO3 + 4Н2o.
За счет выделения водорода гидролиз протекает полностью и необратимо (DН < 0, DS > 0). При этом основные гидриды образуют щелочь, а кислотные — кислоту.
Различие между основными и кислотными гидридами отчетливо проявляется также при их взаимодействии между собой, Например, по схеме
LiH + BH3 = Li[BH4]
основной кислотный тетрагидридоборат лития
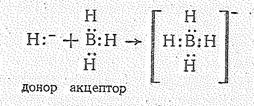
|
Понятно, что эта реакция может протекать лишь в неводных средах, например в эфире. Гидрид лития, передавая в комплекс нон Н-1, выступает как донор электронной пары, а ВН3, присоединяющий гидрид-ион, является акцептором.
В качестве амфотерного соединения можно рассматривать гидрид алюминия АIН3 (алан), который зависимости от партнера по реакции может выступать и как донор электронных пар (основное соединение), и как акцептор (кислотное соединение):
АIН3 + 3ВН3 = А1(ВН4)3
основный тетрагидридоборат алюминия
(смешанный гидрид )
КН + А1Н3 = К[АIН4]
кислотный тетрагидридоалюминат калия
Стандартный потенциал системы 1 / 2Н2 / Н- равен -2,23 В. Следовательно, ион Н- – один из самых сильных восстановителей.
|
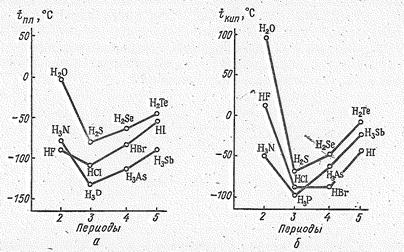
Рис. 1. Температуры плавления (а) и температуры кипения (б) водородных соединений р -элементов VII, VI, V групп.
Поэтому ионные, а также комплексные гидриды — сильные восстановители. Они находят широкое применение для проведения различных синтезов, для получения водорода и в химическом анализе. Гидрид кальция СаН2 применяется, кроме того, в качестве осушителя для удаления следов влаги.
Соединения водорода (I). Положительная поляризация атомов
водорода наблюдается в его многочисленных соединениях с ковалентной связь-ю: при обычных условиях это газы (НСI, Н2S, Н3N.]), жидкости (Н2О, НF, Н2SO4), твердые вещества (Н3РО4, Н2SiО3 ). Свойства
этих соединений сильно зависят от природы элемента, с которым непосредственно связан водород. В частности, для соединений, содержащих связи F – Н, О–Н и N–Н, особо характерна водородная связь. Вследствие этого НF, Н2O и Н3N проявляют аномально высокие температуры плавления и кипения по сравнению с однотипными бинарным соединениями водорода, образованными остальными элементам данной группы (рис. 1). Аналогичный ход кривых наблюдается и в величинах энтальпий испарения этих соединений.
Вследствие способности образовывать водородные связи и вступать в донорно-акцепторное взаимодействие жидкие НF, Н2О и Н3N являются хорошими ионизирующими растворителями.
Присущая водороду, как неметаллическому элементу, тенденция к образованию анионных комплексов — гидрогенатов реализуется, например, в следующих реакциях:
KF + HF = K[HF2]; KNO3 + HNO3 = K[H(NO3)2]
дифторогидро динитратогидрогенат
генат калия калия
Гидрогенат-комплексы образуются за счет водородной связи: [F×××
Н×××F]- ; [ O2NO×××Н×××ONO2 ]-. Они имеют линейное строение. Их образование можно объяснить следующим образом. Орбитали иона НF2- возникают за счет линейной комбинации орбитали центрального атома js (1 s -орбиталь Н) и групповых орбиталей периферических атомов j1, j2 (2 р x – орбиталей двух атомов F):
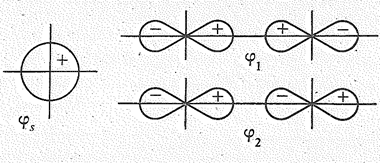
|
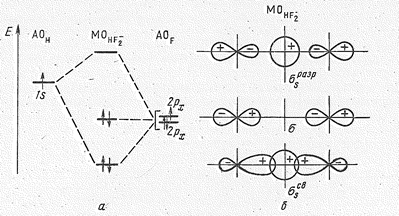
По условиям симметрии сочетание js и j1 -орбиталей приводит к образованию связывающей jsсв - и разрыхляющей jsразр- МО иона НF2- (рис. 2).
y (ssсв) ~ js + j1;
y(ssразр) ~ js - j1.
Для групповой орбитали j2 подходящей по условиям симметрии орбитали центрального атома нет, поэтому в ионе НF2- орбиталь j2 играет роль несвязывающей (рис. 2). Четыре электрона (один от атома Н, два от двух атомов F и один за счет заряда иона) распределяются на связывающей ss и несвязывающей s молекулярных орбиталях. Нахождение электронов на молекулярной s -несвязывающей орбитали соответствует концентрации избыточного отрицательного заряда на концевых атомах. Следовательно, гидрогенат-ионы типа НХ2- должны быть наиболее стабильными в том случае, когда Х – наиболее электроотрицательные атомы или их группировки. Так, в ионе НF2- связь почти в три раза прочнее межмолекулярной водородной связи.
Большинство гидрогенатов может существовать лишь в неводных или насыщенных водных растворах, а также в твердом состоянии.
Атомы водорода входят также в состав гидросолей типа NаНS, NаНСО3, NаНSO4. Группы НS-, НСО3-, НSO4- могут существовать в растворах в виде свободных ионов, называемых соответственно гидросульфид-, гидрокарбонат- и гидросульфат-ионами.
|
Рис. 2. Энергетическая диаграмма орбиталей (а) и схема их образования (б) для иона НF-2.
Структура солей в твердом состоянии также обусловливается водородной связью. Ниже схематически показана структура гидрокарбоната натрия NаНСО3:

|
Металлические соединения водорода. Металлическими свойствами обладают водородные соединения d- и f-элементов. Эти соединения получаются в виде металлоподобных темных порошков или хрупкой массы, их электрическая проводимость и теплопроводность типичны для металлов. Это гидриды нестехиометрического состава. Идеализированный состав металлических гидридов чаще всего отвечает формулам МН (VН, NbН, ТаН), MН2 (ТiН2, ZгН2, НfH2, SсН2) и МН3 (UН3, РаН3).
О характере связи в гидридах d- и f-элементов существуют две теории. В соответствии с одной из них водород входит в решетку в виде нона Н+, а свой электрон отдает в зону проводимости металлической структуры. Согласно другой теории атомы водорода берут электроны из зоны проводимости и находятся в кристаллической решетке гидрида в виде гидрид-ионов Н-. Можно думать, что в периодической системе от Iк V группе имеет место постепенный переход от ионных гидридов (типа солей) к гидридам, в которых водород находится в виде Н+.
Следует отметить, что первые три металла каждого семейства d-элементов (т. е. Sс, Тi и V; Y, Zг и NЬ; Lа, Нf и Та) поглощают водород со значительным:экзотермическим эффектом. Например, энтальпии образования их некоторых гидридов имеют следующие значения:
ScH2 YH2 LaH2 TiH2 ZrH2
DHof, кДж/моль. -69,5 -185,6 -207,7 -144,2 -169,3
d-Металлы VI—VIII групп по отношению к водороду малоактивны, Так, энтальпия образования FеН2 всего —0,84 кДж/моль. Исключение составляет палладий, который поглощает водород очень активно, Аномальное поведение палладия связывают с его уникальной электронной конфигурацией (4d10 —провал» двух 5s-электронов).
Гидриды образуются из простых веществ с понижением энтропии, так как исходные вещества твердое и газообразное, а конечный продукт твердый. Поэтому синтезом из водорода и металла можно получить только те соединения, образование которых сопровождается выделением большого количества теплоты, В противном случае гидриды d- и f-элементов можно получить лишь косвенным путем.
Металлические гидриды используются как восстановители для получения покрытия из соответствующего металла, а также для получения металлов в виде порошков. В последнем случае металл, например Тi или V, насыщают водородом, образовавшийся хрупкий гидрид растирают в порошок и нагревают в вакууме, в результате чего получают порошок металла. Вследствие пластичности чистых металлов получить их порошки простым растиранием металлов не удается. Гидриды используют также в реакциях гидрирования, синтеза многих соединений d- и f-элементов. Гидрид титана представляет интерес в качестве «хранилища» водорода.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2194; Нарушение авторских прав?; Мы поможем в написании вашей работы!